FKBP11下调对肾癌细胞增殖、迁移、侵袭及TGF-β1/Smad3通路的影响
张苗,何德娇,凌娜,李小丽,梁轶岚,张丽丽,胡威
肾细胞癌(renal cell carcinoma,RCC)简称肾癌,是常见的恶性肿瘤[1]。RCC对化疗和放疗的敏感性低,仅有少数患者可通过免疫治疗获效[2]。RCC患者5年生存率相对较低,尤其是RCC伴转移患者5年生存率不超过10%[3]。FK506结合蛋白(FK506-binding proteins,FKBPs)在多种肿瘤细胞的发生发展中具有重要作用,参与调控癌细胞增殖、侵袭及迁移等[4-6]。FK506结合蛋白11(FK506-binding protein 11,FKBP11)的基因表达水平与RCC患者的预后密切相关,可作为潜在标志物评估RCC患者的预后[7]。转化生长因子-β1(transforming growth factor-β1, TGF-β1)/Smad同源物3(mothers against decapentaplegic homolog 3, Smad3)信号通路参与调控肿瘤细胞的增殖、侵袭和迁移等过程[8-9]。本研究通过观察下调FKBP11对RCC细胞增殖、侵袭和迁移及TGF-β1/Smad3通路的影响,探讨其在RCC中可能的作用机制,报道如下。
1 材料与方法
1.1 材料 (1)细胞:人正常肾小管上皮细胞系HK-2和RCC细胞系A498、ACHN、CaKi-1、786-O均购自美国ATCC细胞库。(2)试药、剂试:DEME培养基、胰蛋白酶及CCK-8试剂盒均购自美国BPB公司;Lipofectamine 2000试剂盒购自美国Invitrogeng公司;Trizol试剂、qRT-PCR反应试剂盒、LY364947(TGF-β1/Smads通路抑制剂)、ECL发光试剂及结晶紫均购自美国Sigma公司;FKBP11 siRNA(si-FKBP11)和其阴性对照siRNA购自广州Ruibo公司;Transwell小室购自美国Corning公司;一抗兔抗人FKBP11、增殖细胞核抗原(PCNA)、E-钙黏蛋白(E-cadherin)、波形蛋白(Vimentin)、凋亡抑制蛋白(Twist)、锌指转录因子(Snail)、TGF-β1、β-actin、Smad3及磷酸化Smad3(p-Smad3)均购自英国Abcam公司;所用引物由上海生工生物工程有限公司合成。(3)仪器、设备:MG80型二氧化碳细胞培养箱购于上海冠森生物科技有限公司;MultiskanTMFC型酶标仪、Applied Biosystems型qRT-PCR仪、NERLTM型流式细胞仪及E-Gel Imager型凝胶成像仪均购自美国Themo Fisher Scientific公司,TS100型倒置显微镜购自日本Nikon公司。
1.2 实验方法 2020年3月—2021年3月于武汉大学人民医院生物实验室进行实验。
1.2.1 细胞培养:人正常肾小管上皮细胞系(HK-2)和RCC细胞系(A498、ACHN、CaKi-1、786-O)培养于DEME培养基(含10%胎牛血清)中,在含5% CO2、饱和湿度的37℃恒温细胞培养箱中培养。根据细胞生长状态,细胞融合程度超过80%以上时,更换培养基传代培养。用于检测FKBP11的mRNA和蛋白表达水平。
1.2.2 细胞分组与转染:取对数期且生长状态良好的786-O细胞,以2×105个/ml的细胞密度接种于6孔细胞培养板中,当细胞融合达到80%时,将细胞分为4组,正常培养细胞作为空白组,其余3组按照Lipofectamine 2000试剂盒说明书分别转染阴性对照siRNA、si-FKBP11及si-FKBP11+LY364947 3 μl[9],依次作为对照组、si-FKBP11组和si-FKBP11+LY364947组,转染24 h后检测各组细胞中FKBP11 mRNA和蛋白表达水平。
1.3 观测指标与方法
1.3.1 不同细胞系中FKBP11的mRNA表达水平检测:收集HK-2和RCC细胞,加入Trizol裂解液裂解细胞,提取细胞的总RNA,将RNA反转录形成cDNA,通过荧光定量PCR测定FKBP11的mRNA表达水平。实时荧光定量PCR(qRT-PCR)反应程序为:95℃ 30 s,95℃ 5 s、56℃ 30 s、72℃ 30 s,共40个循环。FKBP11引物:上游5’-GGCGTAGGCGATTGGTTCCTA-3’,下游5’-CCATTCCATTCAT-TTCTCTGGATCG-3’。GAPDH(内参)引物:上游5’-CCCATGGCAAGTTCAAAGGCA-3’,下游5’-TGGTGAAGACGCCAGTAGATT-3’。以2-△△CT计算细胞中FKBP11的mRNA相对表达量。
1.3.2 免疫印记(Western-blot)检测细胞中蛋白表达水平:蛋白裂解液从细胞中提取总蛋白。取蛋白样品使用SDS-PAGE胶电泳分离100 min,通过湿转法将蛋白转移到PVDF膜上,随后添加5%脱脂牛奶在室温下封闭2 h,随后加入一抗:FKBP11、PCNA、E-cadherin、Vimentin、Twist、Snail、TGF-β1、Smad3、p-Smad3和β-actin低温过夜孵育,添加二抗孵育2 h,添加ECL化学发光混合液反应5 min,在凝胶成像仪中观察拍照。使用Image J软件分析条带灰度值。蛋白相对表达水平=目的蛋白条带灰度值/β-actin蛋白的灰度值。
1.3.3 786-O细胞增殖检测:CCK-8法检测细胞增殖活力。取各组处于对数期生长的786-O细胞,以细胞密度为5×103个/ml接种到96孔细胞培养板中,培养24、48、72 h时,每孔依次添加CCK-8溶液10 μl,再继续在培养箱中培养2 h后,使用酶标仪在450 nm波长下检测各孔的光密度值(IOD),以光密度值来表示细胞的增殖活力。
集落形成实验检测各组细胞集落形成情况,各组处理后的786-O细胞1×103个接种在6孔板中孵育2周。4%多聚甲醛固定细胞后通过1%结晶紫染色,通过显微镜拍照集落形成情况。对超过50个细胞的集落进行统计。
1.3.4 Transwell小室实验检测各组786-O细胞的侵袭和迁移数目:在Transwell小室中预涂Matrigel基质胶50 μl,干燥备用。取各组处于对数期生长的786-O细胞,添加无血清的培养基重悬调整细胞密度为2.5×104个/ml,后吸取细胞悬浮液200 μl接种Transwell小室上室中,下室添加含10%胎牛血清的完全培养基,培养24 h后,取出小室,使用PBS冲洗2~3次,添加甲醇固定细胞,后用棉签轻轻擦拭掉上室细胞,将下室细胞用1%结晶紫染色30 min,在显微镜视野下观察,分别选取左上、右上、中部、左下及右下5个视野,计算穿膜细胞数目。迁移实验不需要添加基质胶,其余操作方法同侵袭实验。
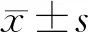
2 结 果
2.1 不同细胞系中FKBP11表达水平比较 与正常肾小管上皮细胞系HK-2比较,RCC细胞系A498、ACHN、CaKi-1、786-O中FKBP11 mRNA和蛋白表达水平显著上调(P<0.05),见图1、表1。其中FKBP11在786-O细胞中表达最高,故后续实验以786-O细胞为研究对象。
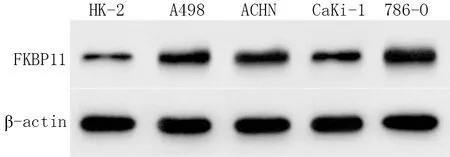
图1 Western blot检测RCC细胞与正常肾小管上皮细胞中FKBP11蛋白表达水平
表1 正常肾小管上皮细胞与RCC细胞中FKBP11表达水平比较
2.2 各组786-O细胞中FKBP11表达水平比较 与对照组比较,si-FKBP11组FKBP11 mRNA和蛋白表达水平显著下调(P<0.05);空白组与对照组,si-FKBP11组与si-FKBP11+LY364947组细胞中FKBP11的mRNA和蛋白表达水平比较差异无统计学意义(P>0.05),见图2、表2。
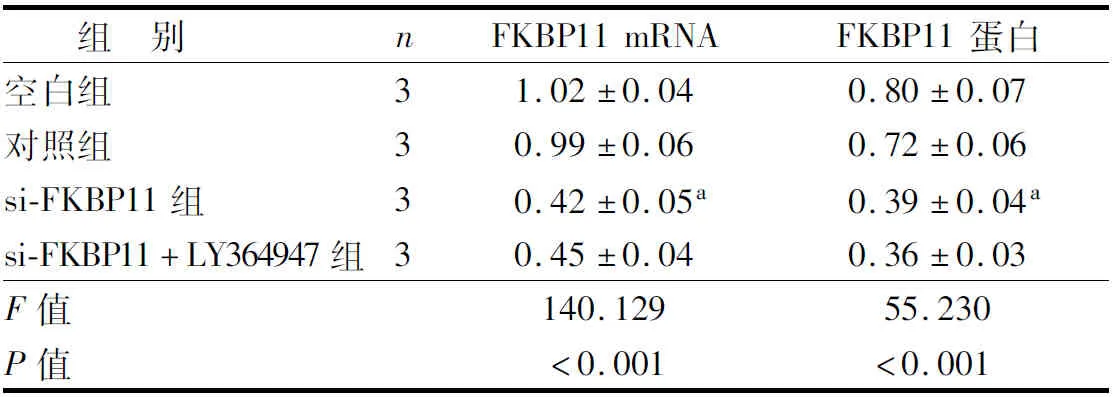
表2 各组786-O细胞中FKBP11 mRNA和蛋白表达水平比较
2.3 各组786-O细胞增殖活力比较 细胞培养24 h后,各组786-O细胞的增殖活力比较差异无统计学意义(P>0.05);培养48、72 h后,与对照组比较,si-FKBP11组786-O细胞增殖活力明显降低(P<0.05);与si-FKBP11组比较,si-FKBP11+LY364947组786-O细胞增殖活力明显降低(P<0.05);而空白组与对照组786-O细胞增殖活力比较差异无统计学意义(P>0.05)。此外,集落形成实验证实,与对照组比较,si-FKBP11组集落形成明显减少(P<0.05);与si-FKBP11组比较,si-FKBP11+LY364947组786-O细胞集落形成数量显著降低(P<0.05);而空白组与对照组786-O细胞集落形成数量比较差异无统计学意义 (P>0.05),见图3、表3。
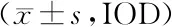
表3 各组786-O细胞增殖情况比较

A.空白组;B.对照组;C.si-FKBP11组;D.si-FKBP11+LY364947组

图3 集落形成实验检测细胞增殖比较
2.4 各组786-O细胞侵袭和迁移能力比较 与对照组比较,si-FKBP11组786-O细胞中侵袭和迁移细胞数目显著减少(P<0.05);与si-FKBP11组比较,si-FKBP11+LY364947组786-O细胞中侵袭和迁移细胞数目显著减少(P<0.05);而空白组与对照组786-O细胞中侵袭和迁移细胞数目比较差异无统计学意义(P>0.05),见图4、表4。

表4 各组786-O细胞侵袭和迁移细胞数目比较个)
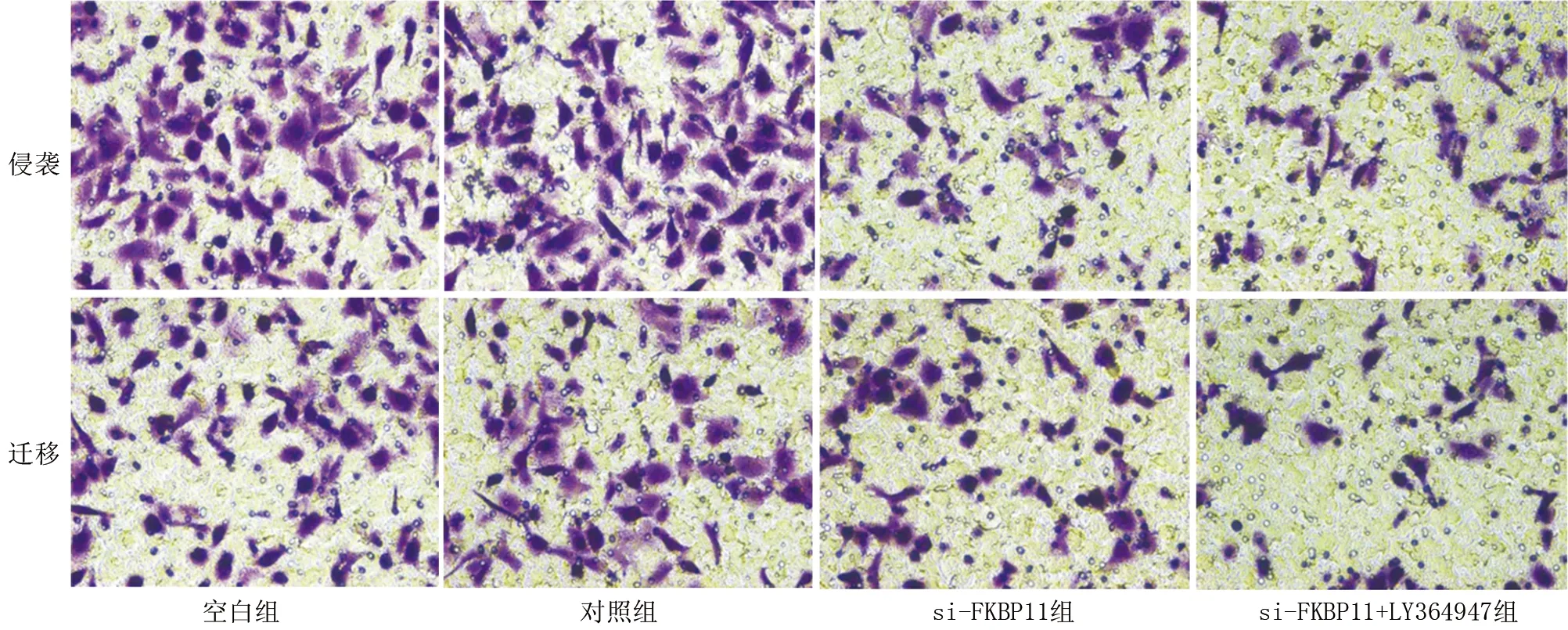
图4 各组786-O细胞侵袭和迁移实验结果比较(×200)
2.5 各组786-O细胞中PCNA、E-cadherin、Vimentin、Twist和Snail蛋白表达水平比较 与对照组比较,si-FKBP11组786-O细胞中PCNA、Vimentin、Twist和Snail蛋白水平显著降低(P<0.05),E-cadherin蛋白水平显著升高(P<0.05);与si-FKBP11组比较,si-FKBP11+LY364947组786-O细胞中PCNA、Vimentin、Twist和Snail蛋白水平显著降低(P<0.05),E-cadherin蛋白水平显著升高(P<0.05);而空白组与对照组786-O细胞中上述蛋白表达水平比较差异无统计学意义(P>0.05)。见图5、表5。

表5 各组786-O细胞中PCNA、E-cadherin、Vimentin、Twist和Snail蛋白水平比较
注:A.空白组;B.对照组;C.si-FKBP11组;D.si-FKBP11+LY364947组
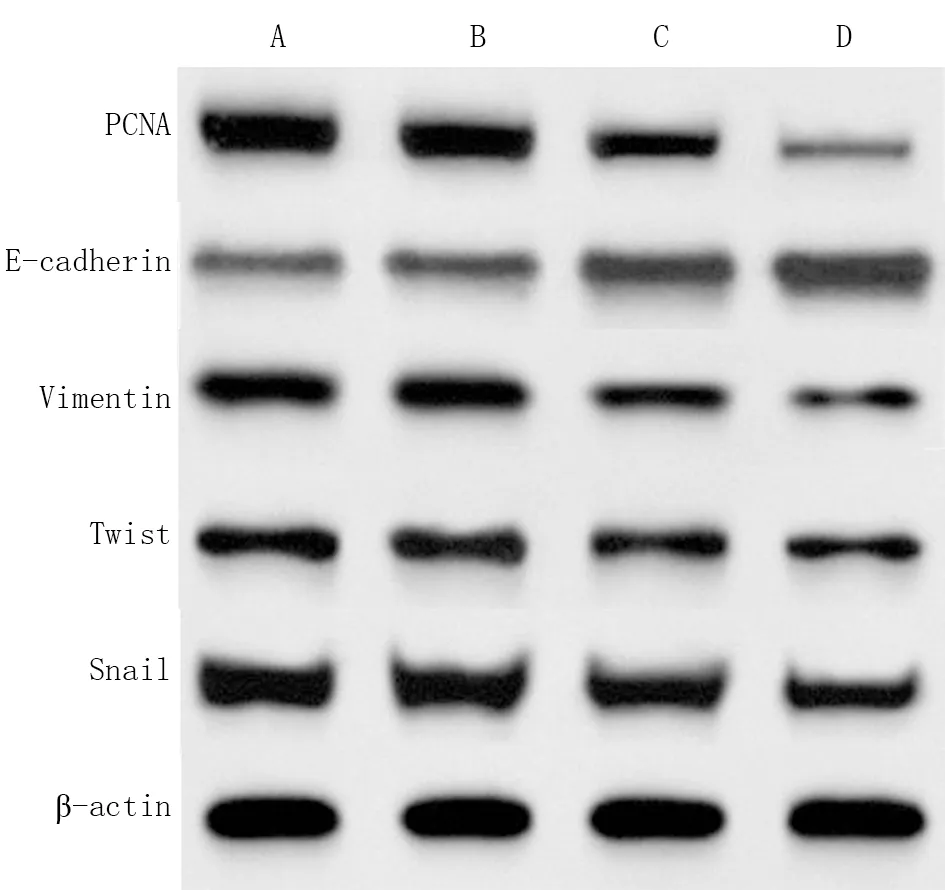
2.6 各组786-O细胞中TGF-β1、Smad3和p-Smad3蛋白表达水平比较 各组786-O细胞中Smad3蛋白表达水平比较差异无统计学意义(P>0.05)。与对照组比较,si-FKBP11组786-O细胞中TGF-β1和p-Smad3蛋白表达明显降低(P<0.05);与si-FKBP11组比较,si-FKBP11+LY364947组786-O细胞中TGF-β1和p-Smad3蛋白表达明显降低(P<0.05);而空白组与对照组786-O细胞中TGF-β1和p-Smad3蛋白表达水平比较差异无统计学意义(P>0.05)。见图6、表6。

表6 各组786-O细胞中TGF-β1和Smad3、p-Smad3蛋白水平比较
注:A.空白组;B.对照组;C.si-FKBP11组;D.si-FKBP11+LY364947组
3 讨 论
RCC发病率占成人恶性肿瘤的2%~3%,早期具有隐匿性,约30%的患者初诊时就已经发生转移[10-11]。传统的化学疗法和放射疗法对RCC治疗基本无效[2],因此发现新的有效的诊断方法和治疗方案尤为重要。
FKBPs是一类包含肽基普脯氨酸顺式/反式异构酶结构域的蛋白质家族,可参与多种生物学功能,如心脏调节功能、神经元的发育等,且与多种疾病的发生发展密切相关[7]。研究发现,FKBP11可参与蛋白质的折叠和分泌[12]。过表达的FKBP11是狼疮B细胞的特征之一,可破坏B细胞的耐受性并导致浆细胞分化[13]。另外,FKBP11表达可随着肝癌细胞的发展而逐渐增高,可成为肝细胞癌早期诊断的标志物之一[14]。此外,也有研究证明,FKBP11在肾透明细胞癌(ccRCC)组织中高表达,且其表达可随着ccRCC病理分级的增高而升高,与ccRCC的发生发展密切相关[7]。但关于FKBP11在RCC中的作用机制还未见详细报道。本研究结果显示,FKBP11在RCC细胞系中高表达,与以往研究相似[7],且在786-O细胞中FKBP11表达最高。进一步分析显示,FKBP11下调可抑制786-O细胞的增殖、侵袭和迁移能力。同时结果表明,敲低FKBP11可降低PCNA、Vimentin、Twist、Snail蛋白水平,上调E-cadherin表达。已知PCNA主要在细胞核中表达,其蛋白水平可用来评估细胞的增殖状态[15]。E-cadherin水平降低及Vimentin水平升高是上皮—间质转化(EMT)发生的重要标志[16]。以上结果说明,FKBP11可通过调控细胞行为相关蛋白的表达进而参与RCC的发生发展过程,但FKBP11在RCC中的作用机制尚不清楚。
肿瘤的发生发展是一个极为复杂的过程,可由多种信号通路参与调控,其中TGF-β1/Smad3信号通路为癌细胞发生发展的重要通路之一[17]。有研究证明,TGF-β1/Smad3促进肾脏炎性反应和纤维化发展[18]。此外有研究报道,雌激素受体β(ERβ)可通过激活TGF-β1/Smad3/miRNAs信号通路,进而影响EMT过程,促进RCC的侵袭和迁移作用,当此通路被抑制时,可逆转ERβ促进RCC发展过程,从而为有效抑制转移性RCC的新疗法提供基础[19]。据报道,Twist和Snail是TGF-β1/Smad3通路上游转录因子,当其水平升高可促进通路激活[20]。TGF-β1和p-Smad3的蛋白水平则可反映TGF-β1/Smad3通路状况,当二者水平增高时,表示此通路被激活,反之则为抑制[21]。本研究结果显示,敲低FKBP11表达抑制Twist、Snail、TGF-β1和p-Smad3蛋白水平,表明敲低FKBP11表达可能抑制TGF-β1/Smad3通路活化。进一步研究显示,TGF-β1/Smad3通路抑制剂部分逆转FKBP11下调对RCC细胞恶性行为及TGF-β1/Smad3通路的影响。以上结果表明,下调FKBP11抑制RCC细胞恶性细胞行为,可能与抑制TGF-β1/Smad3通路激活有关。
综上所述,下调FKBP11可抑制RCC细胞的增殖、侵袭和迁移,其机制可能与抑制TGF-β1/Smad3通路活化有关。然而本研究并未探究下调FKBP11影响RCC的发生发展过程是否还有其他通路的参与,还有待后续更深入的探究。
利益冲突:所有作者声明无利益冲突
作者贡献声明
张苗、张丽丽:构思、设计研究方案;何德娇、凌娜、李小丽:进行实验操作;梁轶岚、胡威:撰写论文,分析或解释数据;张苗:论文终审

