冠状动脉瘤样扩张患者血清Adropin蛋白、hs-CRP水平变化及相关性分析
王丽娜,马娜,刘燕,孙小刚
临床上将冠状动脉瘤样扩张(coronary artery ectasia,CAE)定义为冠状动脉弥漫性或局限性扩张超过邻近正常动脉直径的1.5~2.0倍[1-2]。CAE是一种非阻塞性、心肌缺血性冠状动脉疾病,可引发心功能不全、不稳定型心绞痛、急性心肌梗死等症状。CAE患者5年病死率约为29%,CAE合并冠心病后心血管事件发生率进一步增加,进一步探究CAE的发生、发展机制能有效地预防、诊治和改善CAE患者的预后[3-4]。目前CAE的发生涉及多种病理机制的共同参与,有研究指出血管内皮细胞受损及动脉粥样硬化可能是CAE的重要发病机制[5]。Adropin蛋白是最近报道的由能量稳态基因编码的肽类激素[6],它可通过增加内皮一氧化氮合酶表达,促进NO合成,从而发挥保护血管的作用[7-8]。高敏C反应蛋白(hs-CRP)作为一种机体非特异性炎性反应的敏感指标,与炎性反应及组织损伤程度呈正相关,是预测心血管疾病的重要危险因素[9]。本研究通过分析不同心绞痛患者血清Adropin、hs-CRP水平,探讨CAE与血清Adropin、hs-CRP的关系,以进一步了解CAE的形成、发展过程,以期将血清Adropin、hs-CRP作为诊断CAE的新型生物学标志物,为临床进一步预防和治疗CAE提供新的思路,报道如下。
1 资料与方法
1.1 临床资料 选取2019年4月—2021年10月因心绞痛就诊于甘肃省第二人民医院心内科并行冠状动脉造影(CAG)检查者340例为研究对象,根据CAG检查结果,以冠状动脉无异常者73例为对照组(NCA组),单纯冠状动脉瘤样扩张(CAE)组98例(A组),CAE合并阻塞性冠状动脉疾病(OCAD)组52例(B组),OCAD组117例(C组)。4组受试者性别、年龄、心脏病家族史、高血压、高血脂症及TC、HDL-C、LDL-C、TG水平比较,差异均无统计学意义(P>0.05),A组、B组、C组吸烟史、糖尿病史占比均高于NCA组(P<0.05),IL-6、TNF-α水平比较,A组>B组>C组>NCA组,组间两两比较差异有统计学意义(P<0.05),见表1。本研究经医院伦理委员会审核通过[(2022)伦审第(10号)],全部受试者及家属知情同意并签署知情同意书。
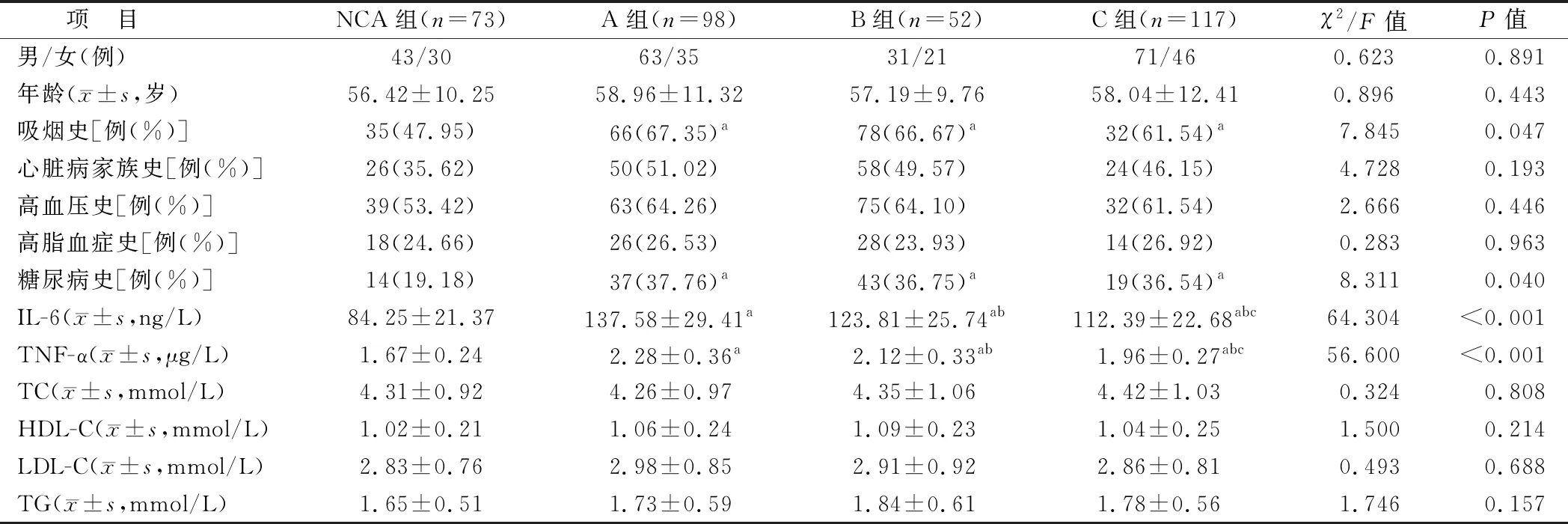
表1 4组受试者临床资料比较
1.2 病例选择标准 (1)纳入标准:①近期未遭遇创伤或接受过重大手术;②临床资料完整;③均行CAG检查;④心、肝、肾等重要脏器功能尚可。(2)排除标准:①合并急慢性感染、各种急性损伤者;②合并慢性肝、肾功能不全者;③合并心肌梗死、冠状动脉畸形等先天性畸形者;④合并免疫性疾病、恶性肿瘤者。
1.3 检测指标与方法
1.3.1 CAG检查:所有患者使用碘克沙醇造影剂,经右侧桡动脉路径,使用J型导丝送至主动脉根部,再置入多功能造影导管,退出导丝,旋转导管至左冠状动脉口,轻推入造影剂,确认导管位于左冠状动脉口后进行造影,同样的方法进行右冠状动脉口造影。每支血管均使用多体位透照。采用美国GE公司全数字化血管造影机,以15帧/秒记录、分析影像学资料。
1.3.2 血清Adropin、IL-6、TNF-α和hs-CRP水平检测:取各组受试者清晨空腹肘静脉血5 ml,在室温中静置30 min,离心留取上层血清置于-20℃待测。双抗体夹心酶联免疫吸附分析法(ELISA)检测血清Adropin、IL-6、TNF-α水平,试剂盒购自博辉生物科技(广州)有限公司。采用日本奥林巴斯AU640生化分析仪,以超敏乳胶增强免疫比浊法检测血清hs-CRP水平,试剂盒购自上海晶都生物技术有限公司。
2 结 果
2.1 各组冠状动脉造影结果及病变判断 A组(CAE)造影检查示:冠状动脉局部或弥漫性扩张超过邻近正常动脉直径的1.5~2.0倍;C组(OCAD)造影检查示:至少1支冠状动脉狭窄大于50%;B组(CAE合并OCAD)造影检查显示:在冠状动脉瘤样扩张的基础上合并有冠状动脉狭窄;NCA组造影检查示:冠状动脉无狭窄或狭窄小于50%,并且冠状动脉无扩张或扩张小于邻近正常动脉直径的1.5倍。
2.2 各组血清Adropin和hs-CRP水平比较 血清Adropin水平比较,A组
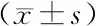
表2 4组受试者血清Adropin和hs-CRP水平比较
2.3 CAE患者血清Adropin与hs-CRP的相关性分析 Pearson相关分析显示,CAE患者血清Adropin与hs-CRP呈负相关(r=-0.522,P<0.001)。
2.4 CAE发生的影响因素Logistic回归分析 通过上述相关性分析,将吸烟史、糖尿病及血清IL-6、TNF-α、Adropin、hs-CRP纳入多因素Logistic模型,结果显示,有吸烟史、糖尿病及血清IL-6、TNF-α、hs-CRP水平高为CAE发生的独立危险因素(P均<0.05),血清Adropin水平高为CAE发生的独立保护因素(P<0.01),见表3。
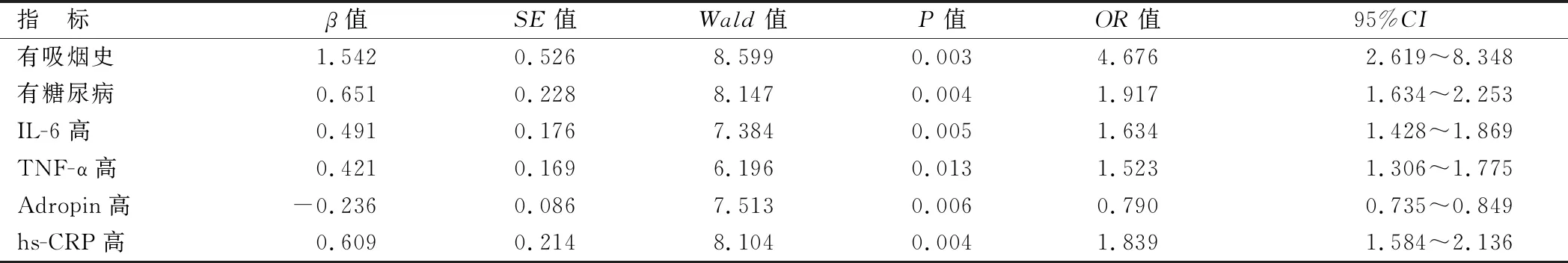
表3 影响CAE发生的多因素Logistic回归分析
3 讨 论
CAE患者冠状动脉中层结构和功能减弱,血管壁异常变薄,从而导致血管壁结构发生改变,局部扩张、膨出[10-12]。它涉及内皮功能障碍、冠状动脉粥样硬化、血小板功能和形态异常、炎性反应等多种病理学机制,其中血管内皮细胞受损及动脉粥样硬化在CAE的发生发展中起着重要作用[13-16]。本研究通过检测各组血清中代表血管内皮功能的Adropin和代表动脉粥样硬化的hs-CRP水平,结果发现Adropin蛋白、hs-CRP水平变化与冠状动脉瘤样扩张相关,且参与了其形成及发展,并为冠状动脉瘤的早期发现、后期干预治疗提供了理论依据。
最近研究表明,Adropin是一种分泌性蛋白,表达于脐静脉内皮细胞和冠状动脉内皮细胞中,可通过激活RISK信号通路促进内皮一氧化氮合成酶表达,增加循环NO含量,发挥血管内皮保护作用[17-18]。Adropin蛋白水平降低与内皮组织的NO生物利用率较少相关,而NO的生物利用率下降是内皮功能紊乱的重要特征[19]。本研究结果显示,A组、B组、C组、NCA组血清Adropin水平依次升高,组间两两比较差异有统计学意义,其中CAE患者血清Adropin水平最低,低水平Adropin导致其冠状动脉血管内皮保护功能下降,可能引发或加速CAE的形成。此外,血清Adropin水平高是CAE的独立保护因素,研究发现,内皮细胞经Adropin处理后,细胞增殖、迁移增加,细胞凋亡减少[20],结合本研究结果推测,Adropin水平具有预测CAE疾病进展的潜力,有望成为预防及治疗CAE的靶点。
动脉粥样硬化是成年人发生CAE的主要病因,而炎性反应贯穿于动脉粥样硬化斑块形成及发展的全过程,hs-CRP作为最敏感的炎性指标,与动脉粥样硬化的严重程度呈显著正相关[21-23],可以反映冠状动脉粥样硬化中炎性反应的过程,包括冠状动脉血管内皮的损伤、动脉粥样硬化的形成、发展与破裂,是预测心血管疾病的主要危险因素[24-25]。本结果显示,CAE患者扩张冠状动脉处存在严重的炎性反应,且hs-CRP水平随着炎性反应的增强而递增,在CAE组中炎性反应最强,炎性反应可损伤冠状动脉血管壁结构,过度降解细胞外基质蛋白,导致管壁扩张及重构[26]。hs-CRP亦通过加速血管内皮细胞损伤、加重动脉粥样硬化程度,从而导致冠状动脉血管壁扩张,引起CAE的发生及进展。因此,监测hs-CRP可以作为诊断冠状动脉瘤的辅助手段。本研究结果还显示,血管内皮功能与动脉粥样硬化之间存在着相互作用,二者可能共同影响血管内皮细胞,改变动脉血管壁结构,参与CAE的发展进程,这为冠状动脉瘤样扩张的治疗提供了理论依据。但二者之间的具体作用机制仍需进一步探究。
综上所述,CAE患者血清Adropin水平降低,hs-CRP水平升高,二者均是CAE的独立影响因素,临床可通过监测二者水平在一定程度上预测CAE的发生。且通过对Adropin蛋白及hs-CRP水平的检测发现,血管内皮细胞受损及动脉粥样硬化共同参与了冠状动脉瘤样扩张的发生、发展,为早期准确地判断冠状动脉瘤样扩张提供现实依据,为靶向药物治疗提供理论支持。
利益冲突:所有作者声明无利益冲突
作者贡献声明
王丽娜、马娜:设计研究方案,实施研究过程,论文撰写;刘燕:提出研究思路,分析试验数据,资料搜集整理;孙小刚:分析试验数据,资料搜集整理,进行统计学分析

