超短波联合夹脊穴针刺治疗寒湿证腰椎间盘突出症的疗效评价
李冉 张雯 李然
作者单位:473000 南阳市中医院针灸推拿科
腰椎间盘突出症(LDH)是临床脊柱外科常见的疾病,当患者腰椎间盘发生退行性改变后,导致其纤维环破裂,髓核突出从而压迫神经,使患者出现腰痛、下肢麻木、坐骨神经痛等症状。临床中LDH治疗方法有针灸、手术治疗、药物治疗等,虽然手术治疗、药物治疗比较成熟,但该病病程、康复周期较长,易复发。而超短波疗法是治疗LDH的一种物理疗法,能有效缓解患者疼痛程度,效果明显[1]。因此,选择一种更加有效的治疗方法对LDH具有重要作用。中医理论认为LDH属于“痹证”“腰痛”等范畴,临床根据其辨证分析,分为湿热型、寒湿型、血瘀型、肾阳虚型、肾阴虚型[2]。随着中国传统医学治疗的发展,针灸治疗因其方便快捷、快速等特点被广泛用于临床治疗LDH,能有效缓解腰痛、下肢麻木等表现。鉴于此,本研究主要探究超短波联合夹脊针椎间孔刺激法治疗寒湿证LDH患者治疗效果、疼痛介质、血液循环及炎性因子的影响。现报告如下。
1 资料与方法
1.1 一般资料 选择2019年12月至2021年10月于南阳市中医院就诊治疗的180例寒湿证LDH患者,根据治疗方法不同,分为对照组、观察组,各90例。两组性别、年龄、病程、突出部位比较,差异无统计学意义(P>0.05),见表1。
表1 两组患者一般资料比较[n,(±s)]

表1 两组患者一般资料比较[n,(±s)]
组别 例数 性别(男/女) 年龄(岁) 病程(年) 突出部位L3~4 L4~5 L5~S1观察组 90 57/33 27~58(40.64±5.96) 0.5~2.4(1.59±0.35) 9 56 25对照组 90 55/35 22~52(40.70±5.38) 0.5~2.5(1.65±0.42) 10 58 22统计值 0.095 0.066 1.158 0.279 P值 0.759 0.948 0.248 0.870
1.2 选取标准 纳入标准:均符合《实用外科学》中LDH诊断标准[3];均符合《中医内科学》中寒湿证LDH诊断标准[4];经CT检查确诊为LDH。排除标准:其他骨科疾病;腰椎脱落;近期内进行药物治疗。
1.3 方法 对照组给予超短波治疗,患者采取仰卧位,用UWM-02超短波治疗仪(日本丸高)进行治疗,设置频率为40.68 MHz,功率为250 W,波长7.37 m,然后将两个中号电极放置在患者腰椎棘突两侧,根据患者情况选择治疗剂量,每次治疗15 min,1次/d。治疗剂量分为无热量、微热量、温热量、热量,共4级。7 d为1个疗程,每个疗程结束后休息1 d。观察组在对照组基础上给予夹脊穴针刺治疗,患者采取仰卧位,可根据CT检查结果确定夹脊穴位置,在患者腰椎间盘突出部位棘突旁开1寸取穴,配合环跳、承山、阳陵泉、昆仑、委中、足三里等穴位针刺。皮肤消毒后,用提插手法进行针刺,出现酸麻胀感后,留针20 min,3次/周,为1个疗程。两组连续治疗3个疗程。
1.4 观察指标 ①临床疗效。显效:下肢及腰背疼痛、活动受限等症状明显缓解,中医证候积分减少>70%,且直腿抬高试验呈阴性;有效:下肢及腰背疼痛等症状有所改善,中医证候积分减少30%~70%,且活动部分受限制;无效:下肢及腰背疼痛、活动受限等症状无改善或加重,中医证候积分减少<30%。②比较治疗前、治疗后14 d、21 d中医证候积分、VAS评分。中医证候积分:主要从日轻夜重、腰腿疼痛程度、拒按、俯仰活动受限、腰部板硬5个方面评分,总分45分。VAS评分:总分10分,0分为无痛,1~3为轻微疼痛,且能耐受,4~6分为疼痛对睡眠有影响,但能耐受;7~10分为疼痛剧烈,无法耐受。③疼痛介质[5- 羟色胺(5-HT)、前列腺素E2(PGE2)、神经生长因子(NGF)]:取治疗前、治疗后14 d、治疗后21 d空腹静脉血,离心后用酶联免疫吸附法(ELISA)检测5-HT、PGE2、NGF。④血液流变学指标:用CCM-111血脂分析仪检测治疗前、治疗后14 d、21 d纤维蛋白原、血浆黏度、红细胞聚集指数。⑤炎性因子[白细胞介素(IL)-17、肿瘤坏死因子(TNF)-α、基质金属蛋白酶(MMP)-3、IL-6]:ELISA检测治疗前、治疗后14 d、21 d的IL-17、TNF-α、MMP-3、IL-6表达水平。
1.5 统计学方法 用软件SPSS 23.0处理数据,计量资料用均数±标准差(±s)表示,采用t检验,计数资料用率[n(%)]表示,采用X2检验,P<0.05为差异有统计学意义。
2 结果
2.1 两组患者临床疗效比较 治疗后观察组总有效率92.22%高于对照组80.00%,差异有统计学意义(P<0.05),见表2。
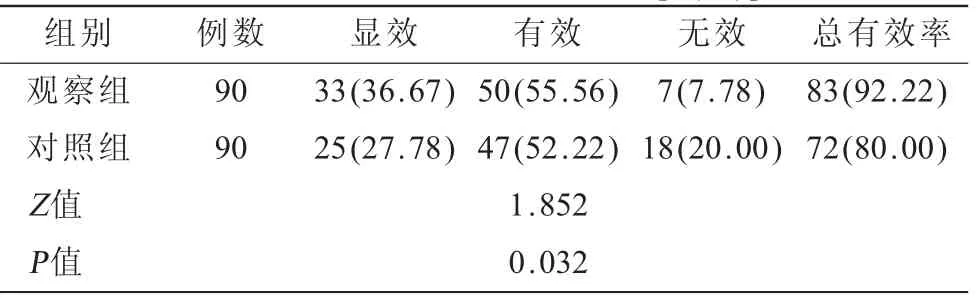
表2 两组患者临床疗效比较[n(%)]
2.2 两组患者中医证候积分、VAS评分比较 治疗前两组中医证候积分、VAS评分比较,差异无统计学意义(P>0.05),治疗后14 d、21 d观察组中医证候积分、VAS评分均低于对照组,差异有统计学意义(P<0.05),见表3。
表3 两组患者中医证候积分、VAS 评分比较(±s) 单位:分

表3 两组患者中医证候积分、VAS 评分比较(±s) 单位:分
组别 例数 中医证候积分 VAS评分治疗前 治疗后14 d 治疗后21 d 治疗前 治疗后14 d 治疗后21 d观察组 90 26.88±3.34 19.84±2.31 13.33±1.56 6.81±0.42 3.57±0.52 2.50±0.50对照组 90 26.79±3.15 22.14±2.98 17.42±2.37 6.68±0.83 4.10±0.50 3.11±0.38 t值 0.184 5.783 13.677 1.356 7.023 9.194 P值 0.854 <0.001 <0.001 0.177 <0.001 <0.001
2.3 两组患者疼痛介质比较 治疗前两组5-HT、PGE2、NGF比较,差异无统计学意义(P>0.05),治疗后14 d、21 d观察组5-HT、PGE2、NGF均低于对照组,差异有统计学意义(P<0.05),见表4。
表4 两组患者疼痛介质比较(±s)

表4 两组患者疼痛介质比较(±s)
注:5-HT=5- 羟色胺,PGE2=前列腺素E2,NGF=神经生长因子。
组别 例数 5-HT(ng/L) PGE2(ng/mL)治疗前 治疗后14 d 治疗后21 d 治疗前 治疗后14 d 治疗后21 d观察组 90 703.44±69.58 458.94±51.22 351.44±40.26 391.22±40.55 311.21±35.27 243.81±25.46对照组 90 692.17±73.54 601.36±63.50 440.12±47.63 387.26±43.47 345.86±30.64 271.60±31.24 t值 1.056 16.559 0.292 <0.001例数13.490 0.634 7.034 6.539 P值 <0.001 0.527 <0.001 <0.001组别 NGF(pg/mL)治疗前 治疗后14 d 治疗后21 d观察组 90 92.11±10.45 71.33±8.72 46.71±5.44对照组 90 90.25±9.87 79.45±9.77 53.45±5.62 t值 1.227 5.879 8.168 P值 0.221 <0.001 <0.001
2.4 两组患者血液流变学指标的比较 治疗前两组纤维蛋白原、血浆黏度、红细胞聚集指数比较,差异无统计学意义(P>0.05),治疗后14 d、21 d观察组纤维蛋白原、血浆黏度、红细胞聚集指数均低于对照组,差异有统计学意义(P<0.05),见表5。
表5 两组患者血液流变学指标的比较(±s)
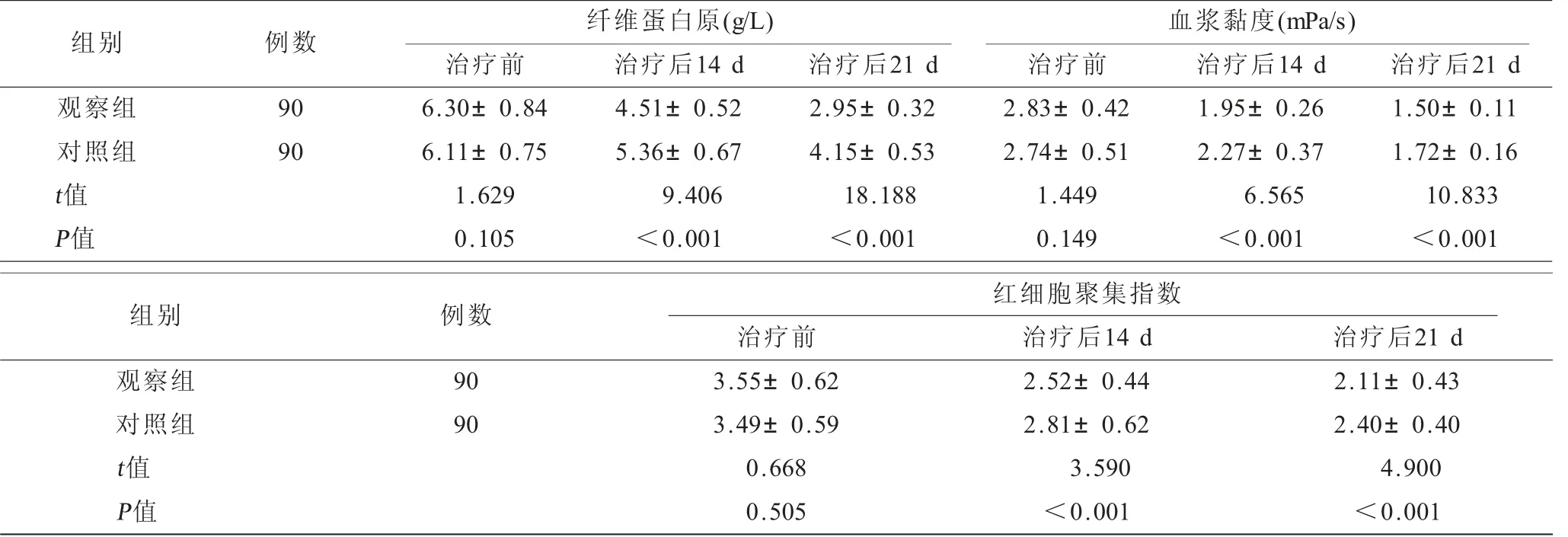
表5 两组患者血液流变学指标的比较(±s)
组别 例数 纤维蛋白原(g/L) 血浆黏度(mPa/s)治疗前 治疗后14 d 治疗后21 d 治疗前 治疗后14 d 治疗后21 d观察组 90 6.30±0.84 4.51±0.52 2.95±0.32 2.83±0.42 1.95±0.26 1.50±0.11对照组 90 6.11±0.75 5.36±0.67 4.15±0.53 2.74±0.51 2.27±0.37 1.72±0.16 t值 1.629 9.406 18.188 1.449 6.565 10.833 P值 0.105 <0.001 <0.001 0.149 <0.001 <0.001组别 例数 红细胞聚集指数治疗前 治疗后14 d 治疗后21 d观察组 90 3.55±0.62 2.52±0.44 2.11±0.43对照组 90 3.49±0.59 2.81±0.62 2.40±0.40 t值 0.668 3.590 4.900 P值 0.505 <0.001 <0.001
2.5 两组患者炎性因子比较 治疗前两组IL-17、TNF-α、MMP-3、IL-6表达水平比较,差异无统计学意义(P>0.05),治疗后14 d、21 d观察组IL-17、TNF-α、MMP-3、IL-6表达水平均低于对照组,差异有统计学意义(P<0.05),见表6。
表6 两组患者炎性因子比较(±s)

表6 两组患者炎性因子比较(±s)
注:IL-17=白细胞介素-17,TNF-α=肿瘤坏死因子-α,MMP-3=基质金属蛋白酶-3,IL-6=白细胞介素-6。
组别 例数 IL-17(pg/mL) TNF-α(μg/mL)治疗前 治疗后14 d 治疗后21 d 治疗前 治疗后14 d 治疗后21 d观察组 90 118.94±15.88 72.16±8.57 45.14±6.10 21.20±3.12 12.11±1.53 7.54±0.98对照组 90 115.62±14.16 95.81±10.39 59.07±5.92 20.85±2.86 15.62±1.66 10.22±1.13 t值 1.476 16.674 15.570 0.784 14.793 17.066 P值 0.142 <0.001 <0.001 0.434 <0.001 <0.001组别 例数 MMP-3(ng/mL)治疗前 治疗后14 d 治疗后21 d 治疗前观察组 90 40.08±5.41 31.24±3.55 22.57±2.67 125.64±15.43对照组 90 40.39±4.71 37.43±4.39 26.84±3.02 128.97±16.90 t值 0.397 10.414 10.057 1.381 P值 0.692 <0.001 <0.001 0.169 IL-6(ng/mL)治疗后14 d 治疗后21 d 86.71±9.56 63.57±8.52 97.52±10.04 79.43±9.87 7.397 11.539<0.001 <0.001
3 讨论
LDH主要是由髓核退行性病变引起的,但具体发病机制尚未阐明,目前研究认为与局部炎症、外力压迫、生活方式等密切相关。目前LDH需要进行手术治疗约占19%,多数患者一般采取保守治疗,如进行非甾体抗炎药、物理疗法等[5]。超短波治疗是临床中常用的物理方法,通过电容电极输出能量从而产生热效应,作用于病灶部位,能增加血管通透性,从而改善患者血液循环、新陈代谢,还能减轻患者交感神经兴奋,从而减轻疼痛、解痉等[6-7]。
中医学中未有“LDH”病名,据表现症状与“腰痛”“痹症”描述一致,因过度劳动导致血瘀、肝肾亏虚,或是因外力作用至经络阻塞、瘀血内停,从而引起疼痛、下肢麻木等症状[8]。根据LDH辨证分类,其中寒湿型是LDH其中较为常见的一种,1 000人内约29.1%属于寒湿型,目前传统中医治疗是临床中治疗该病的首选方式[9]。针灸因创伤小、方便快捷、安全高效等优点,被广泛用于临床治疗LDH,研究学者认为针灸对疏通经络有明显作用,能促进局部血液循环,减轻腰椎疼痛压迫及炎性因子生成[10]。已有研究表明,针灸联合超短波治疗LDH疗效显著,可减轻患者疼痛程度、炎性因子释放[11]。本研究给予超短波联合夹脊穴针刺治疗寒湿证LDH发现,观察组总有效率92.22%高于对照组80.00%,在治疗后14 d、治疗后21 d观察组5-HT、PGE2、NGF、中医证候积分、VAS评分、纤维蛋白原、血浆黏度及红细胞聚集指数均低于对照组,提示其二者治疗寒湿证LDH疗效明确,并可改善患者疼痛程度、血液循环。究其原因可能是因为超短波联合夹脊穴针刺共同作用患者病灶部位,可降低纤维蛋白原、血浆黏度等,快速促进血液循环,改善患者腰部和软组织伸展性,从而在一定程度上减轻患者疼痛程度,利于病情恢复。
现代医学还认为LDH发病与炎性因子释放有关,IL-17、IL-6均属于白细胞家族成员,IL-17因子主要是CD4+T细胞分泌而来,能诱导内皮细胞和上皮细胞等分泌IL-6、IL-8、PGE2等因子,当LDH发生时,能促进下丘脑传递信号,加快炎性因子IL-17、IL-6释放[12-13]。TNF-α是巨噬细胞分泌的一种细胞因子,其能诱导多种因子释放从而调节免疫细胞活性,其表达水平越高,LDH发生风险越高[14]。MMP-3是基质金属蛋白酶家族成员,能参与胶原合成、外基质降解,MMP-3表达水平越高,可破坏基底膜完整性,从而加重LDH发展[15]。本研究结果显示,治疗后14 d、治疗后21 d观察组IL-17、TNF-α、MMP-3、IL-6 表达水平均低于对照组,提示超短波联合夹脊穴针刺可减轻寒湿证LDH患者炎性因子表达。
综上所述,超短波联合夹脊穴针刺可明显提高寒湿证LDH患者治疗效果,改善患者血清疼痛介质、血液循环,降低炎性因子表达。

