miR-221-5p、miR-126在肾细胞癌中的相对表达水平及其对预后的预测价值*
林龙辉,庄巧斐
中国人民解放军联勤保障部队第九〇九医院肾脏内科,福建漳州 363000
肾细胞癌(RCC)在全球患病率呈逐年增高趋势,75%~80%的患者为透明细胞RCC,早期无典型表现,约1/3的患者就诊时已出现转移,错过了最佳手术干预时机,即便行根治性手术治疗,术后复发仍较常见[1]。RCC病因比较复杂,包括肥胖、吸烟、家族遗传史等,进展与转移机制也非常复杂[2]。临床急需寻求相关标志物对RCC病情进行评估,并预测其预后,寻找一种有效方式提高RCC的诊疗水平。有研究发现,微小核糖核酸(miR)可利用靶基因对细胞周期进行调控,发挥促癌与抑癌作用,影响肿瘤进展及转移[3]。有研究显示,miR-221在RCC中表达水平异常增高,并且与这类患者的临床病理学特征有关[4],表明miR-221可能与RCC的病情相关。而miR-221-5p是由miR-221前体的5′端臂加工而来,可能在肿瘤疾病中具有重要的调节作用,但其在RCC中的作用机制及与预后的关系尚未明确,还有待进一步探讨。有研究发现,miR-126在前列腺癌、胰腺癌、RCC等恶性肿瘤中均可见信号通路富集,其表达水平异常可能与多种恶性肿瘤的发生有关[5]。基于上述研究背景,本研究旨在观察miR-221-5p、miR-126在RCC组织中的相对表达水平及其与预后的关系,以便协助RCC的诊疗,改善其预后,现报道如下。
1 资料与方法
1.1一般资料 选取本院2016年7月至2018年7月收治的134例RCC患者作为研究对象,其中男75例,女59例;年龄30~73岁,平均(55.21±13.96)岁;组织类型:乳头状癌23例,透明细胞癌97例,其他14例;肿瘤最大径:≥4 cm 59例,<4 cm 75例;Fuhrman分级:Ⅰ~Ⅱ级97例,Ⅲ~Ⅳ级37例;淋巴结转移:有淋巴结转移29例,无淋巴结转移105例;美国癌症联合会(AICC)分期:Ⅰ期68例,Ⅱ期49例,Ⅲ/Ⅳ期17例。本研究方案获得本院伦理委员会批准。纳入标准:通过病理诊断确诊为RCC的患者;年龄≥18岁的患者;既往无免疫治疗及放化疗史的患者;术前检查及病历资料均完善的患者;意识清醒、精神状态正常的患者;遵循自愿原则,并签署知情同意书的患者。排除标准:既往患其他原发性肿瘤的患者;有严重基础疾病的患者,例如心肌梗死、脑梗死等;有血液系统疾病的患者;近1个月内使用过免疫抑制剂、激素类药物的患者。
1.2方法
1.2.1miR-221-5p、miR-126检测 通过手术获取患者RCC组织、癌旁组织(距离病灶约3 cm),采用实时荧光定量聚合酶链反应(qRT-PCR)检测miR-221-5p、miR-126相对表达水平。主要试剂为无水乙醇、饱和酚、琼脂糖、β-巯基乙醇、反转录试剂、Trizol试剂,均购自美国Thermo公司。主要仪器为5424R型离心机(德国Eppendorf股份公司)、7500型实时荧光定量PCR仪(美国ABI公司)、Nanodrop ND-1000型分光光度计(美国Thermo Fisher公司)。采用Trizol法提取总RNA,取少量RNA检测纯度与浓度,其余置于-70 ℃环境备用。行反转录反应,根据要求加入反转录试剂,在37 ℃下反应60 min,在85 ℃下加入灭活酶,时间5 min,合成cDNA,置于-20 ℃环境下。行qRT-PCR检测,反应条件:95 ℃预变性5 min;95 ℃变性10 s,60 ℃退火2 s,72 ℃延伸10 s,40个循环。引物序列:(1)miR-221-5p上、下游序列分别为5′-GCTACATTGTCTGCTTGGGTTTCA-3′、5′-GT GCAGGGTCCGAGGT-3′。(2)miR-126上、下游序列分别为5′-GTCGTATCCAGTGCAGGGTCCGAGGT-3′、5′-ATTCGCACTGGATACGACCGCATT-3′。(3)内参引物U6上、下游序列分别为5′-CTCGCTTCGGCAGCACA-3′、5′-AACGCTTCACGAATTTGCGT-3′。采用2-ΔΔCt表示miR-221-5p、miR-126相对表达水平。
1.2.2随访分析 从患者术后第1天开始随访,时间为3年,通过电话、微信等方式进行,记录患者3年累积生存率。
2 结 果
2.1RCC组织和癌旁组织中miR-221-5p、miR-126相对表达水平比较 RCC组织中miR-221-5p相对表达水平高于癌旁组织,而miR-126相对表达水平低于癌旁组织,差异均有统计学意义(P<0.05)。见表1。
表1 RCC组织和癌旁组织中miR-221-5p、miR-126相对表达水平比较
2.2不同病理特征与miR-221-5p、miR-126表达情况比较 根据RCC组织内miR-221-5p、miR-126表达水平均值分为高表达组(≥均值)和低表达组(<均值)。miR-221-5p高表达组肿瘤最大径≥4 cm、Fuhrman分级为Ⅲ~Ⅳ级、有淋巴结转移、AICC分期为Ⅲ/Ⅳ期占比均高于低表达组,miR-126低表达组肿瘤最大径≥4 cm、Fuhrman分级为Ⅲ~Ⅳ级、有淋巴结转移、AICC分期为Ⅲ/Ⅳ期占比均高于高表达组,差异均有统计学意义(P<0.05)。见表2。
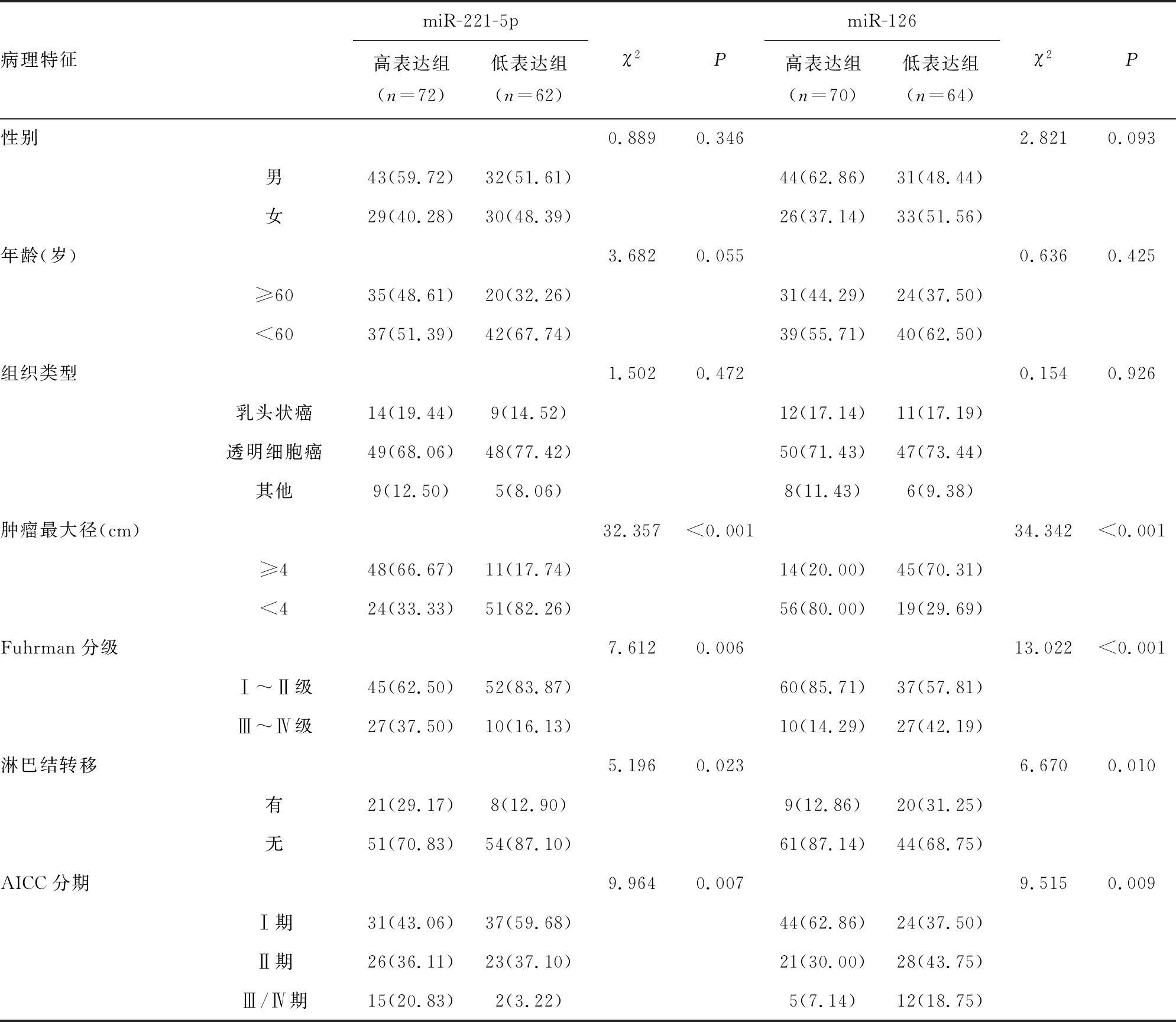
表2 不同病理特征与miR-221-5p、miR-126表达情况比较[n(%)]
2.3miR-221-5p、miR-126表达水平与患者预后的关系 miR-221-5p高表达组3年累积生存率为59.72%(43/72),低表达组3年累积生存率为83.87%(52/62),miR-221-5p高表达组3年累积生存率低于低表达组,差异有统计学意义(log-rankχ2=9.415,P<0.05)。见图1。miR-126高表达组3年累积生存率为80.00%(56/70),低表达组3年累积生存率为60.94%(39/64),miR-126高表达组3年累积生存率高于低表达组,差异有统计学意义(log-rankχ2=5.888,P<0.05)。见图2。
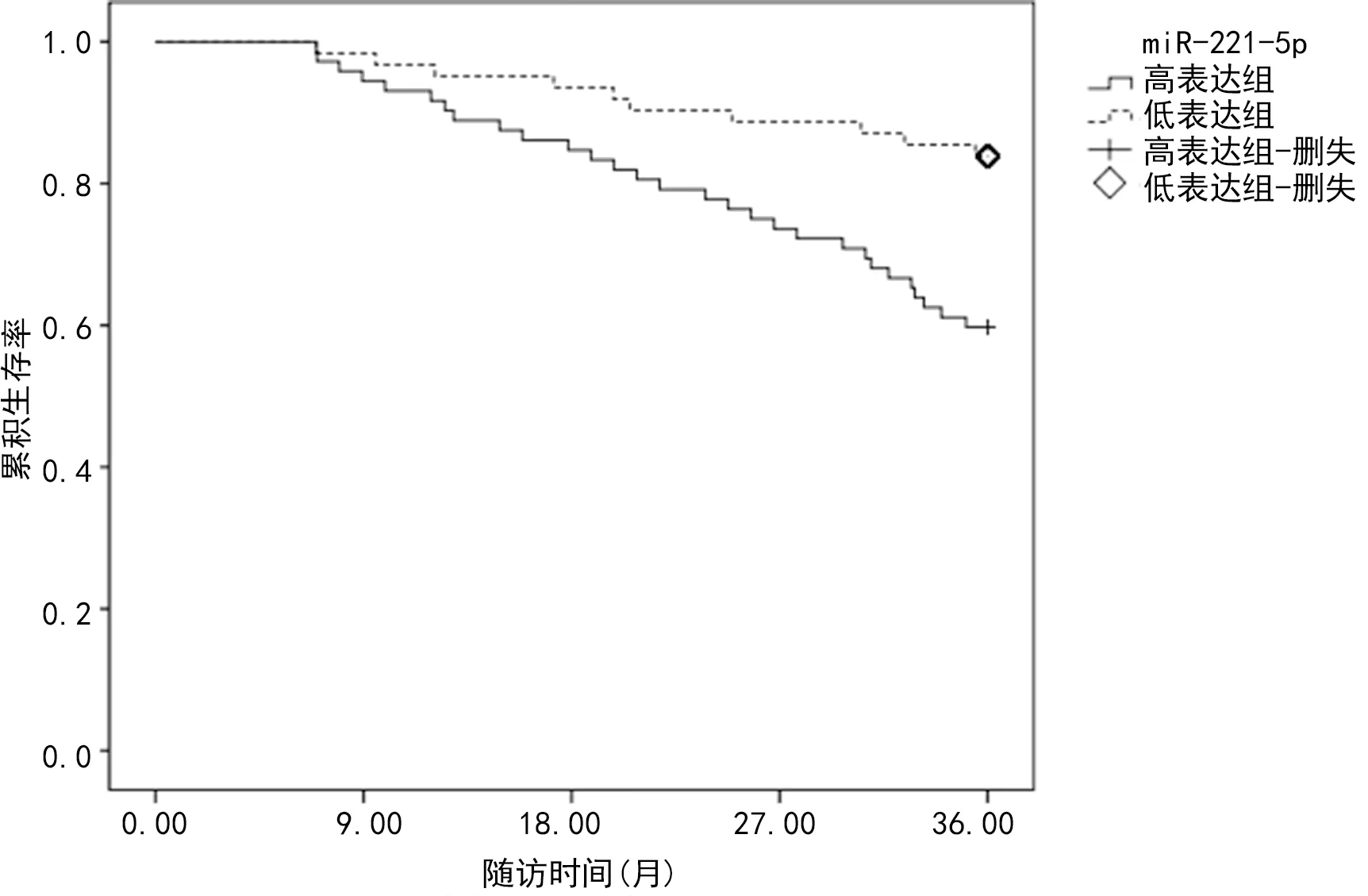
图1 miR-221-5p高表达组和低表达组累积生存率比较
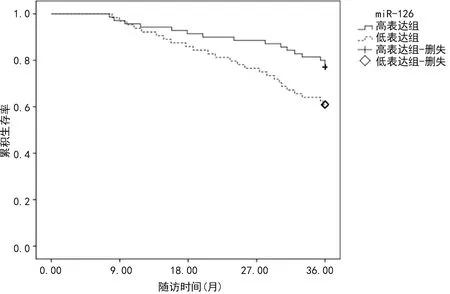
图2 miR-126高表达组和低表达组累积生存率比较
2.4生存组和死亡组miR-221-5p、miR-126相对表达水平比较 根据患者生存和死亡情况分为生存组和死亡组,生存组miR-221-5p相对表达水平低于死亡组,miR-126相对表达水平高于死亡组,差异均有统计学意义(P<0.05),见表3。
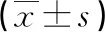
表3 生存组和死亡组miR-221-5p、miR-126相对表达水平比较
2.5miR-221-5p、miR-126相对表达水平对RCC预后的评估价值 miR-221-5p、miR-126单独检测预测RCC预后的AUC分别为0.758、0.791,二者联合检测预测RCC预后的AUC为0.852,见表4、图3。
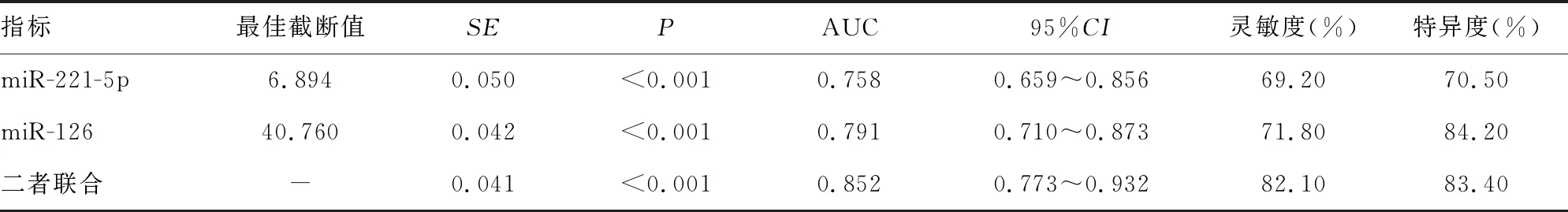
表4 miR-221-5p、miR-126相对表达水平对RCC预后的评估价值
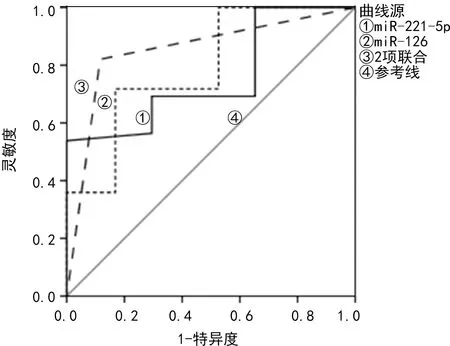
图3 miR-221-5p、miR-126相对表达水平评估RCC预后的ROC曲线
3 讨 论
RCC在肾脏恶性肿瘤中占比为80%~90%,典型表现为局部肿块、血尿及疼痛。目前,外科手术仍然是治疗RCC的主要方法,在患者无手术禁忌证的情况下,通常主张行手术切除,然而即便如此,患者术后复发率仍较高,为20%~40%,对生命质量影响非常大[6]。近年来,临床陆续出现了一系列辅助治疗方法,如靶向治疗、物理治疗、射频消融治疗、微波消融治疗等,这些方法虽有一定价值,但疗效非常有限,预后尚不够理想[7]。RCC早期诊断和治疗比较困难,多数患者就诊时已进展为中晚期,这也是导致预后差的重要因素。因此,尽早诊断和治疗是降低复发率及病死率,改善预后的关键。有研究表明,miRNA在RCC、乳腺癌、肺癌等疾病中发挥重要调节作用,其基因缺失或突变可引起异常表达,从而影响细胞凋亡、增殖、代谢、分化等,在癌症中起抑癌或促癌作用[8]。临床通过分析相关miRNA在RCC中的表达意义,可能对RCC的预后预测有一定作用。
有研究表明,miR-221-5p经转录后能通过靶向细胞因子信号传导抑制蛋白1对癌细胞迁移、增殖进行调节,还能调控有丝分裂原活化蛋白激酶/细胞外信号调节激酶信号通路在肿瘤中发挥作用[9]。另有学者发现,长非编码RNA-ATB能通过调控肿瘤抑制因子miR-126,参与肿瘤细胞迁移与增殖[10]。由此表明miR-221-5p、miR-126对肿瘤细胞具有调控作用,临床有必要进一步分析二者对RCC患者病情及预后的影响,为RCC的治疗提供依据。本研究结果显示,与癌旁组织比较,RCC组织中miR-221-5p相对表达水平上调,miR-126相对表达水平下调,表明二者异常表达与RCC有关。miR-221-5p在恶性肿瘤中具有促癌作用,涉及的机制比较复杂,可受RNF185-AS1调控,促进肝癌进展[11]。TRILLA-FUETES等[12]研究发现,RCC组织中miR-221-5p呈过度表达,进一步提示高表达的miR-221-5p能促进RCC的进展。miR-126是一种肿瘤抑制因子,张玉洁等[13]研究发现,miR-126在非小细胞肺癌患者血清中表达水平降低,提示其在这类癌症中有抑癌作用。蒋莉萍等[14]研究发现,miR-126在胃癌中有抑癌功能,它能通过对高尔基体磷蛋白3进行靶向调节,抑制癌细胞增殖。此外,miR-126与RCC之间也存在密切关联,能下调Rho相关卷曲螺旋形成蛋白激酶1(ROCK1)表达水平,对RCC细胞的侵袭与迁移、增殖进行抑制,在RCC中有抑癌作用[15]。
RCC的病理特征比较复杂,并且部分miRNA与RCC的病理特征密切相关[16]。本研究结果提示,RCC患者miR-221-5p、miR-126表达情况与肿瘤最大径、Fuhrman分级、淋巴结转移、AICC分期均有关,这可能是因为miR-221-5p的促癌功能与miR-126的抑癌功能所致。miR-221-5p在RCC中具有促癌作用,可促进肿瘤生长,影响Fuhrman分级与AICC分期,增加淋巴结转移风险;而miR-126在RCC中有抑癌作用,能抑制肿瘤生长,控制病情进展。RCC恶性程度高,预后差,RCC患者术后的预后因素主要与肿瘤AICC分期高、Fuhrman分级高、有淋巴结转移、肿瘤最大径比较大等有关,上述均为常规因素[17]。本研究发现,miR-221-5p、miR-126相对表达水平与RCC预后密切相关,miR-221-5p低表达与miR-126高表达患者3年累积生存率更高,且二者对预后有一定评估价值。miR-221-5p是miR-221前体的5′端臂加工后的产物,miR-221与RCC进展密切相关,它能通过靶向抑制基质金属蛋白酶2的组织抑制物表达,促进RCC细胞转移、增殖及侵袭[18],间接提示miR-221-5p可能参与了RCC的进展。除此之外,miR-221异常表达会影响RCC患者舒尼替尼治疗的反应[19],间接提示其能影响RCC的治疗效果。miR-126则能通过靶向调节ROCK1表达,抑制RCC进展,这可能是其异常表达影响预后的重要原因。临床有望通过检测miR-221-5p、miR-126相对表达水平对RCC预后进行预测,并将二者作为RCC的诊疗靶标。
综上所述,RCC患者miR-221-5p相对表达水平上调,miR-126相对表达水平下降,二者异常表达可降低3年累积生存率,对预后影响非常大。本研究局限性为纳入样本量较少,并且尚未进一步明确miR-221-5p、miR-126的靶基因,未来还需对此进行更深入的阐述。

