CL6000i全自动化学发光免疫分析仪检测甲状腺激素的性能验证*
王丽娜,赵 伟,张婧莹,张 婉,衣美英,曹永彤
中日友好医院检验科,北京 100029
血清甲状腺激素是反映甲状腺功能的重要指标,能够真实、准确地检测体内甲状腺激素对甲状腺疾病的诊断和治疗尤为重要,而检测仪器的精密性和稳定性则是获得准确测定结果的重要保障。目前,临床常用的甲状腺激素检测方法为化学发光法。为评估迈瑞CL6000i全自动化学发光免疫分析仪(简称迈瑞CL6000i)是否能够满足临床对甲状腺相关疾病的诊疗需求,本实验室对该仪器检测甲状腺激素8项的精密度、准确度、线性范围、最低检出限、生物参考区间和方法学比对等性能进行验证[1-2],以确保检验质量准确可靠,现报道如下。
1 材料与方法
1.1标本来源 选取2021年7-8月于本院就诊的患者和健康体检者的新鲜血清标本,要求标本无溶血、黄疸、脂血等。
1.2仪器与试剂 迈瑞CL6000i及其配套试剂、校准品、质控品和耗材等。性能验证过程中所有试剂均未更换批号。三碘甲状腺原氨酸(T3)、甲状腺素(T4)、游离三碘甲状腺原氨酸(FT3)、游离甲状腺素(FT4)、促甲状腺激素(TSH)、甲状腺球蛋白(Tg)、甲状腺球蛋白抗体(Tg-Ab)、甲状腺过氧化物酶抗体(TPO-Ab)定标品批号分别为210501、210201、210101、210301、210401、210201、210401、210301。TSH、Tg、Tg-Ab、TPO-Ab试剂批号分别为210401、210101、210301、210201,其余试剂批号均为210608。Tg-Ab、TPO-Ab低值质控品(质控L)批号为210501,高值质控品(质控H)批号为210201,其余各项质控品批号均为210401。
1.3方法
1.3.1仪器使用 按照厂家要求对仪器进行维护保养、校准和每日质控,在保证质控在控的情况下,对仪器进行性能验证。
1.3.2精密度 参考美国临床和实验室标准协会(CLSI) EP15-A2文件[3],分别对质控H、质控L,以及高、低两种水平人血清标本进行检测。每天分析一个批次,每种水平重复检测3次,连续检测5 d,计算各项目的批内和批间精密度的变异系数(CV)。要求批内精密度CV均小于美国临床实验室改进修正法规′88(CLIA′88)认可的1/4TEa、批间精密度CV小于CLIA′88认可的1/3TEa,即批内精密度CV<6.25%、批间精密度CV<8.33%为验证通过。
1.3.3准确度 参考CLSI EP15-A3文件[4],采用迈瑞具有溯源性及标准浓度的两种浓度梯度的准确度验证标本,将其作为检测标本按说明书步骤进行检测,每天检测2次,连续检测5 d。计算检测结果均值与已知定值物质的偏倚,准确度标本的相对偏倚=(检测结果均值-靶值)/靶值×100%,要求相对偏倚小于CLIA′88认可的1/2TEa,即<12.5%为验证结果可接受。
1.3.4线性范围 参考美国临床实验室标准化委员会(NCCLS) EP6-A3文件[5]和文献[6-7],收集接近厂家声明的线性范围上限和下限的临床标本H和L各一份,按照1L、0.8L+0.2H、0.6L+0.4H、0.4L+0.6H、0.2L+0.8H、1H的比例梯度混合成6种不同浓度标本,每种浓度的标本重复检测3次,取平均值。计算实测均值与理论值的线性回归方程Y=aX+b。要求斜率在0.97~1.03,并且R2≥0.950,即为验证通过。
1.3.5生物参考区间 随机抽取50份表观健康的体检人群标本进行检测(男女各半,年龄分布均匀),对厂家提供的生物参考区间进行验证。按NCCLS C28-A2文件[8]要求,超出参考范围的数量不应超过总数的5%,即95%以上的健康者检测值在参考区间内,则表明该生物参考区间可用于该实验室。

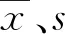
1.3.8方法学对比 收集患者新鲜血清作为标本,要求标本各项目浓度从低于参考范围至高于参考范围,尽可能在分析测量范围内均匀分布。以罗氏Cobas8000全自动生化分析仪(简称罗氏Cobas8000)作为参比仪器,迈瑞CL6000i作为待检仪器,将每份标本在待检仪器和参比仪器上分别测定,比较两种仪器检测结果是否具有一致性。以待检仪器检测结果为Y轴,参比仪器检测结果为X轴,计算线性回归方程,如果R2≥0.950则认为两种仪器检测结果一致性较好。由于免疫类检测项目没有很好地实现标准化,方法学对比只分析结果间的一致性。将各项目检测结果按照各检测仪器的参考范围分别进行判断,比较两种仪器检测结果的符合率,符合率>80%为合格[12-13]。
1.4统计学处理 采用Excel2003和SPSS17.0统计软件进行数据分析处理。计数资料以例数或百分率表示,一致性采用线性回归分析。
2 结 果
2.1精密度验证结果 各项目质控品和混合血清标本批内CV为0.42%~4.96%,均小于CLIA′88认可的1/4TEa批间CV为0.68%~5.47%,均小于CLIA′88认可的1/3TEa所有结果均在可接受范围,表明精密度良好,验证通过。见表1。
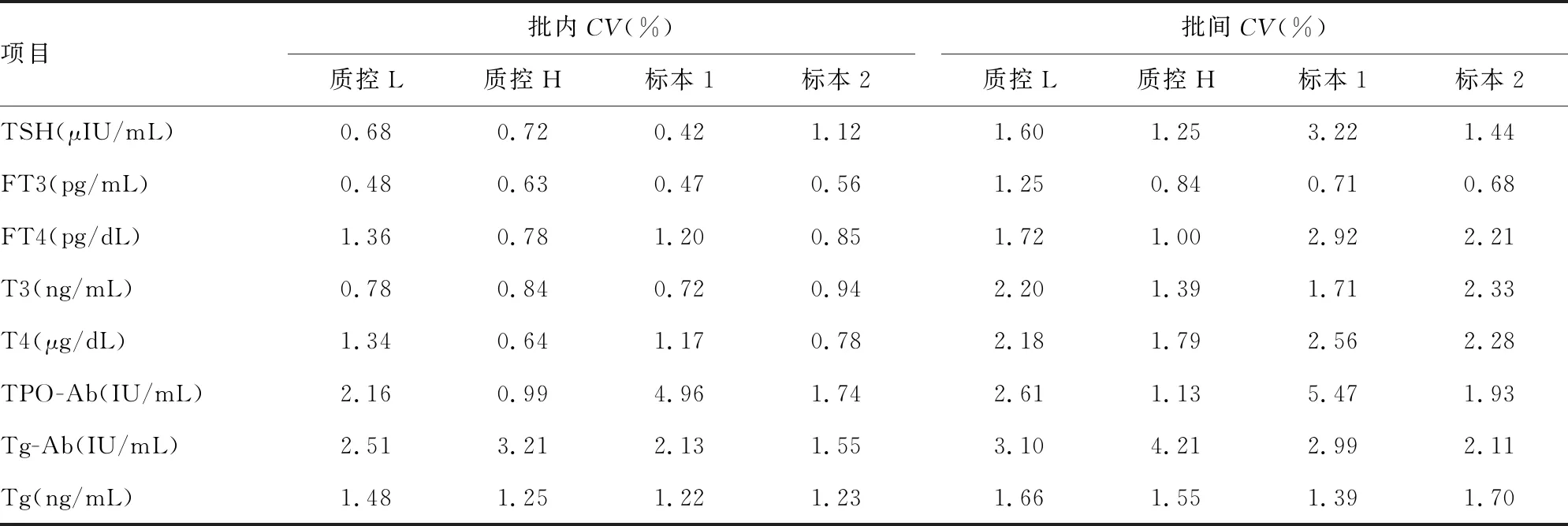
表1 精密度验证结果
2.2准确度验证结果 各项目准确度比对结果显示,相对偏倚范围为-5.95%~11.34%,均小于CLIA′88认可的1/2TEa,表明准确度良好,验证合格。见表2。
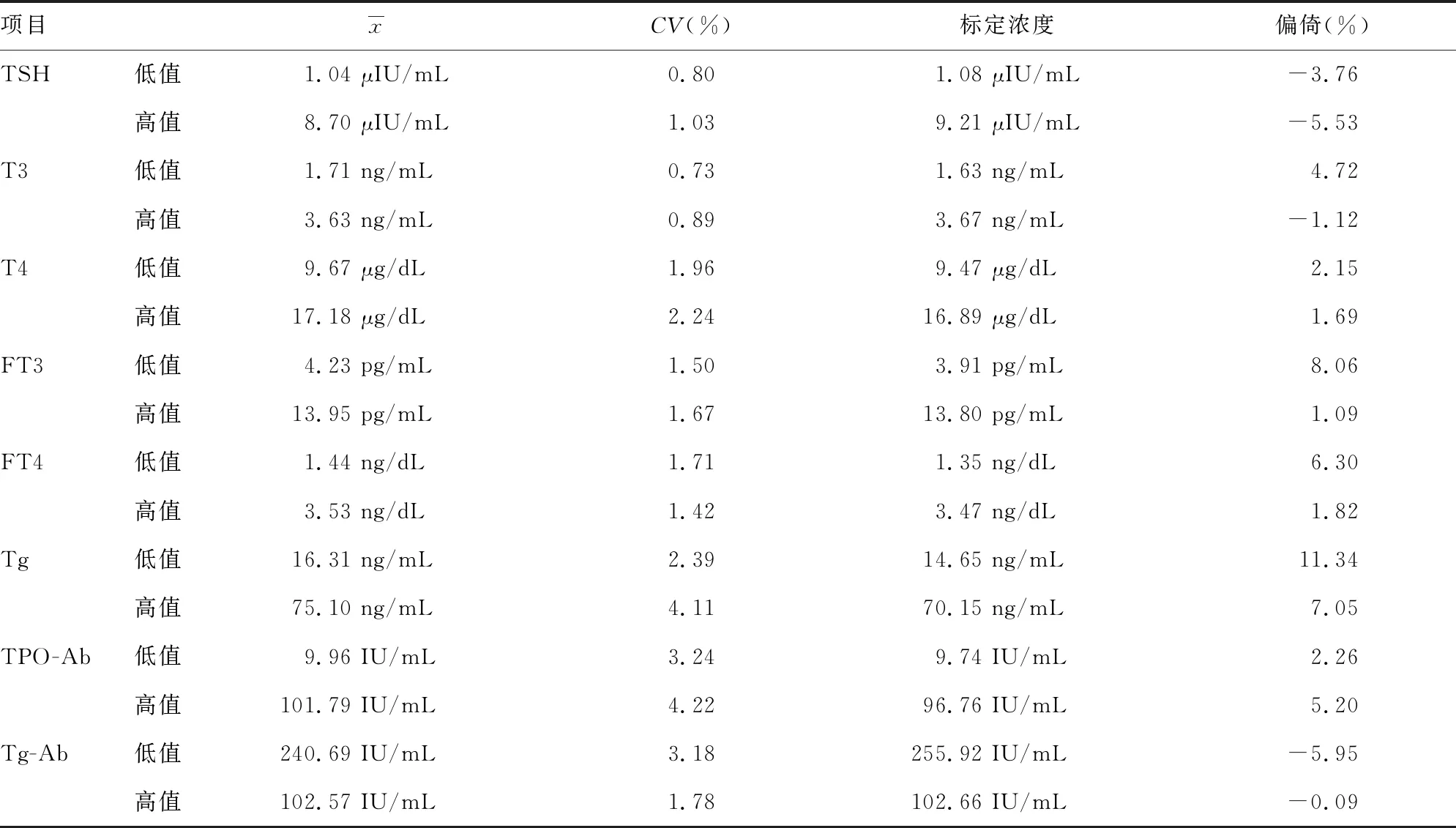
表2 准确度验证结果
2.3线性范围验证结果 TSH、T3、T4、TPO-Ab、Tg线性回归方程斜率为0.97~1.03,R2≥0.990,表明该检测仪器在厂家声明的检测范围内线性良好,验证合格,见表3。因为FT3 和 FT4稀释后的反应不呈线性,所以未进行二者的线性试验。
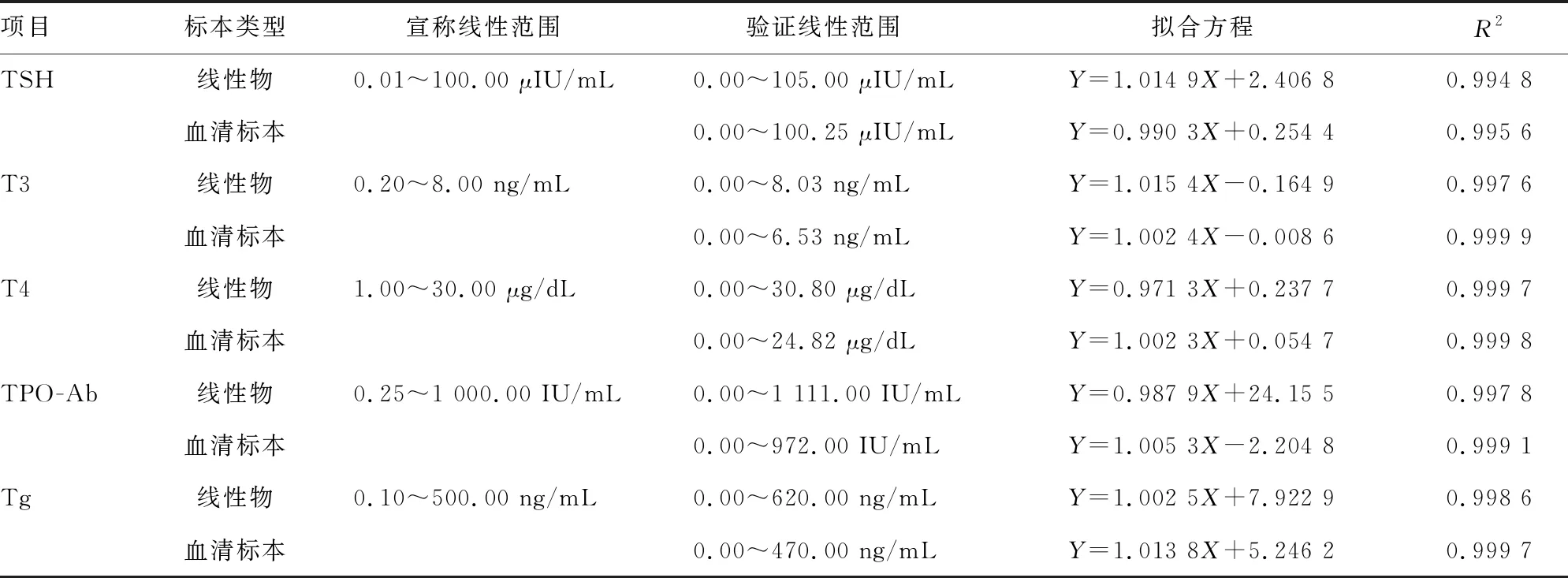
表3 线性范围验证结果
2.4生物参考区间验证结果 参与本次验证的50份标本检测数据,95%分布在厂家声明的生物参考区间内,说明所设参考区间合理,可用于本实验室。见表4。
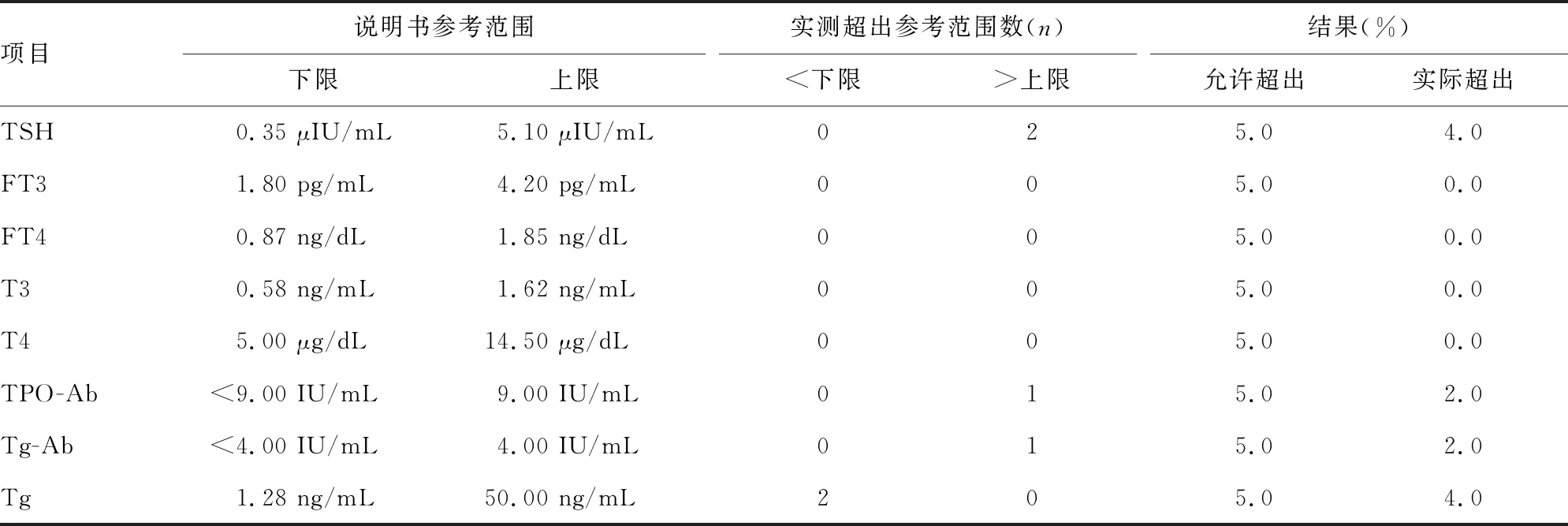
表4 生物参考区间验证结果(n=50)
2.5最低检出限验证结果 各项目最低检出限均小于厂家声明的允许范围,表明厂家声明的最低检出限适合本该实验室。见表5。
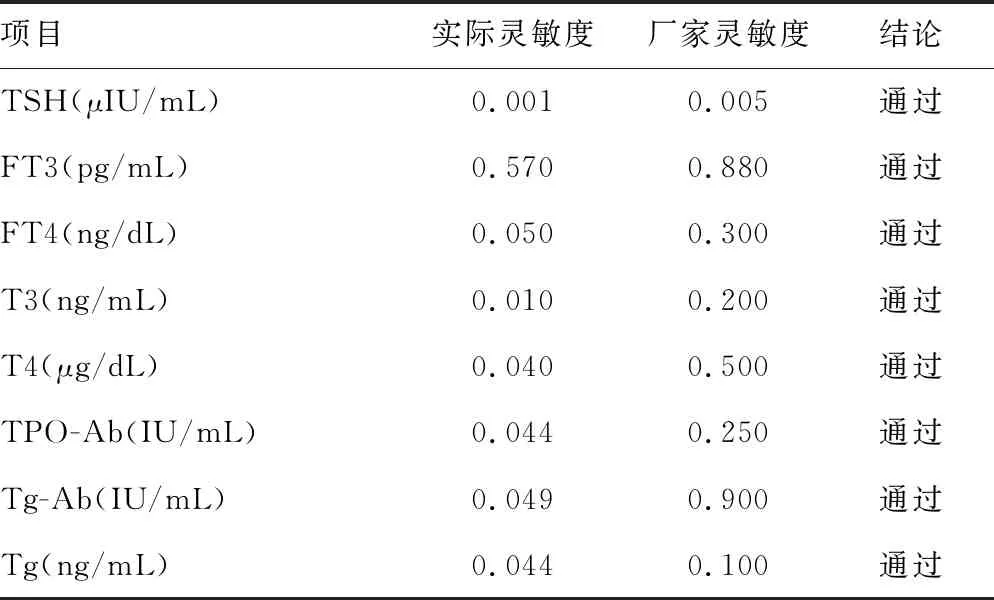
表5 最低检出限验证结果
2.6TSH的功能灵敏度验证结果 TSH日间重复性CV≤20%时,对应的最低检出限为0.008 μIU/mL,小于厂家声明的0.020 μIU/mL,符合说明书要求。见表6。
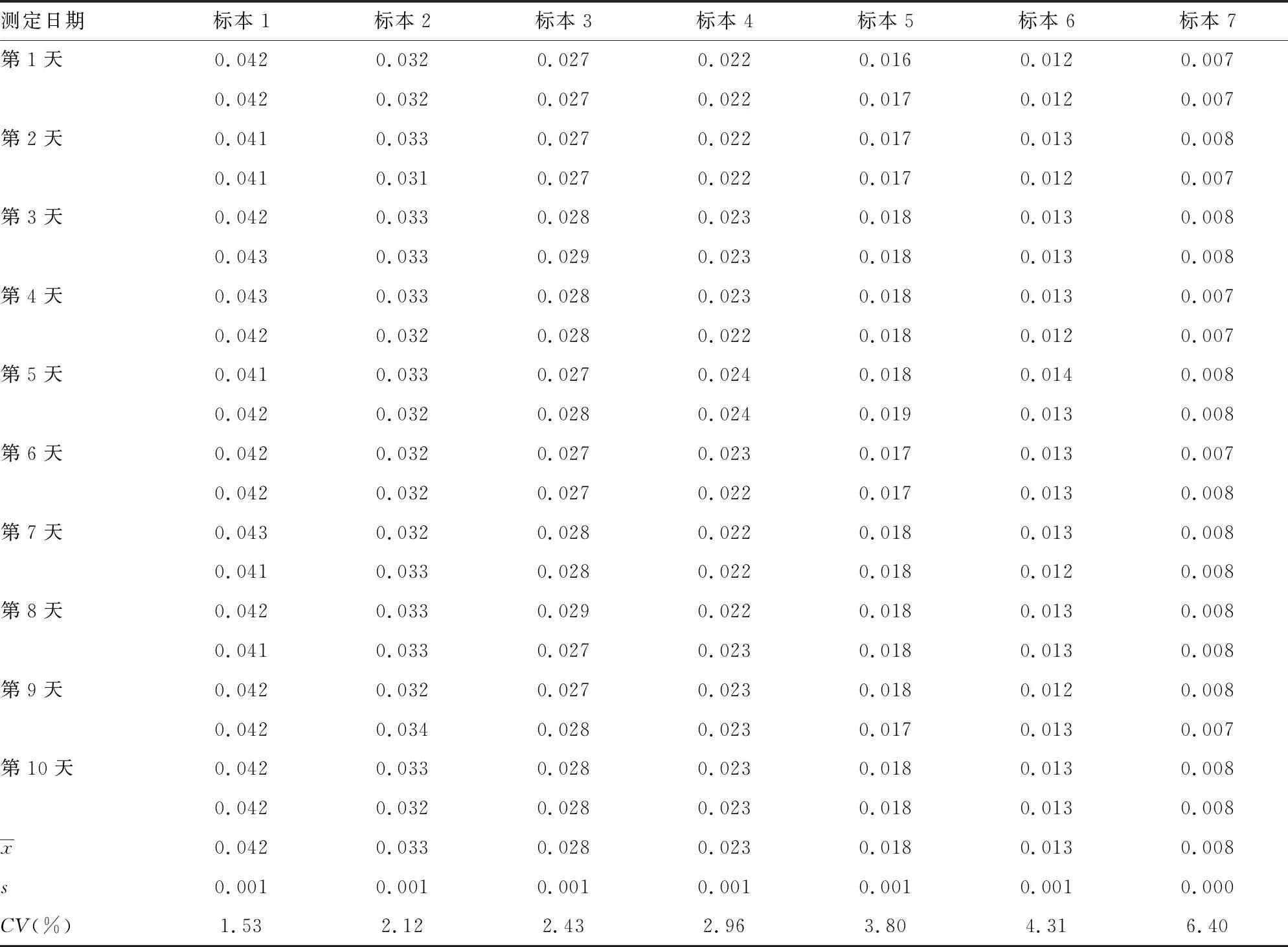
表6 TSH的功能灵敏度验证结果(μIU/mL)
2.7方法学评价和符合率比较 迈瑞CL6000i和罗氏Cobas8000对甲状腺激素各项目检测结果一致性评价见表7。除TPO-Ab、Tg-Ab外,其余各项目的R2>0.950,说明两种仪器对除TPO-Ab、Tg-Ab外的其他项目检测结果有较好的一致性。根据两种仪器各自参考范围(表8)对结果正常、升高、降低进行判断,计算相应结果的符合率。其中TSH各结果符合率均>90.0%,符合率良好;FT3、TPO-Ab各结果符合率均接近90.0%;T4各结果符合率>80.0%;其余各项目结果判断与罗氏Cobas8000相比均有差异。见表9。

表7 两种仪器检测结果一致性评价
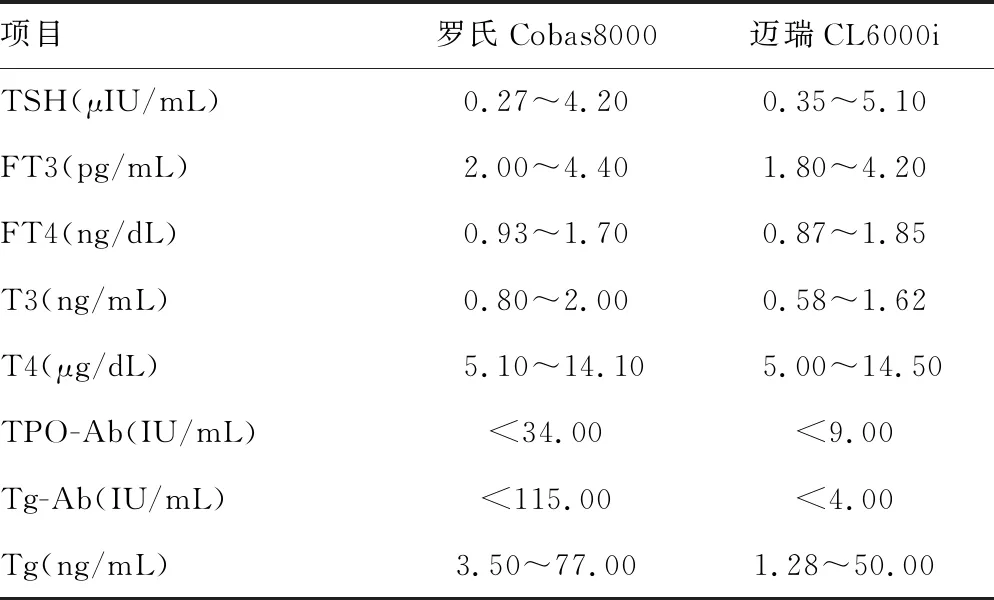
表8 两种仪器参考范围
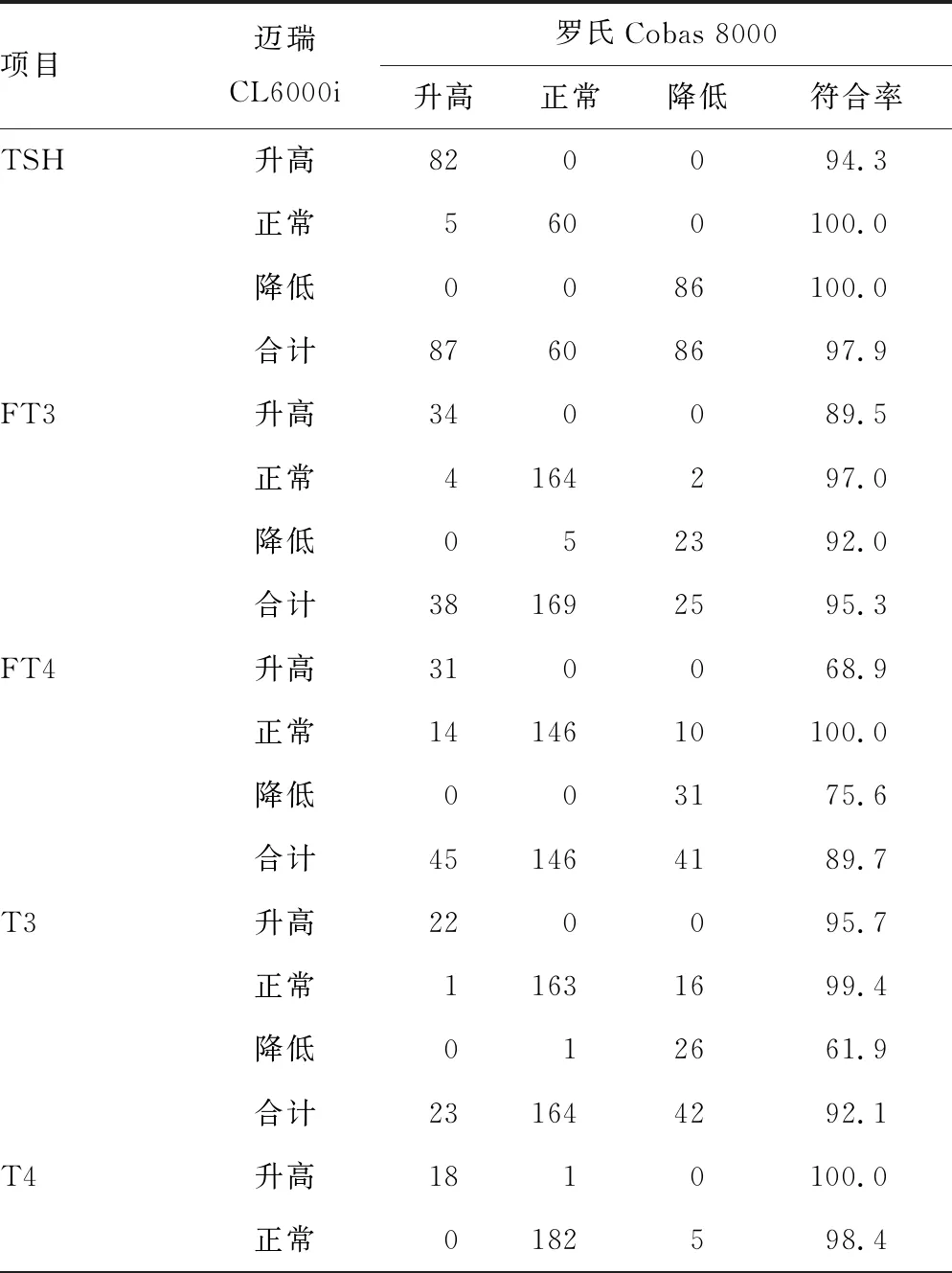
表9 两种仪器各项目检测结果符合情况比较(n或%)
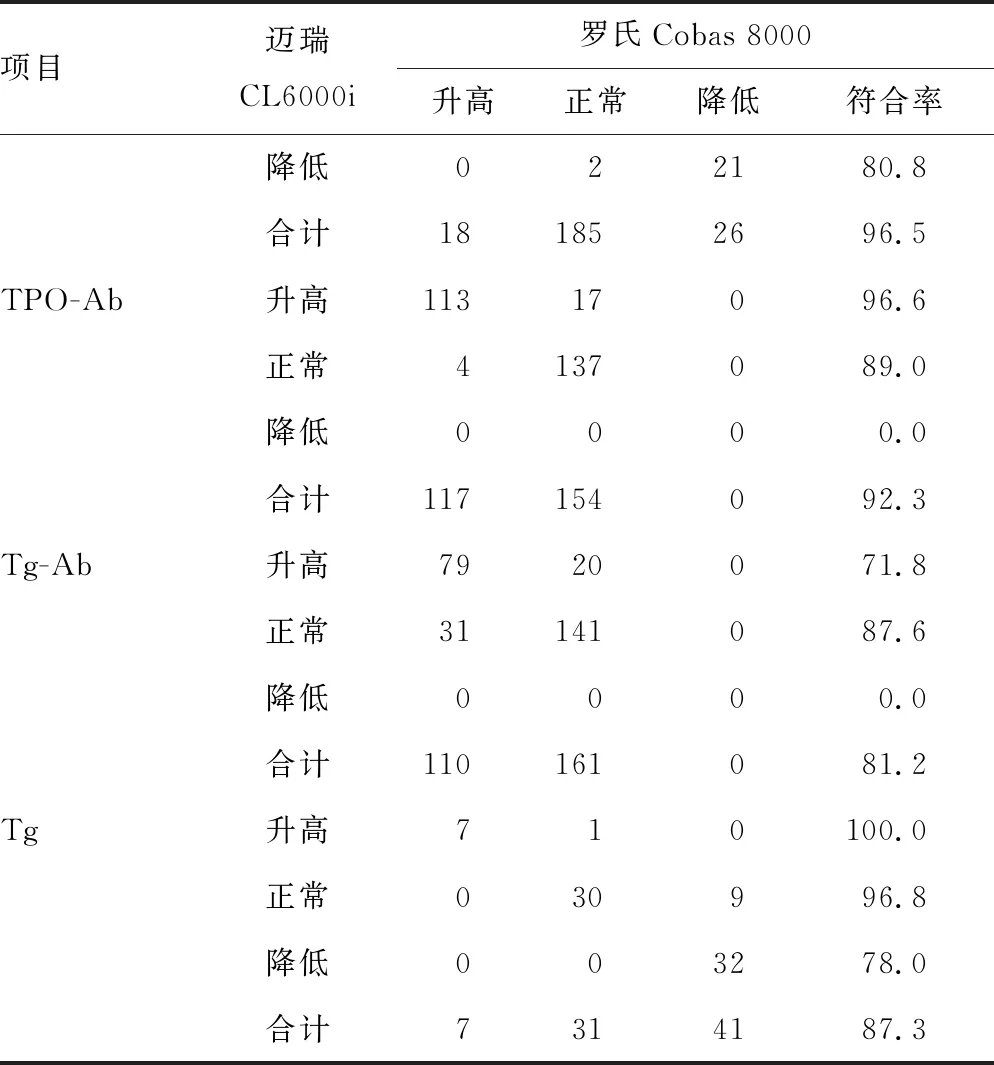
续表9 两种仪器各项目检测结果符合情况比较(n或%)
3 讨 论
血清甲状腺激素水平检测是临床甲状腺疾病诊断和治疗监测的重要手段,而检测仪器的良好性能是获得准确结果的保证。临床实验室在使用新的检测仪器前进行方法学性能验证是质量保证的前提,也是ISO15189《医学实验室质量和能力认可准则》的要求[14-17]。因此,本研究根据CLSI等文件要求,对迈瑞 CL6000i检测T4、T3、FT4、FT3、TSH、Tg、Tg-Ab、TPO-Ab这8项反映甲状腺功能项目的精密度、准确度、线性范围、生物参考区间、最低检出限、方法学比对和结果符合率等进行评估。
精密度是在相同条件下对同一份标本重复检测所得结果的一致性程度,反映检测仪器的随机误差,通常以CV表示。良好的精密度是仪器进行其他各项性能验证的前提和基础。精密度验证可选择新鲜冷冻血清、质控品、校准品,尽可能选择参考区间两端或临床决定水平处的浓度,以确定对临床有影响的关键浓度点的性能[16-18]。本研究选择质控品和血清标本进行验证,结果显示,迈瑞CL6000i对甲状腺功能8项的批内精密度CV均小于CLIA′88认可的1/4TEa,批间精密度CV均小于CLIA′88认可的1/3TEa,表明该仪器检测结果可重复性良好,符合质量标准要求,可为临床提供可靠依据。
准确度是测定值与真值之间的一致程度,反映系统误差,常用偏倚表示。偏倚越小,准确度越高。ISO15189规定可通过检测有定值标准物质、商品化校准品或通过与参考方法比对等进行准确度验证[16-19]。本研究采用检测不同水平具有溯源性的企业参考物质的方法进行准确度验证,评估检测结果与靶值的偏倚。验证结果显示,甲状腺激素各项目检测结果均值与靶值的偏倚均小于CLIA′88认可的1/2TEa,准确度验证合格,说明仪器各项目检测结果准确,达到质量要求。
线性范围是通过检测厂家声明的接近线性范围上、下限之间不同浓度的标本,判断实测均值与理论值是否呈线性关系,从而验证在该浓度范围内检测结果是否准确。本研究结果显示,甲状腺激素各项目实测均值和理论值一致,回归方程各参数符合要求,表明各项目在厂家声明的线性范围内具有良好的线性关系,检测结果准确可靠。
最低检出限是检测仪器能检测出的分析物最低浓度,反映仪器的分析灵敏度[10,16,20]。最低检出限有多种表示方式,如检出低限、功能灵敏度、分析灵敏度等。最早用分析灵敏度来描述检测下限。本研究结果显示,各项目的最低检出限均小于厂家声明的允许范围,表明迈瑞CL6000i具有良好的反应灵敏度。此外,临床实验室对TSH等低值有明显临床意义的项目,除验证最低检出限外,还有必要对其功能灵敏度进行验证,以确定准确的临床可报告低限。TSH是判断甲状腺功能异常的关键指标,并且对后续治疗有重要指导作用。甲状腺功能亢进患者TSH常出现极低检测值,因此,检测仪器是否有良好的功能灵敏度对甲状腺功能的判断与治疗监测至关重要。本研究TSH最低检出限为0.008 μIU/mL,小于迈瑞CL6000i声明的0.020 μIU/mL,表明该仪器可以满足临床检测需求。
生物参考区间是指检测结果在健康人群中的分布范围,确定一个可靠的生物参考区间对实验室而言非常重要。在实际工作中,大部分实验室会采用参考实验室或仪器厂家提供的生物参考区间数据,并进行验证。本研究验证结果显示,各项目检测值95%的数据分布在厂家声明的参考区间范围内,说明该生物参考区间设置合理,适合于本实验室。由于人种、年龄、性别、环境及生活方式等有差异,所以,有条件的实验室最好能建立适合本地区、不同性别、不同年龄等特定人群的生物参考区间。
同一项目在不同仪器间的检测结果需要具有可比性,以确保临床能够根据检测结果对疾病类型进行正确判断。因此,对不同仪器检测结果进行一致性分析也是仪器性能评价的一项重要指标。本研究比对结果显示,两种仪器对除TPO-Ab、Tg-Ab外的甲状腺激素各项目的检测结果均有较好的一致性。
甲状腺激素各项目结果的高低代表了甲状腺功能异常的不同类型,如TSH升高或降低,反映了甲状腺功能减退或亢进。因此,对免疫类检测项目,不同仪器间除了结果需要具有可比性之外,还需要评估按照各自参考范围对结果做出的判断是否相同。本研究结果显示,两种仪器间TSH、FT3、TPO-Ab、T4的符合率良好,结果一致可互认,其他项目的符合率则各有差异。值得注意的是,两种仪器对TPO-Ab的检测结果差异较大,但对结果的判断(正常或异常)却较一致。
分析两种仪器同一项目比对结果和符合率不一致的原因,除了标本局限可能导致的统计分析偏差外,量值溯源、试剂制备、方法学和系统性能差异及其他因素的影响,均有可能导致同一标本在不同仪器间检测结果的不可接受差异。此外,由于免疫检测项目的标准不同,各厂家参考范围设置也不尽一致。因此,在现有条件下,为避免给诊疗活动带来困扰,应根据不同检测仪器制订相应的诊断临界值。努力实现不同平台间检测结果的一致性,则是最终要达到的质量目标。
综上所述,除了检测结果的方法学比对存在差异外,迈瑞CL6000i检测FT3、FT4、T3、T4、TSH、Tg、Tg-Ab、TPO-Ab的精密度、准确度、线性范围、生物参考区间、最低检出限均能达到厂家声明的参数,符合CLIA′88和ISO15189实验室认可要求,能够满足临床需求。

