羽扇豆醇对结直肠癌HCT116细胞的抑制作用及机制研究*
韩泽平,蔡 贞
1.南方医科大学南方医院检验科,广东广州 510515;2.广州市番禺区中心医院中心实验室,广东广州 511400
结直肠癌是全球最常见的消化道恶性肿瘤,发病率居恶性肿瘤的第3位,也是癌症相关死亡的第二大原因[1]。手术及放化疗是目前治疗结直肠癌的主要方法,但由于外科手术的局限性、放疗剂量的限制、化疗药物的不良反应及耐药性等影响,导致结直肠癌治疗及预后仍不理想[2]。近年来,传统中草药及其有效成分的抗癌、调节免疫等作用逐渐引起人们的关注[3-4]。羽扇豆醇是一种来源于羽扇豆、蒲公英等草本植物中的五环三萜类化合物,相对分子质量为426.72,分子式为C30H50O,具有抗炎、抗氧化、抗感染和调节免疫力等作用,提示其具有不同的药理活性及多种作用机制[5-6]。在抗肿瘤研究中,羽扇豆醇对多种肿瘤具有良好的治疗效果[7-8],并且具有保护心脏、肝脏、神经等作用[9-10],但羽扇豆醇抗结直肠癌的作用机制尚未阐明。本文进一步研究羽扇豆醇对结直肠癌HCT116细胞生物学功能的影响,通过TMT标记定量蛋白质组学分析明确羽扇豆醇抑制结直肠癌增殖和转移的潜在分子机制,推动中医药抗肿瘤研究的发展,并为结直肠癌的治疗提供新思路。
1 材料与方法
1.1仪器与试剂 羽扇豆醇(南京狄尔格医药科技有限公司);胎牛血清、RPMI1640培养基、DMEM培养基、胰蛋白酶(美国HyClone公司);Matrigel基质胶(美国Corning公司);Annexin V-FITC细胞凋亡检测试剂盒、BCA蛋白定量试剂盒(凯基生物科技发展有限公司);缺氧诱导因子(HIF)-1α、α-烯醇化酶(ENO1)、乳酸脱氢酶A(LDHA)、β-actin抗体(美国Bioworld Technology公司);CO2培养箱和生物安全柜(美国Thermo公司);Bio-Tek酶标仪ELX-800(美国Biotech公司);倒置荧光显微镜(德国Leica公司);ImageQuant LAS 500生物分子成像仪(美国GE公司);750D照相机(日本Canon公司)。
1.2细胞培养与药物配制 人结直肠癌HCT116细胞、人结肠癌上皮FHC细胞、人腹膜间皮HMrSV5细胞购自武汉普诺赛生物科技有限公司。细胞培养于含10%胎牛血清、1%链霉素(100 μg/mL)和青霉素(100 U/mL)的 RPMI1640 培养基中,置于37 ℃、饱和湿度、5%CO2培养箱内培养。使用0.25%胰蛋白酶消化传代,取对数生长期的细胞用于试验。羽扇豆醇使用无水乙醇和二甲亚砜(DMSO)(1∶1)混合液充分溶解,配制成 23 434.71 μmol/L的贮存液,置于-20 ℃分装保存。采用RPMI1640完全培养基稀释至相应的工作浓度。
1.3方法
1.3.1CCK-8法 以细胞浓度5×103个/孔接种至96孔板,设空白对照组(不加细胞),阴性对照组(不加药物,即0 μmol/L羽扇豆醇组)、溶剂组(DMSO+无水乙醇)、羽扇豆醇组(药物浓度分别为10、20、40、80、160 μmol/L),每组各5个复孔,分别于37 ℃,5% CO2培养箱中孵育24、48、72 h。吸弃旧培养基,每孔加入新鲜培养基100 μL和CCK-8试剂10 μL,于37 ℃孵育3 h,酶标仪检测450 nm处各孔吸光度值(A值),并计算抑制率和半数抑制浓度(IC50)。抑制率=(A阴性对照组-A羽扇豆醇组)/(A阴性对照组-A空白对照组)×100%。
1.3.2克隆形成试验 将细胞按8×102个/孔接种于12孔板中,细胞贴壁后,按羽扇豆醇终浓度为0、20、40、60 μmol/L分为0、20、40、60 μmol/L羽扇豆醇组(简称0、20、40、60 μmol/L组)4组,每组设置 3个复孔。培养7 d后,弃去培养液,用磷酸盐缓冲液(PBS)浸洗2次,95%乙醇固定10 min,风干后用0.1%结晶紫染色10 min,蒸馏水冲洗3次,风干后拍照,计数细胞克隆数量。
1.3.3划痕愈合试验 细胞于12孔版中培养,待融合率达到90%以上时,用枪头垂直划痕,PBS洗去划下的细胞,分别加入终浓度为0、20、40、60 μmol/L羽扇豆醇的无血清培养基继续培养。分别在0、24、48 h于倒置显微镜拍摄细胞划痕愈合情况,并使用Image J软件计算细胞间距离均值。迁移率=(1-测量的宽度/0 h的平均测量宽度)×100%。
1.3.4Transwell试验 用预冷的无血清培养基以1∶3的体积比稀释Matrigel基质胶,取40 μL加入预冷的Transwell小室中,37 ℃孵育2 h,使Matrigel基质胶凝固。吸走小室中多余的液体,并在上室、下室分别加入100、600 μL无血清培养基,37 ℃平衡过夜。计数1×105个细胞,用100 μL无血清培养基重悬,加入Transwell小室上室,分别将终浓度为0、20、40、60 μmol/L羽扇豆醇加载到细胞悬液中。在下室加入600 μL完全培养基。在37 ℃,5%CO2培养箱中孵育48 h后,取出小室,用棉签擦去上室的细胞,倒置显微镜观察小室中的细胞并拍照,计数侵袭细胞的总数。
1.3.5流式细胞术 以2×105个/孔细胞浓度接种于6孔板中,终浓度0、20、40、60 μmol/L羽扇豆醇干预细胞48 h后收集细胞,按照Annexin V-FITC细胞凋亡检测试剂盒说明书进行操作,并采用流式细胞术检测细胞凋亡情况。
1.4TMT标记定量蛋白质组学及生物信息学分析
1.4.1细胞处理 以2×105个/孔细胞浓度接种于6孔板中,并分为阴性对照组(不加药物)和羽扇豆醇组(加入48 μmol/L羽扇豆醇),每组设置3个复孔,于37 ℃,5%CO2培养箱中孵育48 h后收集细胞,收获细胞沉淀并于-80 ℃保存。
1.4.2数据检索和差异蛋白筛选 上述标本送广州辉骏生物科技股份有限公司进行TMT标记定量蛋白质组学检测,并筛选出差异蛋白,筛选条件设置为:(1)至少 2 次重复鉴定到的蛋白;(2)肽段数≥2;(3)选择重复性好的蛋白,即CV<0.5 %;(4)P<0.05;(5)计算各组数据比值的均值(AVG),以AVG≥1.200为上调蛋白,AVG≤0.833为下调蛋白。
1.4.3Gene Ontology(GO)功能富集及KEGG信号通路注释分析 通过R软件,从GO、KEGG数据库中获取每个差异蛋白所对应的功能,设置筛选条件为P<0.05,并计算每种功能上的蛋白富集数,最后将排名前20的GO分析结果和 KEGG 通路绘制成气泡图。
1.4.4蛋白质互作网络(PPI)分析 应用STRING数据库(https://cn.string-db.org/)将蛋白与库中的相应物种蛋白进行比对,并提取蛋白序列,进行PPI分析。
1.5蛋白质免疫印迹法检测相关蛋白的表达水平 细胞接种于6孔板中,以终浓度0、20、40、60 μmol/L羽扇豆醇干预细胞48 h后收集细胞,加入裂解液冰上裂解30 min,12 000×g,4 ℃离心20 min,取上清液,BCA法蛋白定量。95 ℃变性5 min,每组取40 μg总蛋白样本于10%聚丙烯酰胺凝胶电泳,用聚偏乙烯(PVDF)膜进行转膜,5%脱脂奶粉对膜封闭1 h,加入稀释比为1∶1 000的一抗和稀释比为1∶5 000的内参后,4 ℃孵育过夜。TBST清洗PVDF膜2次,每次15 min,用辣根过氧化物酶标记的二抗在室温下孵育2 h,TBST清洗PVDF膜2次后,加入ECL化学发光试剂,通过ImageQuant LAS 500生物分子成像仪曝光显色。
2 结 果
2.1羽扇豆醇对结直肠癌HCT116细胞生物学功能的影响
2.1.1羽扇豆醇抑制HCT116细胞的增殖 分别使用终浓度为0、10、20、40、80、160 μmol/L的羽扇豆醇作用HCT116细胞24、48、72 h,如图1A所示,不同浓度的羽扇豆醇对HCT116细胞有不同程度的增殖抑制作用,并呈明显的时间-剂量依赖性。另外,羽扇豆醇作用HCT116细胞24、48、72 h后的IC50分别为(60.71±4.11)、(48.4±2.26)和(40.79±2.97)μmol/L,IC50随作用时间延长而明显下降,差异有统计学意义(P<0.05),见图1B。图1C显示,分别经溶剂和不同浓度的羽扇豆醇干预48 h后,人正常结肠上皮FHC细胞及人腹膜间皮HMrSV5细胞的存活率比较,差异无统计学意义(P>0.05)。

注:A为羽扇豆醇对HCT116细胞的抑制率;B为羽扇豆醇作用HCT116细胞24、48、72 h后的IC50比较;C为羽扇豆醇对FHC、HMrSV5细胞的存活率。与24 h比较,*P<0.05;与48 h比较,#P<0.05。
2.1.2羽扇豆醇抑制HCT116细胞的克隆形成能力 与0 μmol/L组比较,20 μmol/L组对HCT116细胞的克隆形成能力影响不明显,差异无统计学意义(P>0.05),而40 μmol/L组及60 μmol/L组可明显抑制细胞克隆形成能力,差异均有统计学意义(P<0.05),并且HCT116细胞的克隆形成数量随着羽扇豆醇浓度升高呈减少趋势。见图2。

注:与0 μmol/L组比较,*P<0.05;与20 μmol/L组比较,△P<0.05;与40 μmol/L组比较,▲P<0.05。
2.1.3羽扇豆醇抑制HCT116细胞的迁移能力 经40 μmol/L羽扇豆醇干预48 h后,HCT116细胞的迁移率为(50.83±5.55)%,明显低于0 μmol/L组的(81.51±2.69)%,差异有统计学意义(P<0.05)。随着羽扇豆醇浓度增加,HCT116细胞迁移率进一步下降,在羽扇豆醇浓度为60 μmol/L时,HCT116细胞的迁移率仅为(32.62±5.30)%,明显低于0 μmol/L组、20 μmol/L组和40 μmol/L组,差异均有统计学意义(P<0.05)。见图3。
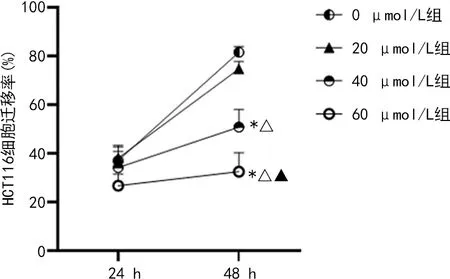
注:与0 μmol/L组比较,*P<0.05;与20 μmol/L组比较,△P<0.05;与40 μmol/L组比较,◆P<0.05。
2.1.4羽扇豆醇抑制HCT116细胞的侵袭能力 Transwell试验结果显示,与0 μmol/L组比较,20 μmol/L羽扇豆醇作用HCT116细胞后,细胞侵袭能力无明显改变,差异无统计学意义(P>0.05);而经40 μmol/L及60 μmol/L的羽扇豆醇干预后,细胞侵袭个数明显减少,差异均有统计学意义(P<0.05)。见图4。

注:与0 μmol/L组比较,*P<0.05;与20 μmol/L组比较,△P<0.05;与40 μmol/L组比较,▲P<0.05。
2.1.5羽扇豆醇诱导HCT116细胞发生凋亡 20 μmol/L与40 μmol/L的羽扇豆醇干预HCT116细胞48 h后无明显细胞凋亡发生,而60 μmol/L的羽扇豆醇可明显诱导细胞凋亡,其中早期凋亡率为(7.33±0.35)%,晚期凋亡率为(7.33±1.44)%,与0 μmol/L组比较明显增高,差异均有统计学意义(P<0.05);但早期、晚期凋亡率比较,差异无统计学意义(P>0.05)。见图5。

注:A为早期凋亡率;B为晚期凋亡率;与0 μmol/L组比较,*P<0.05;与20 μmol/L组比较,△P<0.05;与40 μmol/L组比较,▲P<0.05。
2.2羽扇豆醇对结直肠癌HCT116细胞TMT标记定量蛋白质组学及生物信息学分析结果
2.2.1差异表达蛋白分析 共490种表达差异明显的蛋白质在0 μmol/L组与其他浓度羽扇豆醇组比较中被发现,其中表达上调蛋白269种,表达下调蛋白221种。进一步对蛋白集合的定量信息进行归一化处理,即归一化至-1,1;同时使用Complexheatmap R包(Version 3.4)对样品和蛋白表达量2个维度进行分类,并生成层次聚类热图,见图6A。热图中列举了差异明显的前50种蛋白表达情况,蛋白上调程度越高,颜色越红;蛋白下调程度越低,颜色越绿,黑色代表中间表达的蛋白。图6B火山图中每个点代表一种蛋白,黑色是表达在阴性对照组与羽扇豆醇组中无差异的蛋白,蓝色点代表下调的蛋白,红色点则代表上调的蛋白。

注:A为羽扇豆醇差异蛋白表达量聚类热图;B为羽扇豆醇差异蛋白数目的火山图。
2.2.2差异蛋白的GO功能富集分析 利用GO功能富集分析,将上述490种差异蛋白富集在生物学过程、细胞组分和分子功能3个层面上的二级条目及其蛋白数目。在生物学过程中,差异蛋白主要富集在L-丙氨酸跨膜转运、p53信号通路、纺锤体中区组装、LSU-rRNA的成熟、二磷酸腺苷代谢过程等生物学过程中。在细胞组分中,差异蛋白主要富集在核仁腔、血小板α颗粒腔、内质网内腔等细胞部位。在分子功能中,差异蛋白主要富集在L-丙氨酸跨膜转运体活性、运货受体活性、丝氨酸型内肽酶抑制剂活性、L-抗坏血酸结合等活性分子功能上。
2.2.3差异蛋白的KEGG信号通路注释分析 差异蛋白进行KEGG信号通路注释分析后发现,差异蛋白主要富集在糖酵解/糖异生、HIF-1信号通路、病毒蛋白与细胞因子及细胞因子受体的相互作用、淀粉和蔗糖代谢途径等信号通路上。见图7。
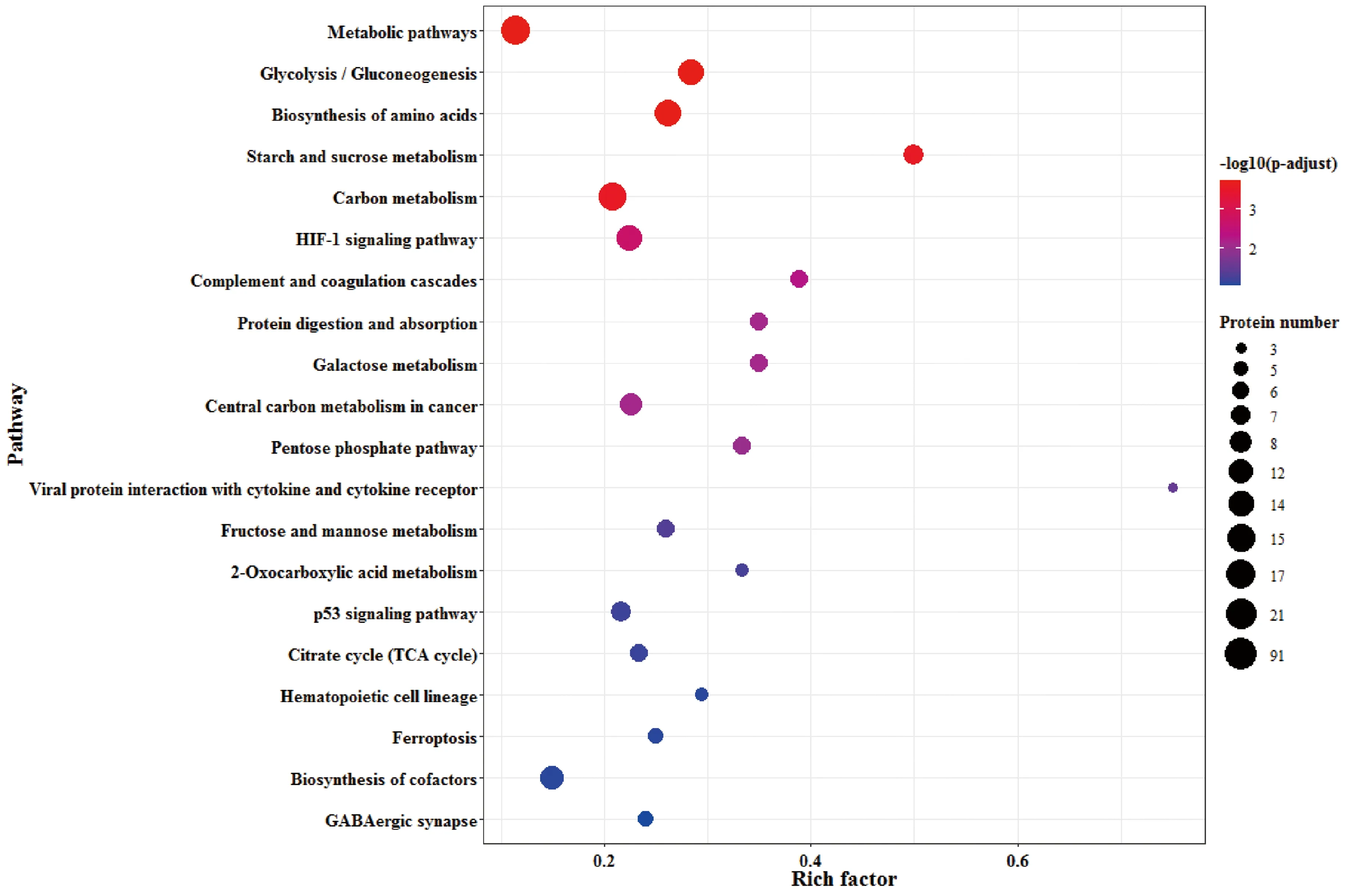
图7 KEGG信号通路注释分析气泡图
2.2.4差异蛋白PPI分析 为进一步探索差异蛋白之间的相互作用,本研究应用 STRING 数据库对490种差异蛋白进行分析,并构建PPI,其中关联度前10的蛋白分别为LDLR、APP、AURKB、ENO1、CALCOCO2、CCNB1、CDC20、CDCA8、LDHA、ECT2,这些蛋白与其他蛋白存在较为紧密的相互作用关系(图8)。另外,参与糖酵解途径的关键酶ENO1和LDHA位于上述差异蛋白的关键节点上。

图8 差异蛋白PPI分析结果
2.3羽扇豆醇对糖酵解途径相关蛋白表达水平的影响 经不同浓度的羽扇豆醇干预HCT116细胞48 h后,细胞中HIF-1α、ENO1和LDHA蛋白表达水平出现明显改变,随着羽扇豆醇干预浓度增高,HIF-1α、ENO1、LDHA蛋白表达水平均呈不同程度减少(图9)。

注:A为各组HCT116细胞的HIF-1α、ENO1、LDHA蛋白表达情况;B为各组HIF-1α蛋白相对表达水平;C为各组ENO1蛋白相对表达水平;D为各组LDHA蛋白相对表达水平。与0 μmol/L组比较,*P<0.05;与20 μmol/L组比较,△P<0.05;与40 μmol/L组比较,▲P<0.05。
3 讨 论
随着中药扶正祛邪的机制及促进人体免疫力的研究进展,中药在癌症预防、早期治疗,甚至是在癌症中晚期的应用方面具有明显优势[11-12]。据报道,羽扇豆醇对前列腺癌、肺癌、膀胱癌等恶性肿瘤具有良好的治疗效果,其机制涉及MAPK/ERK、PI3K/AKT/mTOR等多种细胞内信号通路的改变[13-14]。值得注意的是,与传统抗肿瘤药物不同,羽扇豆醇已被证实对正常细胞、组织、小鼠无毒,并且具有有效的治疗剂量[9-10]。本研究结果显示,羽扇豆醇能明显抑制HCT116细胞的增殖,且呈时间-剂量依赖性,但对人正常结肠上皮FHC细胞及人腹膜间皮HMrSV5细胞无抑制作用。进一步的细胞功能试验提示,羽扇豆醇可明显抑制HCT116细胞的克隆形成、迁移和侵袭能力,同时能有效诱导细胞凋亡,由此提示羽扇豆醇在治疗结直肠癌方面具有一定的临床价值。
本研究进一步通过TMT标记定量蛋白质组学及生物信息学分析探讨其潜在的分子机制。经TMT标记定量蛋白质组学分析显示,共筛选出490种有明显差异表达的蛋白,其中表达上调蛋白269种,表达下调蛋白221种。GO功能富集分析提示,差异蛋白主要参与了细胞分裂、增殖、凋亡及营养物质代谢等生物学过程,以上过程与肿瘤的发生和发展密切相关。通过KEGG信号通路注释分析发现,羽扇豆醇的抑癌作用可能与糖酵解/糖异生、HIF-1信号通路、淀粉和蔗糖代谢途径等信号通路相关。有氧糖酵解途径是肿瘤细胞特征性的代谢方式,肿瘤细胞通过增强糖酵解活性和产生大量乳酸及快速生成三磷酸腺苷(ATP),促进癌细胞的生长与转移[15]。本研究构建PPI分析发现,糖酵解途径中的关键酶ENO1和LDHA均位于差异蛋白的关键节点上。因此,本研究推测羽扇豆醇的抗结直肠癌作用可能与抑制细胞糖酵解通路有关。
ENO1属于一种烯醇化酶,在糖酵解过程中催化2-磷酸甘油酸转化为磷酸烯醇丙酮酸,在大多数肿瘤细胞中表达水平升高,是糖酵解途径的关键酶之一[16]。ENO1可通过糖酵解途径向肿瘤细胞提供代谢所需要的ATP,对肿瘤细胞具有抑制凋亡和促进增殖的作用[17-18],但在正常细胞中无此作用,其原因可能是因为肿瘤细胞处于缺氧微环境,重新调节了糖酵解途径,最终使糖酵解酶增加,而正常细胞则无此现象[19]。另外,ENO1可激活糖酵解途径,改善肿瘤细胞对低氧的能量失衡,诱导肿瘤新生血管形成,促进结直肠癌细胞的增殖、侵袭和体外转移[20]。LDHA也是糖酵解途径的关键酶,处于糖酵解反应的终末端,在多种癌症中呈过表达,可作为一种生物标志物,与预后不良相关[21]。LDHA能将丙酮酸转化为乳酸,降低细胞对氧气的依赖性,为肿瘤细胞生长和增殖提供能量,并且可抑制肿瘤细胞凋亡,促进肿瘤的恶性进展[22]。
HIF-1α是一种氧敏感转录因子,介导对缺氧的适应性代谢反应,在大多数肿瘤组织、细胞中可诱导糖酵解相关基因的表达,通过改变能量代谢、促进细胞增殖、血管生成和血管重塑等方式提高细胞在缺氧环境中的适应性,促进肿瘤生长,与患者预后不良及肿瘤耐药密切相关[23]。据报道,ENO1与LDHA均是HIF-1α的下游信号分子,在糖酵解过程中,HIF-1α可通过与ENO1和LDHA启动子中的低氧反应原件结合,调节ENO1和LDHA表达和靶基因转录,诱导细胞对缺氧的适应性反应,同时随着乳酸生成和葡萄糖利用增加,从而促进肿瘤细胞生长[24-25]。因此,HIF-1α与ENO1、LDHA的表达均呈正相关,并且均能促进肿瘤细胞的生长和转移。本研究中,羽扇豆醇作用于结直肠癌HCT116细胞后,HIF-1α、ENO1和LDHA蛋白表达水平均明显降低,提示羽扇豆醇可抑制HIF-1α表达,进一步下调其下游靶标ENO1和LDHA蛋白表达水平,减少乳酸及ATP产生,最终抑制糖酵解途径,导致HCT116细胞增殖及转移能力受限,并诱导细胞凋亡。上述分子功能和潜在相关通路与生物信息学分析综合结果趋势一致。
综上所述,羽扇豆醇可明显抑制HCT-116细胞增殖、克隆、迁移、侵袭的能力,同时可诱导细胞凋亡,其作用机制可能与下调糖酵解信号通路中HIF-1α、LDHA和ENO1蛋白的表达水平有关。

