MMP1基因rs491152多态性与COPD发生和发展的相关性分析*
唐李凤,钟雪梅,马 涛,弓 慧,郑爱芳,解承鑫,李菲菲,李 黎,△
1.石河子大学医学院,新疆石河子 832000;2.喀什地区第一人民医院呼吸与危重症医学科,新疆喀什844000;3.喀什地区第一人民医院新疆感染性疾病(结核病)临床医学研究中心,新疆喀什 844000
慢性阻塞性肺疾病(COPD)是一种常见的呼吸道疾病,位于中国主要死因的第4位[1]。一项流行病学调查显示,中国喀什地区农村40岁以上维吾尔族人群COPD的发病率高达17.01%[2],明显高于全国平均水平[3]。遗传因素在COPD的发生和发展过程中起重要作用[4],在中国维吾尔族人群中鉴定COPD相关的基因突变可以对其提供一定依据和理论基础,帮助理解这一现象。目前随着高通量测序技术的广泛应用,基因组学的研究可以把分子诊断策略广泛地应用于COPD的诊断和治疗中。蛋白质编码基因仅占人类基因组的1%左右,但包含所有突变的85%,并且明显影响疾病的相关性状[5],全外显子测序(WES)有助于获得对各种人类疾病的相关见解[5]。本研究对3个维吾尔族COPD家系进行WES,经过生物信息学分析,获得一个新的候选突变——基质金属蛋白酶1(MMP1)基因rs491152[6]。蛋白酶-抗蛋白酶失衡是COPD的众多重要病理特征之一,抗蛋白酶相对缺乏,肺组织结构被分解破坏可导致终末气道扩张而引起肺气肿。MMPs能够降解许多细胞外分子和生物活性分子,是降解细胞外基质的主要蛋白酶[7]。MMP1基因位于染色体11q22.3,包含10个外显子,是MMP基因簇的一部分,在细胞外基质重塑中降解纤维性胶原。长期吸入香烟烟雾(CS)会诱发蛋白过度水解,CS可能通过激活细胞外信号调节激酶1/2信号转导通路[8]和Toll样受体4信号级联反应[9]介导MMP1表达增加,从而导致肺组织过多破坏,进而发展为肺气肿。多项研究表明,MMP1在COPD患者血清中表达增加,且受CS的明显影响,提示MMP1在COPD的病理生理机制中发挥重要作用[9-11]。单核苷酸多态性(SNP)是个体最常见的遗传变异,可能影响启动子活性(基因表达)、信使 RNA构象及mRNA和(或)蛋白质的亚细胞定位,进而参与疾病的发生和发展[12]。MMP1基因SNPs可能与COPD的发生和发展密切相关[13-15],但此前关于MMP1基因在COPD中的研究多集中在启动子中 (-1607 1G/2G) 的rs1799750 SNP,且结论存在争议[13-18]。更多多态性位点对于理解MMP1基因SNPs在COPD的发生和发展中的作用至关重要。此外,MMP1基因rs491152多态性与COPD肺功能评估指标是否相关,能否成为未来预测COPD发生和发展的标志物,亟待进一步研究。本研究旨在通过基于喀什地区维吾尔族人群的病例对照研究来评估MMP1基因rs491152多态性与COPD发生和发展的相关性,现报道如下。
1 资料与方法
1.1一般资料 选取2018-2019年于喀什地区招募病例对照研究队列入组。541例COPD患者(病例组)和534例健康对照者(对照组)均来自喀什地区第一人民医院,其中病例组男280例,女261例;对照组男234例,女300例。COPD的诊断符合COPD全球倡议概述的诊断标准,即吸入支气管扩张剂后第1秒用力呼气容积(FEV1)/用力肺活量(FVC)<70%[19]。受试者的纳入和排除标准与GONG等[20]报道一致。所有受试者为3代以上居住在喀什地区的维吾尔族人群,年龄均大于40岁。录入所有受试者的性别、年龄、体质量指数(BMI)、吸烟状况等基线资料。本研究通过喀什地区第一人民医院伦理委员会审核批准,所有受试者均知情同意并签署知情同意书。
1.2MMP1基因rs491152位点的来源 MMP1基因rs491152位点来源于COPD家系的WES,具体筛选说明详见XU等[6]的研究报道。WES被用于3个家庭共9名成员(8名患者,1名健康对照者)。通过WANG等[21]研究(https://annovar.openbioinformatics.org/)进行突变注释,并将单核苷酸变异(SNV)在1000 Genomes、COSMIC、ClinVar、esp6500、ExAC_ALL、GWAS Catalog等不同数据库进行比较,从而得到更为准确的注释结果。之后对上述步骤获得的SNV进行生物信息学分析,包括致病性评估、GO富集分析、通路富集分析及蛋白质相互作用网络分析等。最终筛选出在家系中患病与健康成员之间差异表达位点——MMP1基因rs491152。
1.3DNA提取及目标位点基因分型 于清晨时采集1 075例受试者空腹外周静脉血5 mL,采用Greiner基因组DNA提取试剂盒(Greiner、Pleidelsheim、Germany)按照说明书步骤从全血中提取DNA。NanoDrop 2000(Thermo Fisher Scientific、Waltham、MA、USA)用于检测DNA纯度。采用48-Plex SNPscan试剂盒(Center for Genetic & Genomic Analysis,Genesky Biotechnologies Inc.,Shanghai,China)对目标位点进行Sanger测序[20]。分型成功率在98%以上。最后采用ABI3730XL(ABI、USA)测序器和Genemapper4.1(AppliedBiosystems,USA)分析位点多态性。
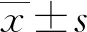
2 结 果
2.1两组一般资料比较 两组在煤炭暴露史、木炭暴露史和家庭年收入方面比较,差异均无统计学意义(P>0.05);两组在年龄、性别、BMI、吸烟状况、吸烟指数(SI,SI=每天吸烟支数×吸烟年数)、FEV1%和FEV1/FVC方面比较,差异均有统计学意义(P<0.05)。见表1。
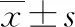
表1 两组一般资料比较[n(%)或或M(P25~P75)]

组别n吸烟状况从不吸烟曾吸烟当前吸烟SI<1≥1~400>400~800>800病例组541 417(77.08)23(4.25)101(18.67)417(77.08)98(18.11)16(2.96)10(1.85)对照组534465(87.08)17(3.18)52(9.74)465(87.08)52(9.74)11(2.06)6(1.12)P<0.001<0.001

组别n煤炭暴露史是否木炭暴露史是否肺功能指标FEV1(%)FEV1/FVC病例组541513(94.82)28(5.18)519(95.93)22(4.07)69.00(53.92~82.00)0.62(0.55~0.66)对照组534516(96.63)18(3.37)500(93.63)34(6.37)86.00(74.00~98.00)0.80(0.75~0.86) P0.1440.090<0.001<0.001
2.2Hardy-Weinberg平衡检验 分别对病例组和对照组中所检测到的MMP1基因rs491152基因型分布频率进行Hardy-Weinberg平衡检验,结果显示,此多态性位点的基因型在对照组中分布均符合Hardy-Weinberg平衡(P>0.05),具有群体代表性。
2.3MMP1基因rs491152与COPD风险的相关性分析 MMP1基因rs491152位点在病例组和对照组的分型成功率分别为98.89%(535/541)、99.63%(532/534)。多因素Logistic回归分析结果显示,rs491152位点在所有遗传模型下与COPD风险比较,差异均无统计学意义(P>0.05),见表2。

表2 MMP1基因rs491152基因型和等位基因频率在病例组和对照组中的分布情况比较[n(%)]
2.4吸烟组和非吸烟组中MMP1基因rs491152的基因型分布及其与COPD风险的相关性分析 根据吸烟史进行亚组分析,采用校正年龄、性别和BMI后的多因素Logistic回归方法进行统计学分析,结果显示,非吸烟组和吸烟组中rs491152与COPD风险比较,差异均无统计学意义(P>0.05)。见表3。

表3 MMP1基因 rs491152在吸烟组和非吸烟组中的遗传模型分析
2.5MMP1基因rs491152多态性与COPD患者肺功能损伤的关系 多因素Logistic回归分析结果显示,MMP1基因rs491152多态性与肺功能严重程度评估指标之间比较,差异均无统计学意义(P>0.05),见表4。
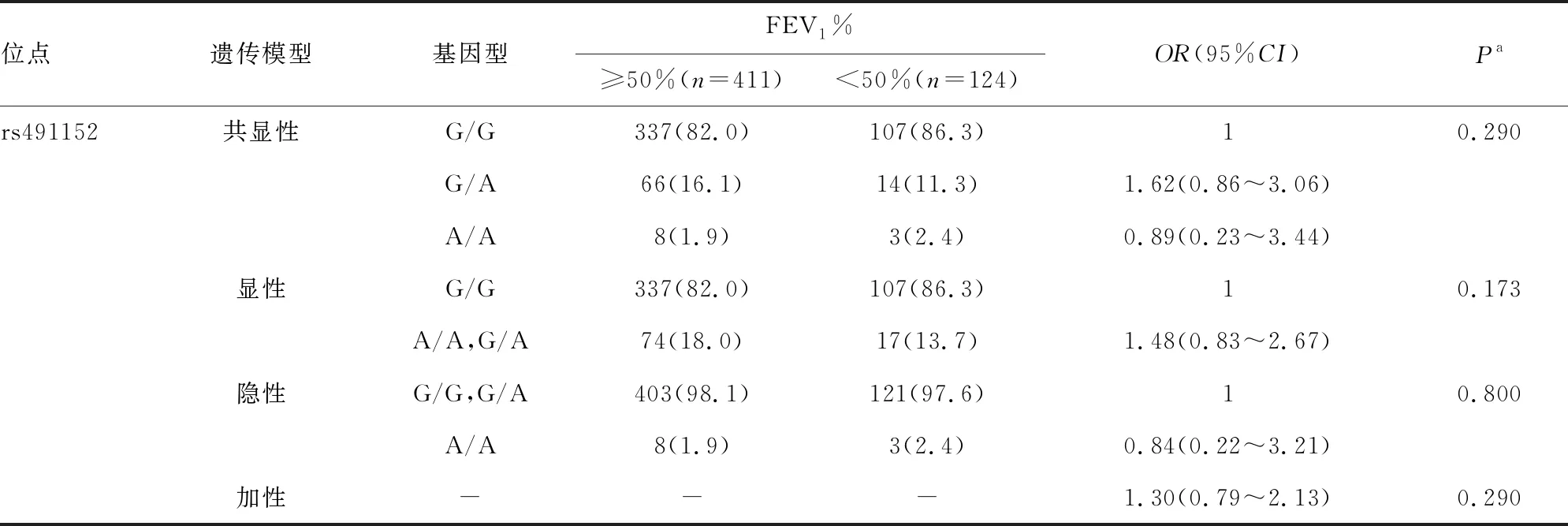
表4 MMP1基因rs491152在病例组不同FEV1%中的分布情况比较[n(%)]
3 讨 论
COPD是一种复杂的、多因素的、多基因的疾病[22]。许多研究试图通过寻找突变来评估基因与COPD之间的关系。本研究对来自3个维吾尔族COPD家系的受试者进行了WES,经过生物信息学分析,获得了在患者和健康成员间差异表达位点MMP1基因rs491152。本研究在喀什地区维吾尔族人群中进一步评估了MMP1基因rs491152与COPD发生和发展的相关性,然而并没有观察到MMP1基因rs491152对COPD的致病或保护作用,并且与是否吸烟无关。在对FEV1%的分层分析中发现,rs491152 SNP也不影响肺功能的严重程度。
蛋白酶介导的弹性蛋白破坏的是肺实质中的主要结缔组织成分,被认为是肺气肿的一个重要特征[22]。MMP1基因主要作用底物为纤维性胶原,可降解细胞外基质中的胶原纤维[7],从而在呼吸道组织重塑的调节过程中起重要作用。进行性肺泡损伤是由于选择性细胞外基质成分的降解,这可能与其不受调控、过度的蛋白质水解有关[23]。SNPs与基因表达、功能、表型和疾病均有关[12],识别基因中的许多变异并分析其影响可能会有助于更好地理解它们对基因功能和个体健康的影响。遗传证据表明,MMP1基因启动子多态性-1607 1G/2G与COPD易感性相关,突变纯合子GG/GG基因型是COPD的高危因素[14-15]。JOOS等[13]研究发现,-1607 1G/2G与连续吸烟者肺功能下降率相关,且-1607 GG等位基因明显影响肺功能的快速下降率。然而,遗传研究并没有提供一致的结果。BCHIR等[18]研究表明,MMP1基因-1607 1G/2G、-519 A/G可能不影响突尼斯人群COPD风险和疾病严重程度。在中国北方汉族、韩国人群中同样未观察到MMP1基因-1607 1G/2G与COPD易感性的相关性[16-17]。HERNANDEZ-MONTOYA等[24]在330例有吸烟史COPD患者、658例无吸烟史COPD患者和150例健康非吸烟者中评估了MMP1基因其他3个位点(rs470215、rs7125062、rs2071232),但这些SNPs与墨西哥人群COPD并不相关。本研究在1 075例维吾尔族受试者中尝试寻找新突变,然而并未观察到MMP1基因rs491152 SNP与COPD易感性、严重程度之间的明显关联。此外,在本研究的吸烟分层分析中,MMP1基因rs491152同样未显示出与COPD易感性明显关联。基于上述文献资料可发现,MMP1基因SNPs与COPD的相关性仍存在争议,出现这种现象的原因可能是:样本量小、遗传异质性、环境(CS暴露)异质性等。
本研究纳入的COPD样本为散发人群,覆盖了喀什地区下辖的大部分区域,在一定程度上降低了选择偏倚对结果的影响。在吸烟状况的亚组分析中观察到rs491152多态性与COPD易感性无明显相关性,而吸烟组的样本量较少,这只能表明MMP1基因rs491152可能不是预测非吸烟人群COPD易感性的重要标志物。鉴于MMP1基因参与CS相关的肺气肿病理机制,因此,有必要通过扩大吸烟组样本量来进一步评估二者的关系。值得注意的是,这项研究的人群验证是基于喀什的民族特征——维吾尔族,这并不意味着rs491152 SNP与其他人群的COPD无关,尤其是吸烟人群。
维吾尔族COPD家系WES筛选出一个COPD潜在的候选突变——MMP1基因rs491152,基于人群的病例对照研究却表明MMP1基因rs491152 SNP可能不是预测中国维吾尔族非吸烟人群COPD发生和发展的重要标志物。尽管MMP1基因与CS诱发的肺气肿密切相关,然而支持胶原分解参与COPD病理机制的证据不足,其在COPD发生和发展机制中的确切功能仍然是一个悬而未解决的问题。MMP1基因rs491152 SNP与其他人群COPD的关系,尤其是吸烟人群,以及MMP1基因更多位点在COPD病理机制中的作用有待进一步探索。

