牦牛PKN2基因克隆与组织表达特性的分析
马 妍,熊 燕,赵 丹,岳永起,范依琳,张姬越,冯欣欣,李 键
(1.青藏高原动物遗传资源保护与利用教育部重点实验室,四川 成都 610041;2.青藏高原动物遗传资源保护与利用四川省重点实验室,四川 成都 610041;3.西南民族大学畜牧兽医学院,四川 成都 610041)
牦牛(Bos grunniens)是青藏高原特有的家畜,在高原区域社会发展和牧民的生活中是必不可少的生产生活资料[1].牦牛生活区域年均气温≤0℃,严寒时间占总季节时间长,枯草期长达多半年[2].牦牛体内沉积的脂肪组织在生长发育、抗逆适应性以及肉品质形成中发挥着重要的作用[3],目前关于牦牛脂肪沉积关键调控基因尚不完全清楚.
PKN是一种蛋白激酶C(Protein kinase C,PKC),也称为PRKs(蛋白激酶C相关激酶),是AGC(cAMP依赖性,cGMP依赖性和蛋白激酶C)激酶家族成员,PKN有三个主要的亚型:PKN1,PKN2和PKN3[4-6].PKN广泛分布于动物的多种组织中,在不同的组织发挥生物学功能具有特异性[7].其中PKN2是一种必须的丝氨酸/苏氨酸蛋白激酶成员,与细胞分化、胚胎中胚层发育、细胞迁移和癌症有关[8],可作为mTORC1信号传导的激活剂[9].PKN2缺失或PI3KC2-β中靶磷酸化位点失活抑制mTORC1信号传递[10-12].有文献显示,PKN2是Rho的效应蛋白,PKN2对胰腺星状细胞(Pancreatic stellate cells,PSC)分化为肌成纤维细胞分化至关重要,当PKN2基因缺失时,促进PSC的增殖,但收缩力和α-平滑肌肌动蛋白(α-smooth muscleactin,α-SMA)应激降低[13].当小鼠敲除PKN2基因时,胚胎成纤维细胞不能生长,导致胚胎致死.此外,研究表明PKN2在培养的骨骼肌细胞和小鼠体内胫骨前肌中对胰岛素信号和糖代谢有重要作用,干扰PKN2通过激活AMPK信号降低胰岛素刺激葡萄糖摄取、糖原合成和氧化[11-12].其他研究显示,敲低PKN2促进PGC-1α和脂肪合成相关基因SREBP-1c的转录及其靶基因的表达[12].上述结果表明,PKN2基因对于调控骨骼肌中的糖脂代谢有重要作用,而目前PKN2基因在牦牛中的作用尚不清楚.
因此,本实验以牦牛为研究对象,克隆PKN2的基因序列,对其CDS序列和蛋白质结构功能进行生物信息学分析;继而利用qPCR方法检测了其在牦牛脂肪、肌肉、睾丸、心脏等部位中的表达,为进一步探究PKN2基因在牦牛脂肪沉积中的作用提供基础数据.
1 材料与方法
1.1 试验样品的采集
本实验样品均采自四川省成都市青白江唐家寺屠宰场,均由四川阿坝羌族藏族自治州金川县庆林乡牦牛养殖场提供.采用颈静脉放血法处死公牦牛后,使用灭菌后的剪刀采集5~6岁健康牦牛的心、肝、脾、肺、肾、肌肉、脂肪、睾丸等组织样.将组织样品用高压灭菌后的PBS清洗干净,置于冻存管后装入液氮罐,运回-80℃冰箱后进行后续试验.
1.2 主要试剂和仪器
Trizol Reagent、DNA Marker DL5000、cDNA反转录试剂盒、2 x Taq PCR Master mix和2 x SYBR Green qPCR Mixture均购自TaKaRa公司;琼脂糖购自Biowest公司;PCR仪(ETC811)购自苏州东盛兴业科学仪器有限公司;荧光定量PCR仪(CFX96)购自美国Bio Rad公司;琼脂糖凝胶成像系统(CL1000)购自Invitrogen公司;氯仿、无水乙醇、试剂耗材均购自成都鹏世达有限公司.
1.3 组织总RNA提取与反转录
使用经典Trizol法提取牦牛各个组织样的RNA[14],利用紫外分光光度仪评估组织RNA的质量与浓度,使用诺唯赞的反转录试剂盒将OD260/280在1.8~2.0之间的RNA样进行反转录,获得各个组织的cDNA于-20℃备用.
1.4 PKN2基因引物设计
根据NCBI数据库中普通牛PKN2(登录号:XM_024 988 972.1)基因的预测序列,并设计合成克隆引物和荧光定量引物;根据NCBI牦牛数据库中PPIA(登录号:NM_178 320)的序列设计PPIA内参基因的引物,克隆及定量序列片段交于擎科公司合成,如表1所示.
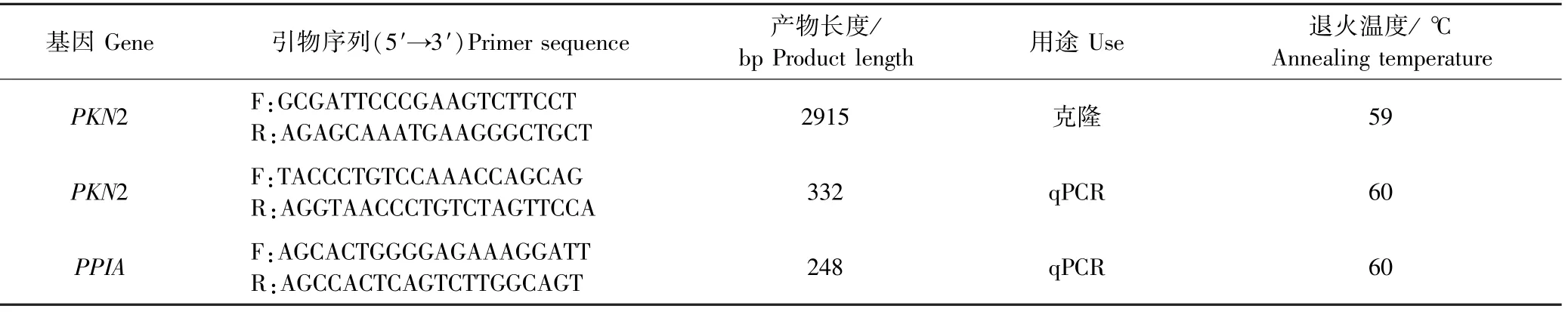
表1 引物序列Table 1 Primer sequences
1.5 牦牛PKN2基因的PCR扩增及测序
利用脂肪组织合成的cDNA为模板克隆PKN2基因.PCR扩增体系25 μL:2×Taq PCR MasterMix 12.5 μL,上、下游引物各1 μL,cDNA 3 μL,ddH2O 7.5 μL.PCR反应程序:95℃预变性3 min;95℃变性15 s,退火15 s(退火温度见表1),72℃延伸1 min,共35个循环;72℃延伸5 min;4℃保存.PCR获得的扩增产物用琼脂糖浓度为2%的凝胶进行电泳,切取目的片段于离心管中,使用试剂盒进行回收及纯化步骤.最终得到的20 μL PCR纯化液送至擎科公司进行双向测通.
1.6 PKN2基因生物信息学分析
对牦牛PKN2基因进行生物学分析软件和功能分析见表2.
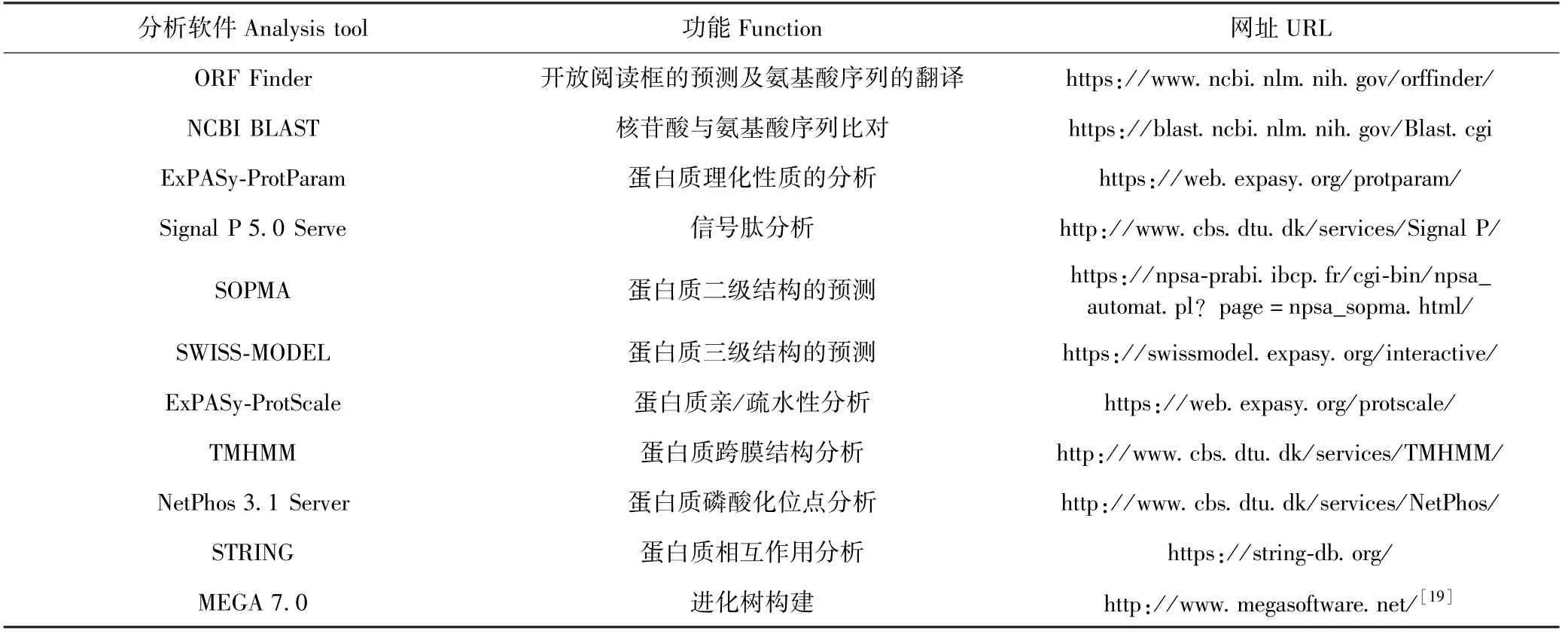
表2 生物信息学分析软件与在线网址Table 2 Bioinformatics analysis software and online websites
1.7 牦牛PKN2基因qPCR扩增
以脂肪中PPIA的相对表达量作为参考,利用荧光定量PCR技术检测PKN2基因在各个组织(心脏、肝脏、脾脏、肺脏、肾脏、肌肉、脂肪、睾丸)表达量,三头公牦牛为三个生物学重复且设置三个技术重复.RT-qPCR的反应体系为:2 x SYBR Green qPCR Mixture 7.5 μL、上下游引物各0.5 μL、5.5 μL ddH2O、1 μL cDNA.反应条件为:95℃预变性4 min;(95℃,10 s;60℃,30 s;72℃,45 s)45个循环;72℃延伸5 min.读取溶解曲线,检测PKN2基因在牦牛各个组织中的表达情况.
1.8 数据统计分析
RT-PCR结果利用2-ΔΔCt法计算PKN2在各个组织中的相对表达量,利用GraphPad Prism 8中的one way-ANOVA程序分析各个组织的差异显著性,当P<0.05时,表示差异显著.
2 结果
2.1 牦牛PKN2基因产物检测
以脂肪组织提取的cDNA为模板,如图1所示获得牦牛PKN2基因全长为2 915 bp,与预期目的产物大小相符.NCBI ORF Finder在线获得PKN2预测序列及翻译的氨基酸序列,开放阅读框大小为942 bp,共编码313个氨基酸.
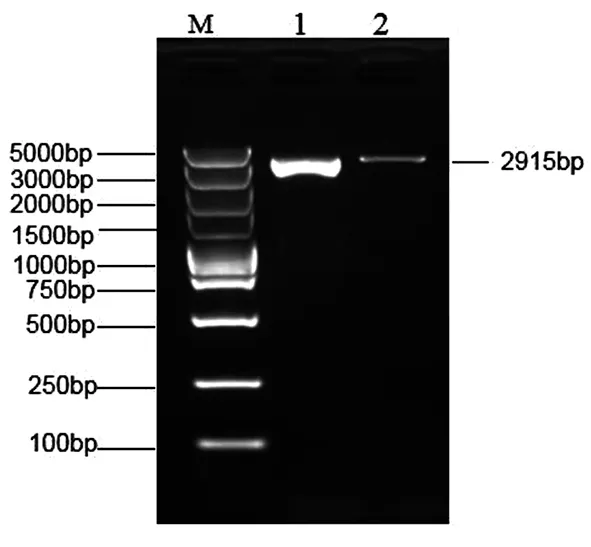
图1 牦牛PKN2基因克隆Fig.1 Gene clone of yak PKN2
2.2 牦牛PKN2基因生物信息学分析
2.2.1 PKN2基因同源性比对和构建进化树
利用在线BLAST对牦牛与穿山甲、大鼠、狗、马、绵羊、普通牛、人、山羊、小鼠、鸡、野猪的PKN2基因核苷酸和氨基酸序列进行同源比对,核苷酸与氨基酸比对结果为表3所示,牦牛与普通牛序列相似度最高,分别为99.84%和99.88%,与鸡的核苷酸序列和氨基酸序列相似度最低,仅分别为84.59%和91.39%.同时发现牦牛与下表其他物种的核苷酸与氨基酸序列的相似性均在84.59%以上,表明PKN2基因在以下物种进化过程中具有高度保守性[15].
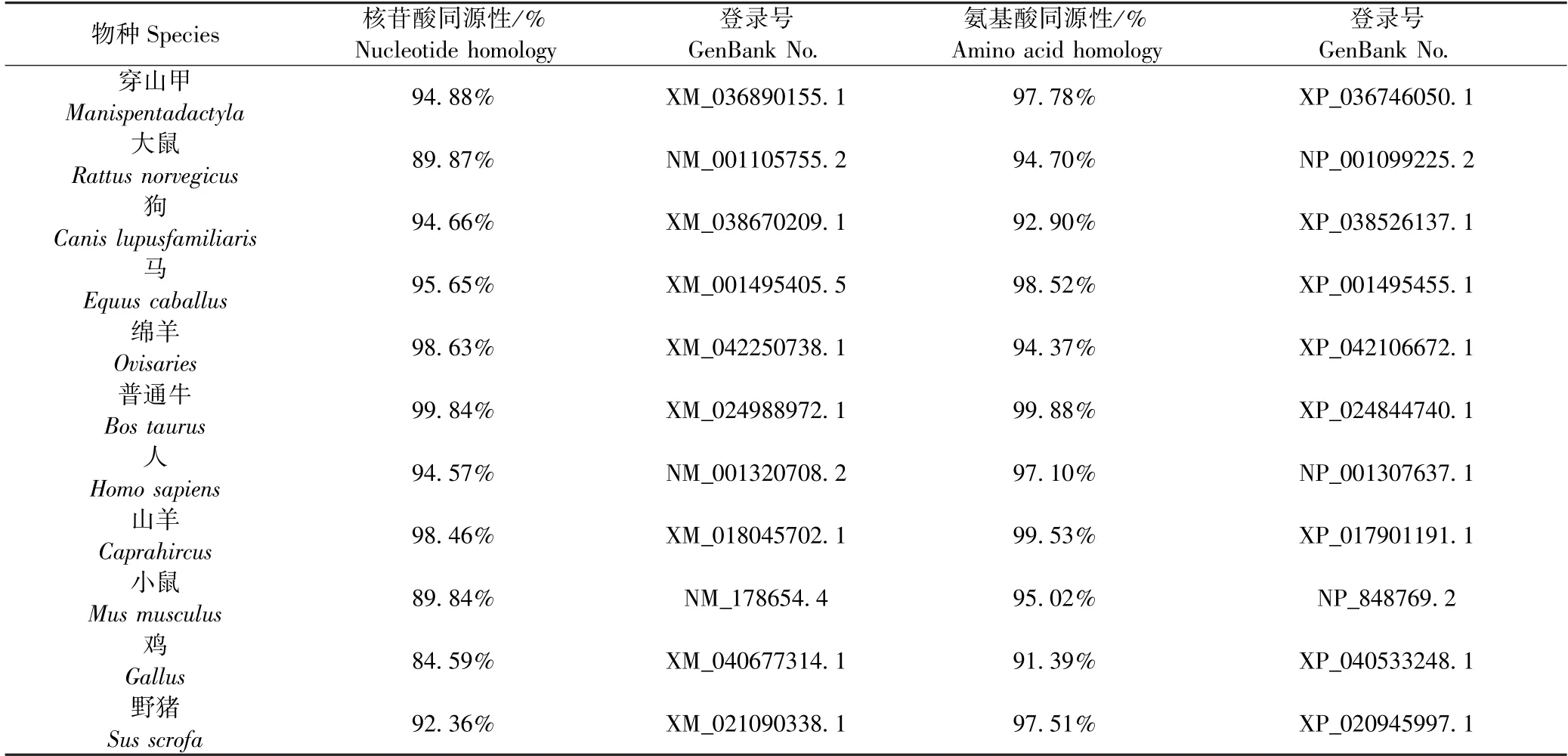
表3 牦牛PKN2基因与其他物种的核苷酸、氨基酸序列对比结果Table 3 Comparison of nucleotide and amino acid sequences of PKN2 gene among yak and other species
此外,用MEGA 7.0构建牦牛PKN2基因与其他物种的系统进化树,结果显示为图2,与序列结果比对一致,牦牛首先与普通牛在分类学上聚为一类,其次与反刍动物山羊、绵羊一类,与斑马鱼的亲缘关系最远,说明进化过程比较保守.以上分析结果表明PKN2基因符合物种进化规律.
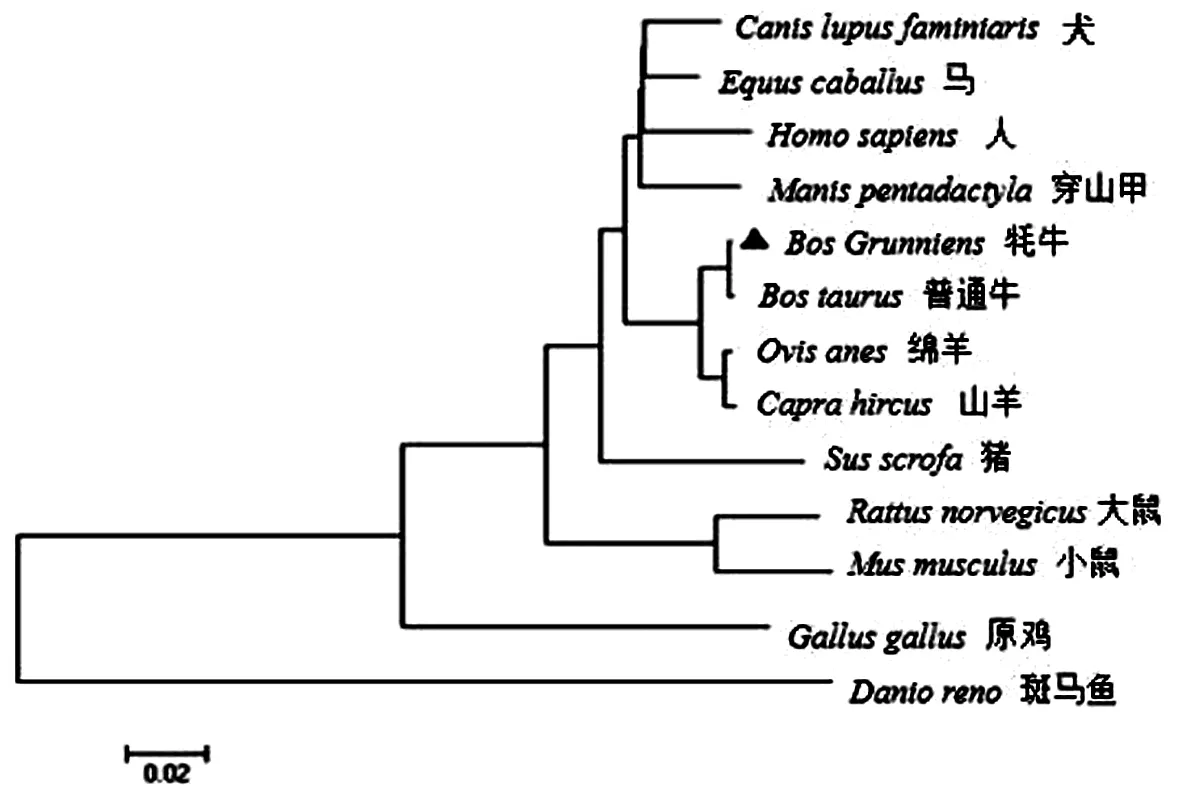
图2 牦牛与其他物种的PKN2基因系统进化树Fig.2 The phylogenetic tree of PKN2 in yak and other species
2.2.2 牦牛PKN2蛋白理化性质分析
使用ExPASy-ProtParam、TMHMM 2.0、Signal P 5.0等在线工具对PKN2蛋白的理化性质分析,得到其蛋白分子式为C4742H7535N1319O1442S38,分子质量为107 315.25 U,氨基酸数为942;PKN2蛋白的氨基酸组成中含量最高的三种氨基酸分别是亮氨酸(Leu)10.2%、谷氨酸(Glu)8.2%、丝氨酸(Ser)7.9%.带正电荷(Arg+Lys)的氨基酸总数为126,带负电荷(Asp+Glu)的氨基酸总数为142.PKN2在哺乳动物的红细胞中半衰期为30 h;脂肪指数为82.68;亲水性平均值为(GRAVY):-0.492;不稳定指数(Ⅱ)为50.33.提示PKN2蛋白属于亲水不稳定蛋白.
利用TMHMM 2.0在线工具分析发现PKN2蛋白没有跨膜结构和信号肽;使用PSORTII在线工具分析发现,PKN2蛋白主要存在于细胞核(65.2%),也存在于细胞质(26.1%)、内质网(4.3%)、线粒体(4.3%)[16].使用Net Phos 3.1在线工具预测发现牦牛PKN2蛋白有101个磷酸化位点,结果显示为图3,其中丝氨酸(Ser)磷酸化位点67个、苏氨酸(Thr)磷酸化位点29个、酪氨酸(Tyr)磷酸化位点5个[17].
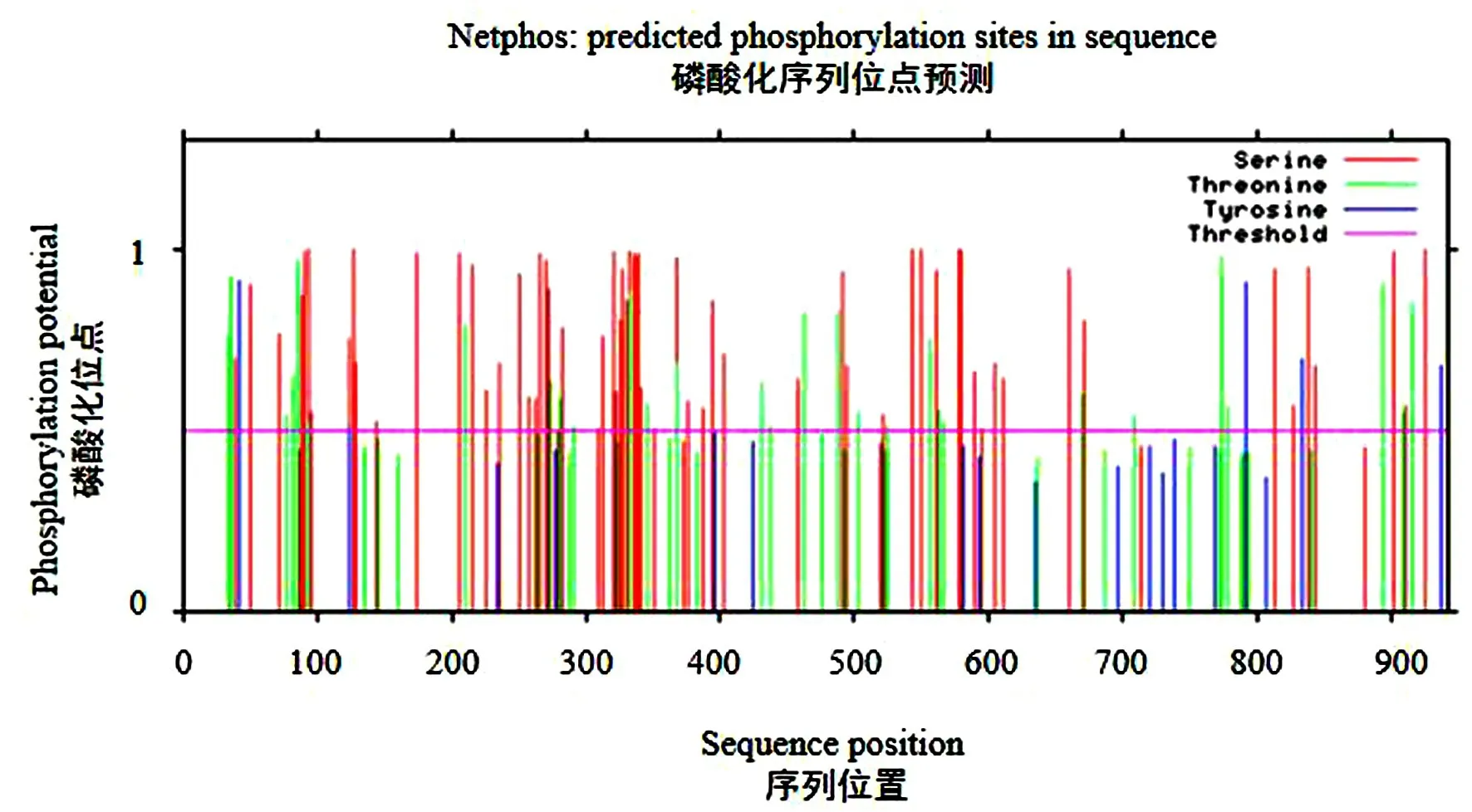
图3 牦牛PKN2蛋白磷酸化位点预测图Fig.3 Phosphorylation site of PKN2 protein predicted in yak
2.2.3 牦牛PKN2蛋白结构的预测
利用SOPMA在线工具预测PKN2蛋白质二级结构,PKN2蛋白在α-螺旋、延伸链、β-转角、无规则卷曲等中分别占比为41.61%、10.62%、4.67%、43.10%(图4A和4B).此外,利用SWISS-MODEL在线工具预测PKN2蛋白三级结构,发现预测结果与二级结构的预测结果基本一致[17](图4C).
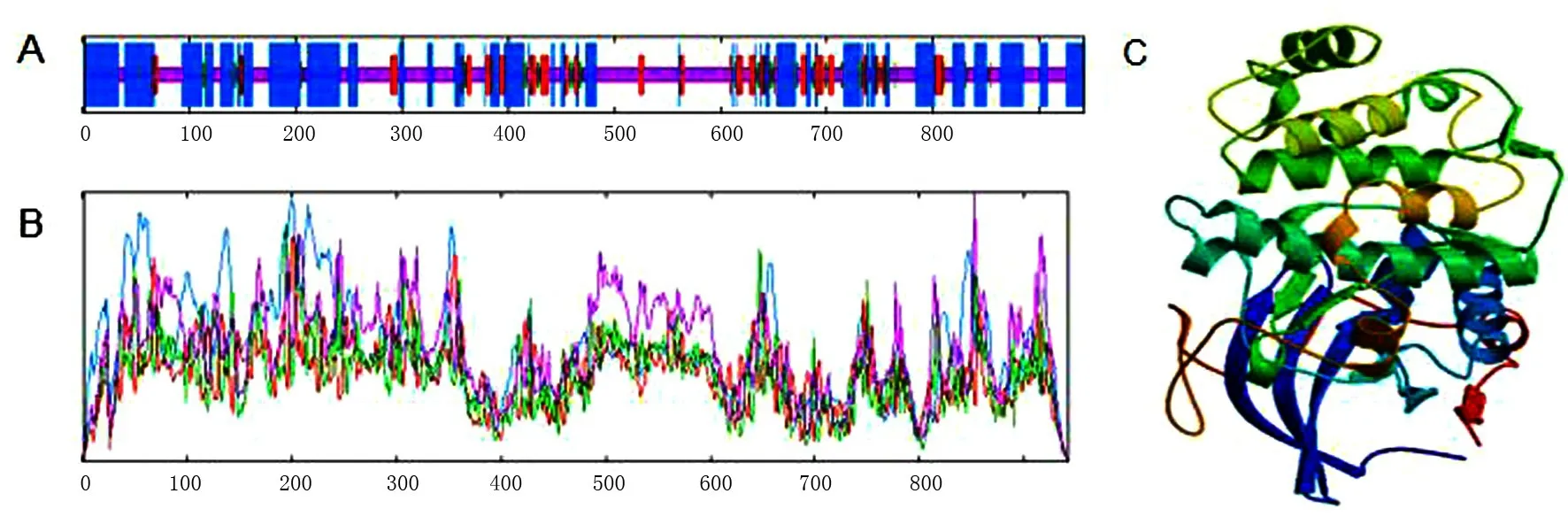
图4 牦牛PKN2蛋白质二级结构及三级结构预测Fig.4 The prediction of secondary and tertiary structure of PKN2 protein in yak
2.2.4 蛋白网络互作分析
根据STRING 11.0在线工具分析显示为图5,与PKN2紧密作用的蛋白有RHOA、PKN3、KYAT3、PDPK1、PIK3CA、AKT3、YWHAE等.其中RhoA被研究报道调节葡萄糖转运和胰岛素信号转导.在胰岛素敏感性细胞中,如脂肪和肌肉细胞,敲除RhoA可以减少两种细胞类型中胰岛素刺激的葡萄糖转运,相反的RhoA过表达抑制该生物学过程.进一步的分子机制解析发现RhoA主要是通过与PKN2蛋白的C端相互作用,激活PKN2蛋白活性,该过程依赖于GTP[18].此外,有文献报道,Akt3通过赖氨酸蛋白激酶1(with no lysine K1,WNK1)和血清/糖皮质激素诱导激酶1(serum and glucocorticoid-inducible kinase 1,SGK1)抑制脂肪生成途径,抵抗饮食诱导肥胖的发生[19].由此可见PKN2蛋白可能通过与RHOA和AKT等蛋白相互作用,参与糖脂代谢.
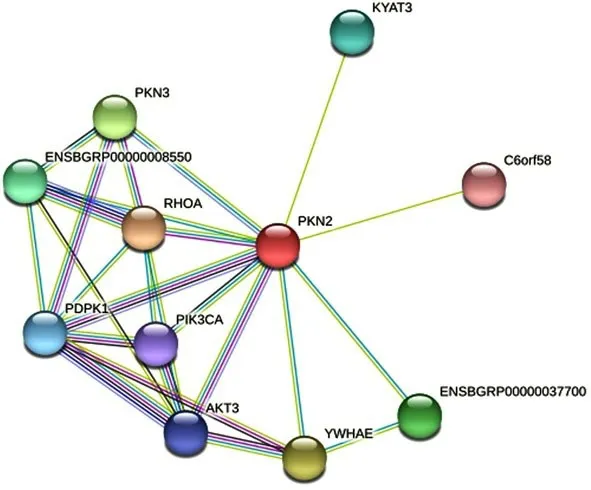
图5 牦牛PKN2蛋白互作图Fig.5 Yak PKN2 protein interaction
2.3 牦牛PKN2基因在不同组织中的表达
以脂肪中PPIA的相对表达量作为参考,利用荧光定量PCR技术检测PKN2基因在牦牛不同组织(心脏、肝脏、脾脏、肺脏、肾脏、肌肉、脂肪、睾丸)的mRNA表达水平.如图6所示,PKN2基因在8个组织中均有表达,在脂肪组织中表达量最高,极显著高于肝脏和睾丸组织(P<0.01),显著高于心脏、脾脏、肺脏(P<0.05).
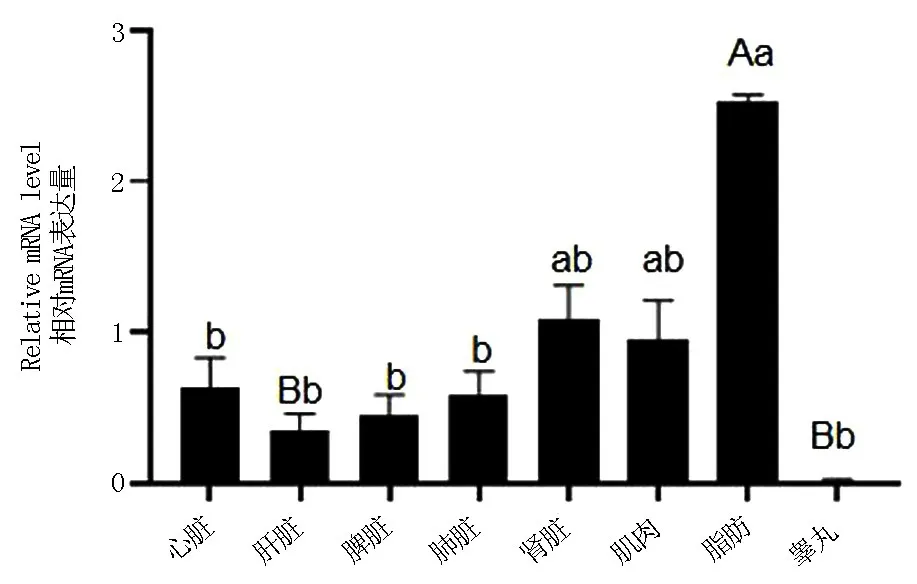
图6 牦牛PKN2基因在不同组织中的表达Fig.6 The expression level of PKN2 gene in different tissues of yak
3 讨论
牦牛作为青藏高原的优势畜种,对生活在高海拔地区的人民具有重要的意义[20,21].在高原地区,牦牛处于“夏肥、秋壮、冬瘦、春乏”的季节性生长.脂肪组织作为潜在的能量供应器官,对牦牛的季节适应性尤为重要[22,23],在枯草期维持了牦牛机体的基本能量需求和抵抗外界的严寒[24].目前关于牦牛脂肪组织脂质代谢分子遗传学基础及其调控因子仍不清楚.
本实验采用PCR技术扩增得到了牦牛PKN2基因的全长序列,发现ORF区为942 bp,共编码313个氨基酸.生物信息学分析发现PKN2为不稳定亲水蛋白,没有跨膜结构.PKN2共由101个磷酸化位点构成,其中丝氨酸(Ser)含量最多,苏氨酸(Thr)次之,酪氨酸(Tyr)含量最少,分别为66%、29%和5%.PKN2是一种具有催化活性的丝氨酸/苏氨酸蛋白激酶,在细胞信号转导和调控蛋白质翻译后修饰中起重要的作用[25].PKN2的二级结构由α-螺旋、延伸链、β-转角、无规则卷曲组成,分别占比为41.61%、10.62%、4.67%、43.10%.三级结构域与二级结构相似.同源性对比发现牦牛与普通牛、绵羊、山羊有较高的相似性,PKN2基因在进化上相对保守.
RT-qPCR结果显示,脂肪在牦牛组织中表达量最高,与睾丸和肝脏差异极显著,与肌肉和肾脏差异不显著.有文献报道,PKN2过表达会促进C2C12成肌细胞的分化,而不影响细胞的存活[26].体外干扰肌细胞中的PKN2表达,降低胰岛素刺激葡萄糖摄取、糖原合成和氧化;体内敲除PKN2也抑制葡萄糖摄取并提高了AMPK的磷酸化水平.在脂代谢研究方面,文献报道PKN2 siRNA处理肌细胞通过AMPK信号通路刺激脂肪酸氧化和甘油三酯的合成,减少蛋白组合成,伴随着脂代谢相关基因PGC-1α和SREBP-1c及其靶基因的表达的上调[12].通过蛋白互作发现,PKN2可以与AKT3相互作用,AKT3也是一种蛋白激酶,将敲除了AKT3基因的小鼠进行高脂饲喂,发现能阻断糖皮质激素酶1,从而抑制小鼠脂肪的生成[19].因此我们推测PKN2基因在骨骼肌与脂肪沉积中有一定的调控作用.
4 结论
本试验成功克隆出牦牛PKN2基因的完整CDS区,其长度为942 bp,共编码313个氨基酸,核苷酸和氨基酸对比发现该基因在进化过程中具有高度保守性;PKN2基因在各个组织中均有表达,在脂肪中的表达量最高.本实验结果对进一步研究PKN2基因调控牦牛的脂肪沉积提供基础数据.

