lncRNA OSER1-AS1和miR-373-3p在动脉粥样硬化患者中的表达及对AngⅡ诱导血管平滑肌细胞增殖和迁移的影响
黄 岚,张洪波,庄 红
动脉粥样硬化(AS)是高血压病、冠心病等多种心血管疾病的主要原因,严重危害中老年人的身体健康。血管平滑肌细胞是血管壁的主要成分,其异常增殖和迁移是AS的病理机制,抑制其增殖与迁移对AS的治疗尤为重要[1]。氧化应激反应丝氨酸丰富1反义RNA 1(OSER1-AS1)是一种位于人染色体20q13.12的长链非编码RNA(lncRNA),由2个外显子组成,全长1482 nt。目前,OSER1-AS1研究多集中在肿瘤方面,其发挥促癌基因作用,可促进肾癌、肝癌、非小细胞肺癌等肿瘤细胞侵袭、增殖、迁移等恶性生物学行为,敲减其表达有利于延缓肿瘤发展进程[2-4]。但OSER1-AS1在AS发生发展中的作用还未知。lncRNA常通过竞争性吸附微小RNA(miRNA)并调控miRNA靶基因的表达发挥生物学调控作用[5]。StarBase靶基因在线软件预测显示,OSER1-AS1可能与miR-373-3p存在相互作用。韩文静等[6]研究显示,上调miR-373-3p可降低血管紧张素Ⅱ(AngⅡ)诱导血管平滑肌细胞的迁移能力,提示miR-373-3p可能是AS治疗的分子靶点。但OSER1-AS1能否靶向miR-373-3p影响AS的发生发展也还未知。本研究旨在观察OSER1-AS1和miR-373-3p在AS患者血清、AngⅡ诱导的人主动脉血管平滑肌细胞(HASMCs)中的表达及OSER1-AS1能否靶向miR-373-3p调控AngⅡ诱导HASMCs的增殖与迁移,以期阐明OSER1-AS1/miR-373-3p在AS发生发展中的作用,为其治疗提供新靶点。
1 资料与方法
1.1临床资料 选取2019年5月—2020年12月于本院就诊的41例AS,男23例、女18例,年龄(62.39±8.51)岁。纳入标准:冠状动脉造影显示至少一支狭窄程度>50%;近3个月内未使用抗炎、抗菌药物;近3个月内未进行免疫治疗。排除标准:合并糖尿病、高血压病等慢性疾病者;合并肿瘤者;肝、肾等功能障碍者。另选取同时期41例体检健康者做对照,男25例、女16例,年龄(60.28±7.69)岁。纳入研究者自愿签署本研究知情同意书。
1.2细胞与试剂 正常HASMCs原代细胞、平滑肌细胞培养液购自美国ScienCell公司;AngⅡ购自美国Sigma公司;RNA提取试剂盒、逆转录试剂盒、PCR试剂盒购自宝生物工程(大连)有限公司;OSER1-AS1小干扰RNA(si-OSER1-AS1)、小干扰RNA阴性序列(si-NC)、miR-373-3p模拟物(mimic)、模拟对照序列(miR-NC)、miR-373-3p抑制剂(anti-miR-373-3p)、抑制剂阴性序列(anti-miR-NC)、引物序列、野生型(WT)和突变型(MUT)OSER1-AS1荧光素酶报告基因载体购自广州锐博生物技术有限公司;LipofectamineTM2000试剂盒、CCK-8试剂盒、RIPA试剂购自北京索莱宝科技有限公司;BCA试剂盒购自上海碧云天生物技术有限公司。
1.3研究方法
1.3.1细胞培养:复苏HASMCs,接种至平滑肌细胞专用培养液中,放置于5%二氧化碳培养箱(温度37 ℃)中培养。
1.3.2RT-qPCR法测定OSER1-AS1与miR-373-3p表达:①取受试者清晨空腹肘静脉血5 ml,350×g离心10 min,测定上清中OSER1-AS1与miR-373-3p表达。②HASMCs接种至6孔板中,密度为1.0×105个/孔。培养4 h后,分为对照组(Con组)和AngⅡ组,分别用含0、1×10-7mol/L的AngⅡ[7]培养液干预24 h,干预后收集各组细胞,测定细胞中OSER1-AS1与miR-373-3p表达。用RNA提取试剂盒分别提取血清、细胞中总RNA,并逆转录为cDNA后行PCR扩增。引物序列:OSER1-AS1上游序列为5'-AATCACGCAATTGAAGGAAAAA-3',下游序列为5'-CCTTGTTTTCCAACCCTTAGACT-3';GAPDH上游序列为5'-GGGAGCCAAAAGGGTCAT-3',下游序列为5'-GAGTCCTTCCACGATACCAA-3';miR-373-3p上游序列为5'-CCAGGGCTTTTCAAAAATGA-3',下游序列为5'-CCGATCCAATCTGTTCTGGT-3';U6上游序列为5'-CTCGCTTCGGCAGCACATA-3',下游序列为5'-AACGATTCACGAATTTGCGT-3'。2-ΔΔCt法计算OSER1-AS1、GAPDH、miR-373-3p的相对表达量。
1.3.3细胞转染:接种HASMCs至6孔板中,密度为1.0×105个/孔。培养24 h后,分别转染si-OSER1-AS1、si-NC、miR-373-3p mimic、miR-NC或共转染si-OSER1-AS1与anti-miR-373-3p、si-OSER1-AS1与anti-miR-NC至HASMCs,转染步骤严格参照LipofectamineTM2000试剂盒说明书进行。转染24 h后,采用RT-qPCR法测定细胞中OSER1-AS1或miR-373-3p表达。
1.3.4CCK-8法测定HASMCs增殖活性:接种转染后及未转染的各细胞于96孔板中,密度为2.5×104个/孔。培养4 h后,转染的各细胞均用含1×10-7mol/L AngⅡ的培养液干预24、48和72 h,依次记为AngⅡ+si-OSER1-AS1组、AngⅡ+si-NC组、AngⅡ+miR-373-3p组、AngⅡ+miR-NC组、AngⅡ+si-OSER1-AS1+anti-miR-373-3p组、AngⅡ+si-OSER1-AS1+anti-miR-NC组。未转染的细胞分为Con组和AngⅡ组,分别用含0、1×10-7mol/L AngⅡ的培养液干预24、48和72 h。干预结束后,向各孔加10 μl的CCK-8孵育2 h后,酶标仪测定450 nm波长处各孔光密度(OD)值。OD值越大说明细胞增殖活性越强。
1.3.5Transwell小室实验测定HASMCs迁移能力:接种转染后及未转染的各细胞于Transwell小室上室,密度为2.5×104个/室,下室加500 μl完全培养液。培养4 h后,将上室按照“1.3.4”分组干预24 h。干预后,取出小室,将下室细胞用多聚甲醛固定、结晶紫染色,显微镜下计数即为迁移细胞数。
1.3.6Western blot法测定增殖、迁移相关蛋白表达:接种转染后及未转染的各细胞于6孔板中,密度为1.0×105个/孔。培养4 h后,按照“1.3.4”分组干预24 h。干预后,RIPA试剂提取各组细胞中总蛋白,BCA试剂盒测定蛋白浓度后,行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离。分离后蛋白转至聚偏二氟乙烯膜上,5%脱脂奶粉封闭2 h。分别用Ki-67(1︰1000)、基质金属蛋白酶-2(MMP-2,1︰500)、基质金属蛋白酶-9(MMP-9,1︰500)、GAPDH(内参,1︰1000)一抗在4 ℃冰箱中孵育12 h,洗膜,再用山羊抗小鼠二抗(1︰2000)于37 ℃摇床中孵育1 h。显影,曝光,ImageJ软件分析蛋白条带灰度值。
1.3.7双荧光素酶报告基因实验测定OSER1-AS1与miR-373-3p靶向关系:接种HASMCs至6孔板中,密度为1.0×105个/孔。培养24 h后,分别共转染WT-OSER1-AS1与miR-373-3p mimic(或miR-NC)、MUT-OSER1-AS1与miR-373-3p mimic(或miR-NC),转染步骤严格参照LipofectamineTM2000试剂盒说明书进行。转染24 h后,裂解各组细胞,350×g离心10 min。将上清液20 μl与萤火虫或海肾荧光素酶反应液100 μl充分混合,测定萤火虫或海肾荧光强度,以二者比值表示细胞荧光素酶活性。

2 结果
2.1OSER1-AS1和miR-373-3p在AS患者血清及AngⅡ诱导血管平滑肌细胞中的表达 AS患者血清中OSER1-AS1表达较体检健康者升高(4.70±0.32 vs 1.00±0.14,P<0.05),miR-373-3p表达较体检健康者降低(0.31±0.03 vs 1.00±0.11,P<0.05)。AngⅡ组HASMCs中OSER1-AS1表达较Con组升高(3.47±0.26 vs 1.00±0.00,P<0.05),miR-373-3p表达较Con组降低(0.40±0.04 vs 1.00±0.00,P<0.05)。
2.2干扰OSER1-AS1表达对AngⅡ诱导血管平滑肌细胞增殖的影响 转染si-OSER1-AS1的HASMCs中OSER1-AS1表达较转染si-NC的HASMCs降低(0.23±0.02 vs 1.00±0.00,P<0.05)。AngⅡ组HASMCs增殖活性较Con组升高,同时增殖相关蛋白Ki-67表达较Con组升高(P<0.05)。AngⅡ+si-OSER1-AS1组HASMCs增殖活性较AngⅡ+si-NC组降低,同时增殖相关蛋白Ki-67表达较AngⅡ+si-NC组降低(P<0.05)。见图1、表1。
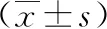
表1 干扰OSER1-AS1表达对AngⅡ诱导HASMCs增殖的影响
2.3干扰OSER1-AS1表达对AngⅡ诱导血管平滑肌细胞迁移的影响 AngⅡ组HASMCs迁移数较Con组升高,同时迁移相关蛋白MMP-2、MMP-9表达较Con组升高(P<0.05)。AngⅡ+si-OSER1-AS1组HASMCs迁移数较AngⅡ+si-NC组降低,同时迁移相关蛋白MMP-2、MMP-9表达较AngⅡ+si-NC组降低(P<0.05)。见图2、表2。
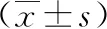
表2 干扰OSER1-AS1表达对AngⅡ诱导的HASMCs迁移的影响
2.4OSER1-AS1靶向调控miR-373-3p表达 StarBase靶基因在线软件预测显示OSER1-AS1与miR-373-3p的结合位点见图3。共转染WT-OSER1-AS1与miR-373-3p mimic的HASMCs荧光素酶活性较共转染WT-OSER1-AS1与miR-NC的HASMCs降低(0.43±0.05 vs 0.98±0.06,P<0.05);共转染MUT-OSER1-AS1与miR-373-3p mimic的HASMCs荧光素酶活性较共转染MUT-OSER1-AS1与miR-NC的HASMCs比较差异无统计学意义(0.99±0.07 vs 1.01±0.07,P>0.05)。同时,转染si-OSER1-AS1的HASMCs中miR-373-3p表达较转染si-NC的HASMCs升高(3.08±0.23 vs 1.00±0.00,P<0.05)。
2.5miR-373-3p过表达对AngⅡ诱导血管平滑肌细胞增殖和迁移的影响 转染miR-373-3p mimic的HASMCs中miR-373-3p表达较转染miR-NC的HASMCs升高(3.18±0.31 vs 1.00±0.00,P<0.05)。AngⅡ+miR-373-3p组HASMCs增殖活性、迁移数较AngⅡ+miR-NC组降低,同时增殖、迁移相关蛋白Ki-67、MMP-2、MMP-9表达较AngⅡ+miR-NC组降低(P<0.05,P<0.01)。见图4、表3。
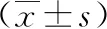
表3 miR-373-3p过表达对AngⅡ诱导HASMCs增殖和迁移的影响
2.6下调miR-373-3p表达联合干扰lncRNA OSER1-AS1表达对AngⅡ诱导HASMCs增殖和迁移的影响 共转染si-OSER1-AS1与anti-miR-373-3p的HASMCs中miR-373-3p表达较共转染si-OSER1-AS1与anti-miR-NC的HASMCs降低(0.47±0.03 vs 1.00±0.00,P<0.05)。AngⅡ+si-OSER1-AS1+anti-miR-373-3p组HASMCs增殖活性、迁移数较AngⅡ+si-OSER1-AS1+anti-miR-NC组升高,同时增殖、迁移相关蛋白Ki-67、MMP-2、MMP-9表达较AngⅡ+si-OSER1-AS1+anti-miR-NC组升高(P<0.05,P<0.01)。见图5、表4。
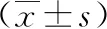
表4 下调miR-373-3p表达联合干扰OSER1-AS1表达对AngⅡ诱导HASMCs增殖和迁移的影响
3 讨论
AS是一种发病率逐年升高的慢性炎症性疾病[8],其发生发展与血管平滑肌细胞的异常增殖和迁移有关,抑制病理状态下血管平滑肌细胞的增殖与迁移对AS的治疗十分关键。
AngⅡ是目前已知的缩血管活性物质,其参与维持血管壁结构和功能的完整性,对血管平滑肌细胞增殖与迁移起促进作用[9]。本研究HASMCs经AngⅡ干预后,其增殖与迁移能力明显增强,与张永安等[1]报道结果一致。
研究显示,lncRNA参与调控血管平滑肌细胞增殖或迁移,对AS在内的心血管疾病的发生发展具有重要影响,是心血管疾病治疗的潜在分子靶点[10]。本研究结果表明,OSER1-AS1在AS患者血清、AngⅡ诱导HASMCs中表达均上调,干扰其表达可降低AngⅡ诱导HASMCs增殖与迁移能力,提示干扰OSER1-AS1有利于抑制或延缓AS的发展进程,可能为AS治疗提供新途径。Ki-67是细胞增殖的标志性分子[11]。MMP-2和MMP-9属于基质金属蛋白酶家族成员,其通过降解细胞外基质和基底膜促进细胞迁移[12]。本研究显示,干扰OSER1-AS1抑制AngⅡ诱导HASMCs增殖和迁移能力与其调控细胞中Ki-67、MMP-2、MMP-9蛋白表达有关。
研究显示,miR-373-3p在肝癌、宫颈癌等肿瘤中发挥抗肿瘤基因作用,上调其表达有利于肿瘤治疗[13];上调miR-373-3p通过靶向抑制SOX4阻碍软骨细胞凋亡及细胞外基质降解,为骨关节炎提供了有效的治疗靶点。本研究结果显示,miR-373-3p过表达降低了AngⅡ诱导HASMCs增殖与迁移能力,提示miR-373-3p过表达可能为AS治疗提供了新策略。同时,本研究证实OSER1-AS1可靶向结合并负调控miR-373-3p,且下调miR-373-3p导致干扰OSER1-AS1对AngⅡ诱导HASMCs增殖与迁移的抑制作用明显减弱,提示干扰OSER1-AS1通过靶向上调miR-373-3p表达可抑制AngⅡ诱导HASMCs的增殖与迁移能力。
综上,OSER1-AS1在AS患者血清、AngⅡ诱导的HASMCs中表达上调,而miR-373-3p表达下调;干扰OSER1-AS1抑制AngⅡ诱导HASMCs的增殖和迁移与干扰其表达引起细胞中miR-373-3p表达上调有关,其有可能成为AS治疗的新靶点。

