circRNA_103809调节胃癌干样细胞特性和线粒体功能的研究
郑小红,金正伟,董庆焕,谢 杨
胃癌是全球极为常见的恶性肿瘤,尽管针对胃癌相关的分子研究不断深入,但是胃癌病死率依旧呈上升趋势[1]。由于胃癌发病早期无明显特异性症状,与胃炎和胃溃疡等疾病极为相似,极易造成误诊,延误治疗时机[2]。随着病情的不断发展,胃癌晚期患者会出现胃痛、恶心呕吐,部分患者会出现吞咽困难等局部症状[3]。胃癌晚期患者可能出现淋巴结转移,是造成患者治愈率不高、预后不佳的主要原因[4]。随着高通量测序技术的快速发展,越来越多环状RNA(circRNA)被发现,成为研究者关注的重点。circRNA是一类特殊的非编码RNA分子,呈封闭环状结构,不受RNA外切酶影响,表达更稳定,不易降解[5]。既往研究表明circRNA_103809可调控肝癌细胞增殖[6]。但其在胃癌中的作用机制尚无统一定论。本文旨在分析circRNA_103809调节胃癌干样细胞特性和线粒体的作用机制。
1 材料与方法
1.1主要细胞 胃癌细胞株(SGC-7901)购自中国科学院细胞库。Annexin V-FITC细胞凋亡检测试剂盒购自上海翊圣生物科技有限公司;二喹啉甲酸(BCA)蛋白浓度测定试剂盒购自上海碧云天生物技术公司;B淋巴细胞瘤-2(Bcl-2)、兔抗人单克隆抗体(Bax)、裂解半胱天冬酶9(cleaved cas9)/半胱氨酸蛋白酶9(Caspase9)、裂解半胱天冬酶3(cleaved cas3)/半胱氨酸蛋白酶3(Caspase3)和相应二抗购自武汉博欧特生物科技有限公司;Trizol、逆转录试剂盒购自日本TaKaRa公司;聚偏二氟乙烯膜(PVDF)购自上海吉至生化科技有限公司;兔抗人circRNA_103809抗体和抗人β-actin抗体购自武汉菲恩生物科技有限公司;兔抗人细胞黏附分子44(CD44)、胚胎干细胞关键蛋白(SOX2)和八聚体结合转录因子4(OCT4)抗体购于英国Abcam公司。
1.2circRNA_103809干扰序列设计 circRNA_103809 shRNA及空载质粒均购自中国碧云天生物技术研究所。将SGC-7901细胞分成Control组、shRNA-NC组、circRNA_103809-shRNA1组、circRNA_103809-shRNA2组和circRNA_103809-shRNA3组,分别接种于6孔板,置于37 ℃、5% CO2培养箱中培养后,shRNA-NC组采用空转质粒转染,circRNA_103809-shRNA1组、circRNA_103809-shRNA2组和circRNA_103809-shRNA3组导入circRNA_103809基因。按照RT-PCR逆转录试剂盒说明书将提取的总RNA逆转录为cDNA。以逆转录后的样品为模板进行RT-PCR反应,设置反应条件。选择β-actin作为内参,检测circRNA_103809水平。确定circRNA_103809-shRNA1组、circRNA_103809-shRNA2组和circRNA_103809-shRNA3组转染成功,进行后续实验。
1.3RT-PCR测定CD44、SOX2和OCT4 分别收集稳定筛选的细胞,Trizol用于提取总RNA,NanoDrop2000分光光度仪测定RNA浓度,根据逆转录试剂盒合成cDNA,在RT-PCR仪上进行PCR扩增,设置反应条件。实验进行3组平行重复。CD44上游引物序列为5'-CGGACACCATGGACAAGTTT-3',下游引物序列为5'-CCGTCCGAGAGATGCTGTAG-3'。SOX2上游引物序列为5'-GAAAAGGCGTGTGGTGTGAC3-3′,下游引物序列为5′-CGCTGATTGGTCGCTAGAAAC-3′。OCT4上游引物序列为5′-AGGATCCCCCGCCGGAACAA-3′,下游引物序列为5′-GAGTTCCCGCGTTGCCCCTC-3′。根据样本的Ct值计算2-ΔΔCt值,计算每个肿瘤样品中的目的基因对于正常样品的倍数差异。
1.4显微观察肿瘤细胞成球情况 取各组处于对数生长期细胞以1×105/ml的密度接种于6孔板中进行培育,1周后收集成球细胞,重制成单细胞悬液进行传代培养,分别检测培育1周后每团细胞超过100个的成球细胞数目及成球细胞的成球直径。
1.5流式细胞仪检测细胞线粒体膜电位 SGC-7901细胞线粒体膜电位采用JC-10染色及流式细胞仪检测。将各组细胞制成密度为1×105个/ml悬液,接种于6孔板中,培养48 h后加入JC-1染色液1 ml,37 ℃避光孵育,1000 r/min离心5 min,弃上清液,加入缓冲液冲洗,后采用流式细胞仪检测JC-1荧光信号。
1.6Western blot法检测干细胞标志物 检测各组干细胞标志物CD44、SOX2和OCT4蛋白表达水平,取各组对数生长期细胞以1200 r/min离心10 min后加入裂解液重悬细胞并裂解、离心,采用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳提取待测蛋白,用BCA法测量蛋白浓度并定量。凝胶电泳后转PVDF膜2 h。5%脱脂牛奶室温封闭1.5 h,一抗孵育过夜,取出使用PBST反复洗涤3次,添加相应二抗于室温孵育1.5 h。选择β-actin作为内参,采用软件获得蛋白条带并计算每组条带的灰度值。

2 结果
2.1干扰circRNA_103809稳定细胞株的建立 相比Control组和shRNA-NC组,circRNA_103809-shRNA1组、circRNA_103809-shRNA2组和circRNA_103809-shRNA3组中circRNA_103809 mRNA水平均降低(P<0.05);相比circRNA_103809-shRNA2组和circRNA_103809-shRNA3组,circRNA_103809-shRNA1组circRNA_103809 mRNA最低(P<0.05);Control组和shRNA-NC组比较无差异(P>0.05)。见图1。选择干扰效果最好的circRNA_103809-shRNA1组做后续研究,简写为sh-circ103809。
2.2干细胞标志物CD44、SOX2和OCT4表达比较 相比Control组和shRNA-NC组,sh-circ103809组CD44、SOX2和OCT4蛋白及mRNA水平明显降低(P<0.05);Control组和shRNA-NC组CD44、SOX2和OCT4蛋白及mRNA水平比较差异无统计学意义(P>0.05)。见图2、表1和表2。

表1 各组干细胞标志物CD44、SOX2和OCT4 mRNA水平比较
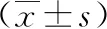
表2 各组干细胞标志物CD44、SOX2和OCT4 mRNA相对表达水平比较
2.5干扰circRNA_103809表达对凋亡蛋白的影响 Control组和shRNA-NC组Bax/Bcl-2、Caspase9/β-actin、Caspase3、β-actin蛋白表达水平比较差异无统计学意义(P>0.05);与shRNA-NC组和Control组相比,sh-circ103809组Bax/Bcl-2、Caspase9/β-actin、Caspase3/β-actin蛋白表达水平明显增加(P<0.05)。见图4和表4。
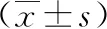
表4 各组凋亡蛋白表达水平比较
2.3干扰circRNA_103809表达抑制肿瘤细胞体外成瘤能力 sh-circ103809组细胞成球率低于Control组和shRNA-NC组(P<0.05);sh-circ103809组成球直径明显小于Control组和shRNA-NC组(P<0.05);Control组与shRNA-NC组细胞成球率和成球直径比较差异无统计学意义(P>0.05)。见表3。
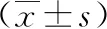
表3 各组细胞成球率及成球直径比较
3 讨论
胃癌是导致世界范围内癌症死亡的主要原因,其具有恶性程度高、生长迅速、转移率高等特点[7]。目前,临床上采取的主要治疗措施是放化疗和手术切除瘤体,但是治疗后患者的生存率依旧不高[8]。
本研究发现,相比Control组和shRNA-NC组,sh-circ103809组CD44、SOX2和OCT4蛋白及mRNA水平明显降低,提示干扰circRNA_103809基因表达可以减少干细胞标志物CD44、SOX2和OCT4表达水平。CD44是肿瘤干细胞标志物之一,广泛存在于淋巴细胞、上皮细胞、中胚层细胞等各类细胞表面,其与肿瘤浸润转移关系的研究已有大量文献报道[9-12]。SOX2是SOX基因家族的重要成员,有大量文献报道其与肿瘤细胞增殖、侵袭转移和维持肿瘤干细胞自我更新具有密切联系,并在人类胃黏膜上皮细胞的分化过程中具有重要作用[13-15]。有研究表明,SOX2蛋白表达变化与胃癌的发生发展有关[16]。OCT4基因具有多个转录起始位点,可转录不同的mRNA亚型,从而翻译成多种蛋白质[17]。OCT4广泛表达于胚胎及生殖干细胞内,并维持该类细胞潜能分化及自更新功能[18]。有研究报道,OCT4在胃癌、肝癌、乳腺癌中均有表达,参与肿瘤的形成和发展[19]。于洋等[20]发现干细胞标志物OCT4在膀胱癌组织中高表达,且与膀胱癌转移有关,患者远期预后不良。本研究结果说明,干扰circRNA_103809基因表达可能通过抑制CD44、SOX2和OCT4表达,抑制肿瘤干细胞的形成,从而达到抑制胃癌进展的效果。
本研究发现sh-circ103809组细胞成球率明显降低,成球直径明显减少,提示干扰circRNA_103809基因表达可抑制其体外成瘤能力。本研究结果还显示,干扰circRNA_103809基因表达,sh-circ103809组细胞线粒体膜电位明显下降。线粒体是细胞中重要的组成部分,参与细胞分化、信号转导和细胞凋亡等生物学过程,而线粒体膜电位则是评估线粒体功能的重要指标[21-22]。当细胞受到外界因素的刺激,线粒体膜电位下降,导致线粒体膜通透性转运通道开放,大量凋亡诱导因子从线粒体释放到细胞质中,从而使得细胞加速死亡[23]。因此,促进线粒体膜电位下降则会促进细胞凋亡。
本研究结果显示,干扰circRNA_103809基因表达,Bax/Bcl-2、Caspase9/β-actin、Caspase3/β-actin蛋白表达水平明显增加,提示干扰circRNA_103809基因表达可调控凋亡蛋白表达,从而促进胃癌细胞凋亡。通常通过抑制肿瘤抗凋亡基因表达和促进促凋亡基因表达等方式,来加速肿瘤细胞凋亡,其中Bcl-2家族在凋亡基因调控中起重要作用[24]。本研究结果提示,干扰circRNA_103809基因表达后,可通过上调促凋亡Bax蛋白表达,下调抗凋亡Bcl-2蛋白表达,进而影响胃癌的发展进程。
综上,干扰circRNA_103809表达可以降低线粒体膜电位,有效抑制肿瘤细胞的增长,其调控机制可能是通过抑制干细胞标志物蛋白的表达及促进Bax蛋白表达、抑制Bcl-2蛋白表达,进而影响胃癌的发展进程。

