CT影像特征及影像组学在肺淋巴瘤与肺浸润性黏液腺癌诊断中的应用
胡菲,张琳,李桃,邹丹丹,司成海,韩旭
(秦皇岛市第一医院,1.影像中心;2.血液科;3.病理科,河北 秦皇岛 066000)
原发性肺淋巴瘤(PPL)是罕见的肺部恶性肿瘤,是由肺实质或支气管的淋巴组织异常增生引起,伴或不伴肺门淋巴结浸润,其最常见的类型是黏膜相关淋巴组织型淋巴瘤(MALT)[1-2]。肺是MALT的常见累及器官,患者一般临床症状表现为咳嗽、咯血、呼吸困难、胸痛等。临床发现,肺MALT的临床症状和实验室检查并不具有特异性,而肺MALT影像学检查结果多种多样,极易与肺浸润性黏液腺癌(PIMA)混淆[3]。PIMA沿肺泡壁或支气管壁生长,以肿瘤内含有大量黏液为主要组织学特征,临床症状和影像学检查同样缺乏特异性[4]。穿刺活检是MALT、PIMA病理确诊的主要方法,但并非所有患者愿意接受,因此临床对于无创诊断技术的需求越来越大。影像组学通过提取大量影像特征,应用自动化数据特征化算法将其转化为可发掘的数据信息,对影像学检查诊断不具特异性的疾病拥有独特优势[5-6]。MALT、PIMA在影像学上难以鉴别,且临床上关于二者的鉴别诊断报道相对较少。本研究旨在探讨CT影像特征及影像组学鉴别诊断MALT与PIMA的应用价值。
1 资料与方法
1.1 一般资料
选择2016年2月至2022年2月在秦皇岛市第一医院接受手术治疗的50例肺MALT患者及52例PIMA患者为研究对象,按照2∶1随机分为训练集和验证集,训练集68例(33例MALT,35例PIMA);验证集34例(17例MALT,17例PIMA)。肺MALT和PIMA患者一般资料比较,差异无统计学意义(P>0.05)。见表1。纳入标准:(1)均为单发病灶;(2)均经穿刺活检、手术病理或免疫组化证实;(3)术前行肺部CT检查,图像清晰完整;(4)入组前均未接受过抗肿瘤治疗。排除标准:(1)图像模糊不可用;(2)微小病灶,难以提取有效影像组学参数。
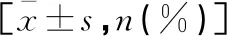
表1 肺MALT和PIMA患者一般资料比较
1.2 方法
1.2.1 CT检查 使用Philips Brilliance 64层CT扫描仪进行胸部平扫,患者呈仰卧位,上臂上举,吸气-屏气后开始扫描,放射科医生划定扫描范围,确定范围为胸廓入口至肺底,扫描参数设定:管电压120 kV,管电流200 mAs,螺距≤1,层厚5 mm,重建层厚为1 mm,矩阵512×512。
1.2.2 图像处理与分析 采取双盲法阅片,由两位年资分别为5年和10年的影像诊断医师分别阅片,查阅病灶形态、密度、空洞征、空气支气管征等CT征象,图像上传至影像组学工作平台,A医师使用半自动勾画工具勾画感兴趣区(ROI),在勾画瘤周5 mm范围ROI,勾画完毕则由B医师复核,意见不一致则协商一致。使用A.K.应用平台提取影像特征,在特征提取模块勾选相应特征,包括一阶特征(熵、偏度、均匀性)、形状特征(二维和三维形状、大小)、纹理特征[灰度共生矩阵(GLCM)、灰度游程长度矩阵(GLRLM)]及变换特征(小波变换等)4大类,共提取出108个特征参数。
1.3 统计学分析
2 结果
2.1 训练集和验证集患者CT征象比较
训练集和验证集病灶形态、病灶密度、空泡、空洞、空气支气管征、支气管狭窄、支气管扩张、胸腔积液、胸膜转移等CT征象比较,差异无统计学意义(P>0.05)。见表2。
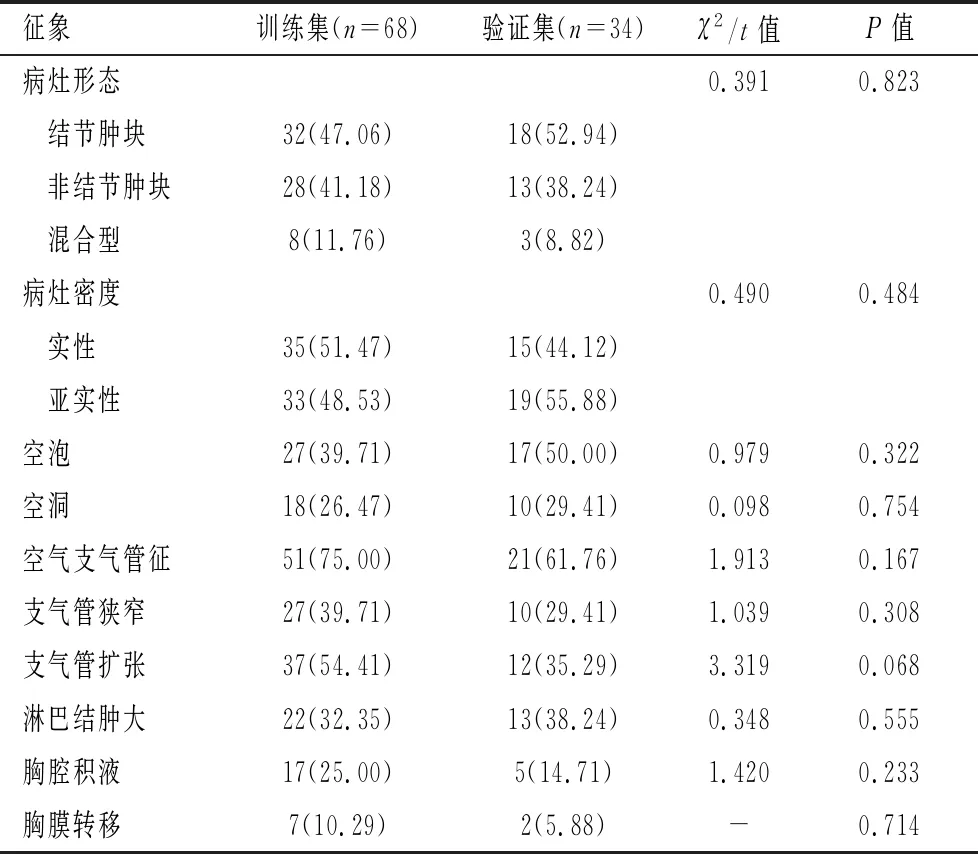
表2 训练集和验证集患者CT征象比较[n(%)]
2.2 验证集肺MALT及PIMA患者影像组学特征比较
提取验证集的108个影像组学特征,应用LASSO降维和Logistic回归后,经过交叉验证,最终得到6个影像组学特征,包括4个一阶特征和2个纹理特征。训练集肺MALT及PIMA患者6个影像组学特征值差异有统计学意义(P<0.05)。见表3。

表3 验证集肺MALT及PIMA患者影像组学特征比较[M(P75,P25)]
2.3 训练集肺MALT、PIMA影像组学特征预测模型
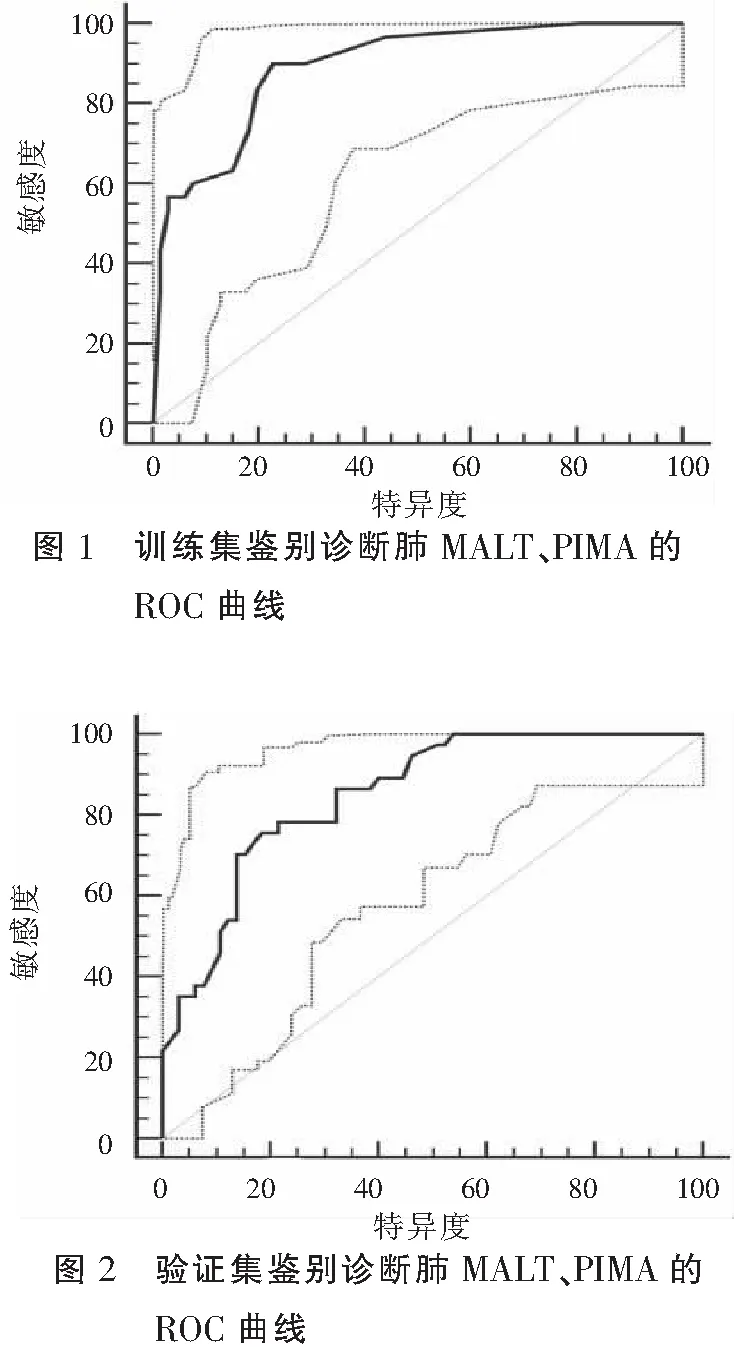
ROC曲线显示,训练集鉴别诊断肺MALT、PIMA的AUC为0.873,95%CI为0.792~0.930,约登指数为0.587,临界值为0.034,敏感度、特异度分别为75.68%、83.08%,经过拟合优度检验,χ2=5.373,P=0.717,模型预测效能良好。见图1。
2.4 验证集肺MALT、PIMA影像组学特征预测模型
ROC曲线显示,验证集鉴别诊断肺MALT、PIMA的AUC为0.852,95% CI为0.768~0.915,约登指数为0.572,临界值为0.036,敏感度、特异度分别为75.68%、81.54%,经过拟合优度检验,χ2=11.754,P=0.612,模型预测效能良好。见图2。
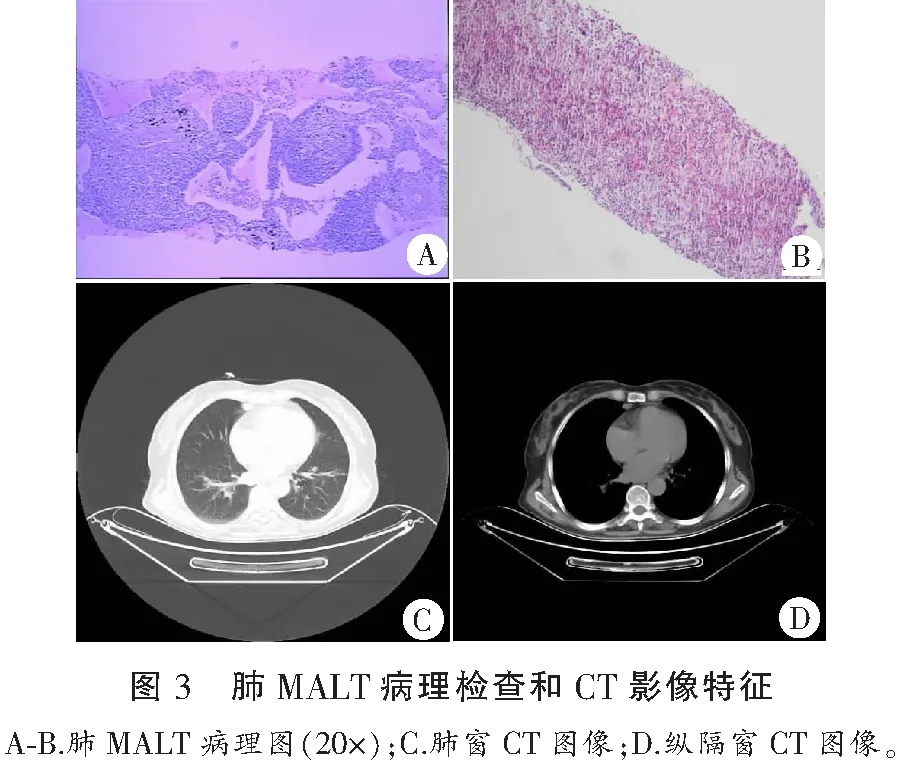
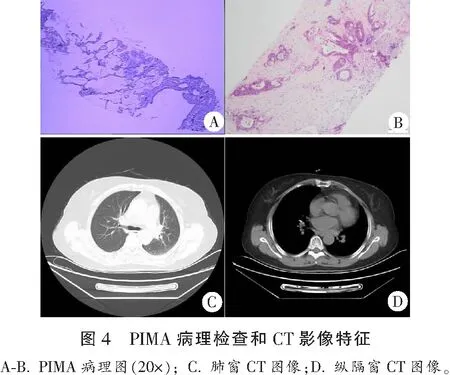
2.5 典型病例病理检查和CT影像特征
患者1,灰白色穿刺组织少许,体积1.2 cm×0.1 cm×0.05 cm,小细胞恶性肿瘤,病理诊断为MALT(左肺,图3A及3B)。患者双肺见多发团片状密度增高影,大小约3.3 cm×2.5 cm,边缘毛糙,内细小支气管影欠通畅,心影不大,心包稍厚(图3C),纵隔内小淋巴结短径<1 cm(图3D)。患者2,灰白色穿刺组织一条,长0.3 cm,直径0.05 cm,病理诊断为PIMA(左肺下叶,图4A及4B)。患者左肺下叶后基底段见不规则结节灶,大小约2.0 cm×0.9 cm,右肺见微结节(im11,22,30)。右肺中叶及左肺上叶舌段见索条影(图4C)。纵隔略向左侧偏移,纵隔内(气管前腔静脉后、主肺动脉窗、气管隆突下)可见小淋巴结,直径<1.0 cm(图4D)。
3 讨论
肺MALT是低度恶性淋巴瘤,病情发展缓慢,且由于发病率低,疾病表现并无特征性,影像学也不具典型性,临床极易出现漏诊误诊[7]。PIMA的黏液特质可以通过气道向周围组织播散,呈浸润趋势,相对肺MALT,PIMA一般预后不佳,二者的鉴别诊断对改善患者预后和提高患者生存率极其重要[8-9]。影像组学在计算机诊断基础上,对不同病灶的特征进行定量诊断,将大量影像数据进行结构化梳理并提取特殊影像特征,大大提高了诊断准确率[10-11]。
本研究发现肺MALT、PIMA的CT影像特征呈类似表现,二者均呈充气支气管征,支气管会出现不同程度的扩张,肺MALT支气管走形自然,明显扩张处会呈现空腔或囊状含气影,而PIMA支气管僵硬,管腔粗细不一,扩张可达病变远端,本研究结果与既往研究[12-13]报道相符。CT影像特征有助于肺MALT、PIMA的鉴别,但信息较少,具有局限性,比如胸腔积液是更多地出现在晚期疾病患者身上的影像特征,对于早期患者的诊断不具特异性。本研究结果显示,训练集及验证集CT征象比较,差异无统计学意义(P>0.05),暗示后续影像组学分析中训练集与验证集诊断效能相当。影像组学获得的特征除了肉眼可辨的形态、大小、毛刺、分叶征之外,还可以提取肉眼难辨的灰度、纹理特征,借此反映肿瘤组织学上的异质性[14]。本研究从验证集提取出的108个影像组学特征中筛选出6个鉴别性较好的影像组学特征,包括4个一阶特征、2个纹理特征。一阶特征包括平均值、中位数、10百分位数、总能量。本研究结果显示,PIMA患者的平均值、中位数、10百分位数的CT信号强度值高于肺MALT患者(P<0.05);总能量图像亮度信息变化较肺MALT患者更剧烈(P<0.05)。纹理特征包括灰度不均匀度、游程不均匀度,本研究中,肺MALT患者灰度不均匀度特征值大于PIMA患者(P<0.05)。灰度不均匀度反映疾病影像学图像中某种灰度的出现频率,图像中某种灰度出现越多则表明灰度越均匀,因此特征值越大,提示PIMA较肺MALT灰度更均匀,值越小则表明图像纹理粗细更均匀。游程不均匀度反映疾病影像学图像中游程长度相似度,本研究中,肺MALT游程不均匀度特征值大于PIMA患者(P<0.05),提示PIMA较肺MALT图像纹理更均匀。从一阶特征和纹理特征可以挖掘肉眼难辨的图像差异来分辨PIMA和肺MALT,影像组学特征的差异主要是因为于PIMA异质性较肺MALT高,从而导致CT图像上的一阶特征和局部纹理特征出现强烈反差。
基于以上影像组学特征构建预测模型,训练集影像组学特征AUC为0.873,验证集影像组学特征AUC为0.852,模型拟合优度良好,说明验证集和训练集影像组学特征均具有较高的诊断效能。吴琦等[15]报道训练集、验证集影像学特征模型鉴别诊断肺MALT、PIMA的AUC为0.85、0.81,与本研究结果类似。
综上,通过影像组学对肺MALT、PIMA进行特征提取,可以有效鉴别肺MALT和PIMA,影像组学在临床上有很大应用空间。

