脂联素通过调节BMP信号通路促进骨髓干细胞成骨分化
刘雷 毛文 郑一舟 祁福 李红 张明焕
武汉市第三医院,湖北 武汉 430074
骨组织具有极大的修复和再生能力,由创伤、手术切除、感染和先天性骨病等造成的大块骨缺损的修复和功能重建一直是骨科领域的难题和研究热点[1-2]。针对大块骨缺损的治疗,自体骨移植一直被认为是其修复方法,但该方法存在供骨来源有限且操作复杂等缺点[3]。随着组织工程学的发展,骨髓间充质干细胞(bone marrow mesenchymal stem cells, BMSCs)在大块骨缺损的骨骼修复中具有重要作用[4]。BMSCs是一种多潜能的干细胞,具有干细胞特性,可分化为软骨细胞、肌细胞、成骨细胞和脂肪细胞等[5]。BMSCs所参与的成骨过程是骨形成的关键步骤,从骨祖细胞到成骨前细胞,最终分化为成熟的成骨细胞[6]。骨形态发生蛋白(bone morphogenetic protein, BMP)信号通路是体外调控成骨分化和体内骨形成的重要途径之一[7-8]。脂联素(adiponectin, ApN)是脂肪组织分泌的一种脂肪因子,研究[9-11]表明,ApN可通过多种途径促进骨形成。本实验旨在研究ApN对BMSCs成骨分化的作用及其机制。
1 材料和方法
1.1 主要材料
人BMSCs和hMSC无血清培养液购自中国科学院上海细胞库;L-抗坏血酸、β-甘油磷酸钠和地塞米松购自Sigma公司;NheI、KpnI、AgeI和EcoRI购自NEB公司;T4 DNA连接酶购自TaKaRa公司;DNA回收试剂盒和质粒提取试剂盒购自天根公司;TOP10感受态细胞购自索莱宝公司;Opti-MEM购自Gibgo公司;Lipofectamine 2000购自凯瑞基公司;茜素红法钙质染色试剂盒购自上海歌凡公司;碱性磷酸酶(alkaline phosphatase, ALP)染色液购自Servicebio公司;Trizol购自Ambion公司;SYBR FAST qPCR Master Mix购自KAPA Biosystems公司;BCA蛋白浓度测定试剂盒购自Solarbio公司;PVDF转移膜和化学发光试剂购自Millipore公司;兔抗ApN抗体购自Bioswamp公司。
1.2 细胞培养
将BMSCs接种于hMSC无血清培养液,置于37 ℃、5 % CO2的环境培养。待细胞长至80 %~90 %融合时,将无血清培养液更换为成骨诱导分化所用的完全培养基(L-抗坏血酸50 μg/mL、β-甘油磷酸钠10 mmol/L、地塞米松10-8mol/L),诱导培养14 d。
1.3 过表达及干扰质粒构建
设计并合成ApN基因过表达引物(3对shRNA),PCR扩增。PCR产物通过琼脂糖电泳后切胶回收,和载体PCDNA3.1-EGFP(pLKO.1-EGFP)分别用NheI和KpnI(AgeI和EcoRI)双酶切,回收酶切产物,加入T4连接酶及连接反应缓冲液,16 ℃连接过夜,连接产物经TOP10感受态细胞转化,挑选阳性克隆菌落接种于含抗生素的LB培养基,37 ℃培养12 h,PCR验证菌落,阳性克隆测序。
1.4 细胞转染
转染前24 h,在6孔板接种5×105个细胞,当细胞融合度为90 %进行转染。用250 μL Opti-MEM稀释4 μg质粒DNA。用250 μL Opti-MEM稀释10 μL Lipofectamine 2000,室温静置5 min。混匀两种稀释液,室温静置20 min。将500 μL复合物加到含有细胞和换有1.5 mL新鲜培养基的培养板中,轻摇培养板。将培养板置于37 ℃、5 % CO2培养箱,培养48 h。
1.5 细胞分组与处理
将BMSCs分为5组:对照组、过表达组、过表达空载组、干扰组和干扰空载组。对照组不做任何处理。过表达组BMSCs转染ApN过表达质粒。过表达空载组BMSCs转染过表达空载质粒。干扰组BMSCs转染ApN干扰质粒。干扰空载组BMSCs转染干扰空载质粒。转染48 h。
1.6 茜素红染色
PBS清洗细胞,4 %多聚甲醛固定30 min。吸去4 %多聚甲醛溶液,加入2 mL茜素红染色液染色30 min,蒸馏水清洗,在倒置显微镜下观察并拍照。
1.7 ALP染色
取6孔板培养各组细胞,PBS清洗。加入2 mL 4 %多聚甲醛固定15 min,PBS清洗。加入2 mL ALP染色液,避光染色15 min,PBS清洗,在倒置显微镜下观察并拍照。
1.8 qRT-PCR检测
取各组细胞约1×106个,加1 mL Trizol提取总RNA。反转录合成cDNA,10 μL SYBR FAST qPCR Master Mix,0.5 μL上游引物,0.5 μL下游引物,1 μL cDNA模板,8 μL ddH2O。反应程序:95 ℃预变性3 min,95 ℃变性5 s,56 ℃退火10 s,72 ℃延伸25 s,进行40个循环。GAPDH作为内参,使用2-ΔΔCT法进行统计分析。
1.9 Western Blot检测
收集各组细胞约1×106个,加200 μL裂解液,4 ℃,12 000g离心10 min,取上清,BCA法测定蛋白浓度。40 μg蛋白上样,SDS-PAGE电泳,将分离的蛋白转移至PVDF膜上。4 ℃环境中,5 %脱脂奶粉封闭12 h,分别加入兔抗ApN(稀释比1∶1 000)兔抗GAPDH(稀释比1∶1 000),室温孵育1 h。蒸馏水清洗膜,加入HRP标记的羊抗兔IgG,室温孵育1 h。蒸馏水清洗膜后加入ECL化学发光试剂,在暗的环境中曝光显影,读取蛋白条带灰度值,统计分析灰度值。

表1 引物序列Table 1 Primer sequences
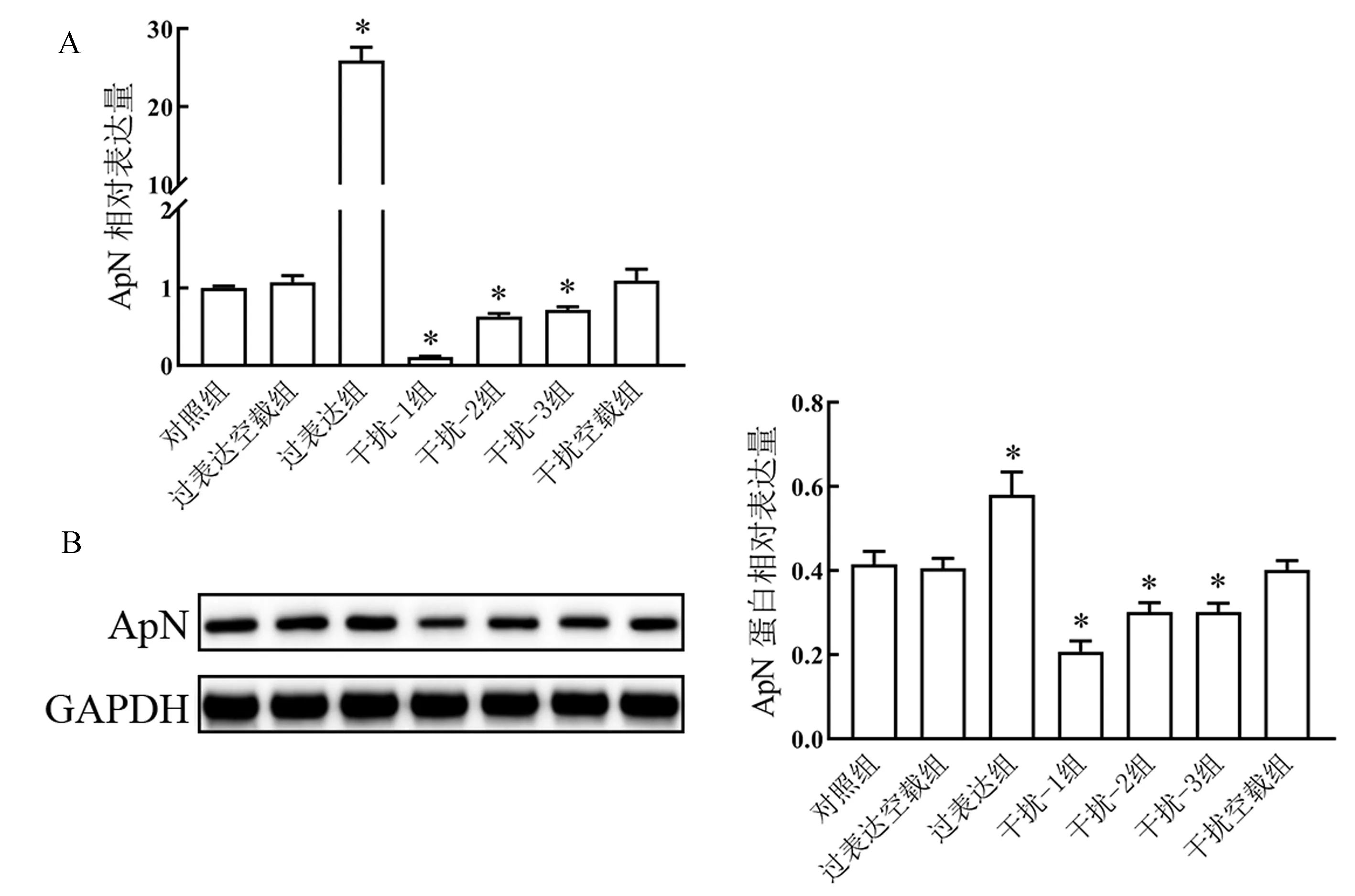
注:A:qRT-PCR检测ApN mRNA表达量;B:Western Blot检测ApN蛋白表达量;与对照组比较,*P<0.05。图1 转染效率鉴定Fig.1 Identification of transfection efficiency
1.10 统计学处理
2 结果
2.1 转染效率鉴定
qRT-PCR和Western Blot检测ApN过表达质粒及干扰质粒转染效率。结果见图1,与对照组相比,过表达组BMSCs中ApN mRNA和蛋白相对表达量显著升高(P<0.05),干扰组BMSCs中ApN mRNA和蛋白相对表达量显著降低(P<0.05),这一结果表明ApN过表达质粒及干扰质粒转染成功。本研究选择干扰效果最好的shRNA-1进行后续实验。
2.2 ApN促进BMSCs钙化沉积
茜素红染色观察各组细胞钙化沉积。结果见图2,与对照组相比,过表达组BMSCs中钙化沉积增多,干扰组BMSCs中钙化沉积减少。表明过表达ApN可促进BMSCs钙化沉积。
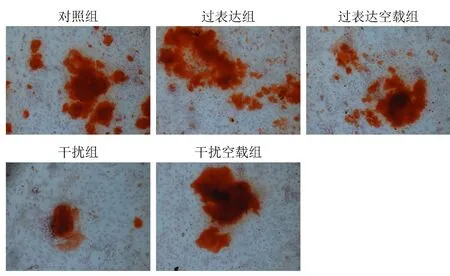
图2 茜素红染色(100×)Fig.2 Alizarin red staining (100×)
2.3 ApN促进BMSCs成骨分化
ALP染色观察各组细胞成骨分化能力。结果见图3,与对照组相比,过表达组BMSCs阳性表达较多,干扰组BMSCs阳性表达较少。表明过表达ApN可促进BMSCs成骨分化。
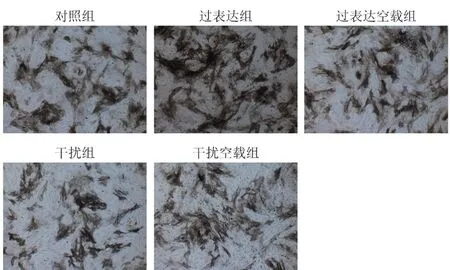
图3 ALP染色(100×)Fig.3 ALP staining (100×)
2.4 ApN上调受体AdipoR1和AdipoR2表达
qRT-PCR检测ApN受体AdipoR1和AdipoR2 mRNA表达量。结果见图4,与对照组相比,过表达组BMSCs中AdipoR1和AdipoR2 mRNA相对表达量显著升高(P<0.05),干扰组BMSCs中AdipoR1和AdipoR2 mRNA相对表达量显著降低(P<0.05)。表明过表达ApN可上调BMSCs中AdipoR1受体和AdipoR2受体表达。
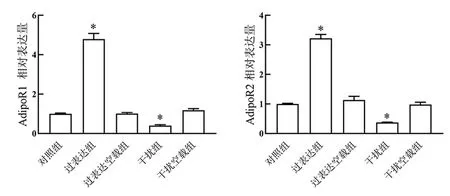
注:与对照组比较,*P<0.05。图4 qRT-PCR检测AdipoR1和AdipoR2 mRNA表达量Fig.4 The mRNA expression levels of AdipoR1 and AdipoR2 were detected using qRT-PCR
2.5 ApN上调BMP信号通路及成骨相关基因表达
qRT-PCR检测BMP信号通路及成骨相关基因mRNA表达量。结果见表2,与对照组相比,过表达组BMSCs中BMP2、RUNX2、Smad1和Smad5 mRNA相对表达量显著升高(P<0.05),干扰组BMSCs中BMP2、RUNX2、Smad1和Smad5 mRNA相对表达量显著降低(P<0.05)。表明过表达ApN可在基因转录水平上上调成骨相关基因表达以激活BMP信号通路。
表2 BMP信号通路及成骨相关基因表达情况
3 讨论
脂肪组织被认为是一种简单的脂质储存器官,后被发现为重要的内分泌器官,能分泌许多细胞因子,例如ApN、瘦素和抵抗素等[12]。ApN是脂肪组织中含量最丰富的脂肪因子,具有抗炎和增加胰岛素敏感性等生物学功能[13]。Yamauchi等[14]最初鉴定了两种ApN受体,AdipoR1以及AdipoR2,AdipoR1主要在肌肉中表达,AdipoR2主要在肝脏中表达。Berner等[15]在人成骨细胞和鼠成骨细胞系MC3T3-E1中均检测到ApN及其受体AdipoR1和AdipoR2的表达。Wang等[16]的研究通过免疫组化方法检测了AdipoR1和AdipoR2在BMSCs中的表达情况,结果显示AdipoR1在细胞核、细胞质和细胞膜中均有表达,而AdipoR2尽在细胞质和细胞膜中表达,表明ApN与BMSCs存在着密切联系。Yang等[17]在ApN缺陷型Adipoqtm1Chan小鼠中研究了ApN对骨代谢的影响,结果表明与野生型小鼠相比,ApN缺陷型小鼠骨量减少,破骨细胞和脂肪细胞生成增加,成骨细胞生成减少。这证明了ApN确实存在调节骨细胞和骨量的作用,然而具体的作用机制还未有报道。
BMSCs是一类具有多向分化能力的原始骨髓细胞,可修复受损骨组织,维持骨组织代谢平衡[1]。研究[18]表明,BMP信号通路在BMSCs分化中发挥重要作用。BMP2是成骨过程中的关键调节因子,BMP2通过与靶细胞上的I型和II型丝氨酸/苏氨酸激酶受体结合,进而磷酸化下游的Smad1/5/9,磷酸化的Smads可与Smad4结合形成复合物,易位进细胞核内,调节RUNX2和Osx等靶基因[19]。然而RUNX2是成骨分化所必需的转录因子,可调节成骨特异性标志物ALP、Col I和OCN等的表达[20]。Qiu等[21]在研究微管微丝交联因子1(microtubule actin cross-linking factor 1, Macf1)在骨形成和成骨分化中的功能和机制时,发现敲低Macf1抑制Bmp2/Smad/RUNX2信号通路,下调ALP、Col I和OCN表达,抑制骨形成和成骨分化。因此BMP2及BMP通路作用ALP在骨形成和骨分化中发挥着重要作用。
ALP是成骨分化的早期标志物[22],在本研究中,我们首先用茜素红染色和ALP染色评估了ApN对BMSCs成骨分化的影响。研究结果显示,过表达ApN增强了BMSCs中钙化沉积,ALP阳性表达也增多;而干扰ApN表达则显示出相反的结果,这表明ApN可促进BMSCs的成骨分化。为探讨BMP通路是否也参与ApN介导的BMSCs成骨分化,我们也检测了BMP信号通路及成骨相关基因的表达。研究结果显示,过表达ApN上调BMSCs中BMP2、RUNX2、Smad1和Smad5 mRNA表达;干扰ApN表达下调BMP2、RUNX2、Smad1和Smad5 mRNA表达。这表明ApN可能是通过激活BMP信号通路发挥促进BMSCs成骨分化的作用。有研究[23]发现,枸杞多糖在缺氧条件下增强了BMSCs的成骨细胞分化,并认为其作用机制为增强了BMSCs中Runx2和ALP的表达。Yuan等[24]证实了新橙皮苷促进小鼠骨髓间充质干细胞的增殖和成骨分化,增强碱性磷酸酶活性,上调成骨细胞标志物的表达与新橙皮苷作用BMP2-Wnt/β-catenin通路的作用机制相关。本研究仅在细胞水平初步探讨了ApN对BMSCs成骨分化的作用和机制,然而ApN对BMP信号通路的调控具体的关键靶点是什么尚不清楚,仍需进一步研究。
综上所述,ApN可通过BMP信号通路促进BMSCs成骨分化。这为BMSCs用于治疗骨损伤提供了一定的理论基础。
——一道江苏高考题的奥秘解读和拓展

