高效广谱复合光催化抗菌剂Ag-AgVO3/BiVO4的设计合成及抗菌机制
邵文惠,胡欣,尚静,林峰,金黎明,权春善,张艳梅,李军
(1.大连民族大学生命科学学院,大连 116600;2.中国科学院大连化学物理研究所催化基础国家实验室,大连 116023;3.大连民族大学物理与材料学院,大连 116600)
致病细菌感染对公众健康造成了巨大威胁.虽然抗生素是控制细菌感染的最有效药物,但抗生素滥用导致的全球耐药性问题使细菌感染的治疗更加困难.因此,亟需开发新型的抗菌剂和抗菌方法对抗细菌感染[1~5].光催化抗菌是利用半导体催化剂在光照下产生高活性的活性氧物种(ROS)破坏并穿透细菌的细胞膜,破坏细胞内的生物活性分子,如蛋白质、DNA等,从而杀死细菌的技术,其独特的抗菌机制不会导致细菌耐药性的产生.与传统的化学法相比,光催化抗菌具有能耗低、效率高、环境友好等优点,有望取代传统的化学抗菌方法来消除微生物对环境的污染[6~13].
在众多的半导体材料中,BiVO4是近年来发展起来的一种铋基半导体光催化材料,具有结构稳定、可见光活性好、可重复使用、性价比高和无毒等特点[14~23].但是由于载流子传输效率低,扩散长度短,光生电子和空穴易复合,光催化效率低,阻碍了其在光催化和抗菌中的应用.将其与其它半导体构建异质结结构可以促进光生电荷与空穴的快速分离,是提高其光催化性能的有效途径[24~29].在多种异质结结构中,Z型光催化体系由于能有效地分离光生电子和空穴而具有优异的光催化活性和稳定性.
在银基光催化剂中,p型半导体AgVO3以其优异的光电性质和催化性能引起了人们的广泛关注,在抗菌领域也显示出巨大的潜力[30~34].然而,由于光生电荷载体的快速复合和光腐蚀问题,使得单一AgVO3的光催化活性相对较低,极大地限制了其实际应用.为了提高AgVO3的光催化性能和稳定性,目前已开发了多种基于BiVO4和AgVO3异质结结构的复合材料[35~40].
本文合成了一种具有树叶状形貌的Ag-AgVO3/BiVO4复合光催化剂用于光催化抗菌.研究结果表明,合成的树叶状形貌的Ag-AgVO3/BiVO4复合光催化抗菌剂不仅表现出优异的光响应类氧化酶活性,而且能有效杀灭金黄色葡萄球菌和大肠杆菌.抗菌机制研究结果表明,在可见光照射下,Ag-AgVO3/BiVO4所产生的光生电子与O2反应生成的·O2-可以破坏细菌细胞膜,造成细胞内容物的流出,从而杀灭多种革兰氏阴性、阳性细菌和真菌.
1 实验部分
1.1 试剂与仪器
五水合硝酸铋(BiNO3·5H2O)和十二水合正钒酸钠(Na3VO4·12H2O),分析纯,国药集团化学试剂有限公司;硝酸银(AgNO3),分析纯,西陇化工股份有限公司;2′,7′-二氯荧光素二乙酸酯(DCFH-DA)、3,3′,5,5′-四甲基联苯胺(TMB)、二甲基亚砜(DMSO)、无水乙酸钠、冰乙酸、无水乙醇、25%戊二醛、异丙醇(IPA)和三乙醇胺,分析纯,阿拉丁科技(中国)有限公司;1,4-苯醌,分析纯,北京百灵威科技有限公司;重铬酸钾(K2Cr2O7),分析纯,江苏联科化学科技有限公司;4′,6-二脒基-2-苯基吲哚(DAPI)、碘化丙啶(PI)和BCA蛋白质定量检测试剂盒,生工生物工程(上海)股份有限公司.
LabX XRD-6000型X射线衍射仪(XRD),日本岛津国际贸易公司;S-4800型扫描电子显微镜(SEM),日本日立公司;JEM-2100型透射电子显微镜(TEM),日本电子株式会社;Escalab Xi+型X射线光电子能谱仪(XPS),美国赛默飞世尔科技有限公司;UV-2600型紫外-可见漫反射吸收光谱仪(UV-Vis-DRS),日本岛津公司;FS5一体化稳态瞬态荧光光谱仪(PL光谱),英国爱丁堡公司;H1型多功能酶标仪,美国伯腾仪器有限公司;IX71型倒置荧光显微镜,德国徕卡显微系统公司;PLS-SEX300D/300DUV型氙灯,北京泊菲莱科技有限公司.
1.2 实验过程
1.2.1 树叶状BiVO4的合成 参考文献[41]的合成方法并进行了轻微的修改来合成树叶状BiVO4.首先,将60 mg BiNO3·5H2O分散在40 mL去离子水中,超声5 min至完全溶解,然后在搅拌下加入100 mg Na3VO·412H2O,搅拌30 min后得到均匀的橙黄色溶液.将溶液转移至100 mL反应釜中,于160℃反应8 h,待冷却至室温后,用去离子水和无水乙醇分别洗涤3次,将固体在60℃的真空干燥箱中干燥12 h,得到黄色粉末,即为树叶状BiVO4.
1.2.2 Ag-AgVO3/BiVO4异质结光催化剂的合成 参考文献[35~41]方法合成Ag-AgVO3/BiVO4异质结光催化剂.首先,在超声条件下将0.324 g(1 mmol)BiVO4分散于50 mL去离子水中,10 min后在分散液中加入0.17 g(1.2 mmol)AgNO3,在黑暗条件下搅拌30 min,然后将溶解在50 mL去离子水中的0.074 g(0.4 mmol)Na3VO4·12H2O缓慢滴加到上述分散液中,在黑暗条件下继续搅拌3 h,反应结束后,将溶液用去离子水和无水乙醇分别洗涤3次,干燥后得到Ag-AgVO3/BiVO4.Ag-AgVO3则是在不添加BiVO4的条件下按照相同流程合成得到.
1.2.3 Ag-AgVO3/BiVO4的光响应类氧化酶活性 以TMB为底物,检测Ag-AgVO3/BiVO4及相关材料的类氧化酶活性[42~44].反应在室温下的24孔板中进行,总体积为2 mL.将0.1 mL样品分散液(2 mg/mL)、0.1 mL TMB溶液(5 mmol/L,DMSO)和1.8 mL乙酸钠缓冲溶液(pH=4.0)充分混合,避光/光照5 min后,用酶标仪测定652 nm处的吸光度来测定其类氧化酶活性.在最佳反应条件下,通过改变底物TMB的浓度进行了TMB的稳态动力学实验.Michaelis-Menten参数利用Lineweaver-Burk方法作图计算得出.
式中:V(mol·L-1·s-1)和Vma(xmol·L-1·s-1)分别代表初始速度和最大速度;[S](mol/L)为TMB的浓度;Km(s-1)为Michaelis常数.
1.2.4 Ag-AgVO3/BiVO4的光催化抗菌活性 选择最常见的两种细菌病原体,金黄色葡萄球菌(S.aureus,ATCC 6538)和大肠杆菌(E.coli,CICC 10003)作为模型菌株,使用梯度稀释法和平板计数法研究了制备的光催化抗菌剂的抗菌活性[45].实验中使用的玻璃器皿均经过高压灭菌,所有实验在无菌条件下进行.将冻存的细菌接种在Luria-Bertani培养基中,于37℃,180 r/min转速下振荡培养10 h,以达到对数生长期.将细菌用pH=7的磷酸盐缓冲溶液(PBS,0.01 mol/L)梯度稀释至106CFU/mL备用.在已灭菌的玻璃瓶中,依次加入1.5 mg制备的光催化剂、2.97 mL PBS缓冲液和30 μL已经稀释好的菌悬液.冷却装置设置为23℃以保证实验在恒温的条件下进行,使用配备紫外线截止滤光片(λ>420 nm)的300 W氙灯,光源位于反应溶液20 cm处.打开光源并开始计时,分别在0,2 min时吸取10 μL菌悬液,用490 μL PBS进行稀释后,取50 μL菌悬液进行涂布,于37℃培养24 h,统计每个培养基上的菌落数.作为对比,在光催化实验的同时进行暗对照(无光照)和空白对照(无光催化剂)实验,并添加万古霉素作为阳性对照,浓度与反应时间均与材料一致(0.5 mg/mL,避光/光照2 min),所有实验均平行操作3次.利用下式计算光催化抗菌率(Antibacterial rate,%).
式中:N0和Nt分别代表未经光照和光照一段时间后的活菌落数.
1.2.5 活性物种的检测 为了研究在光催化抗菌过程中起关键作用的活性物种,分别在反应体系中添加浓度为1 mmol/L的IPA、0.5 mmol/L的1,4-对苯醌、1 mmol/L的K2Cr2O7和1 mmol/L的三乙醇胺,分别作为羟基自由基(·OH)、超氧阴离子(·O2-)、电子(e-)和空穴(h+)的捕获剂[46],具体操作过程与1.2.4节一致.同时,为了消除捕获剂的毒性作用,进行了在光照条件下单独捕获剂与细菌反应的实验作为对照.
1.2.6用于SEM观测的细菌样品的制备 反应结束后,离心收集沉淀并用PBS清洗3次.在4℃下,使用2.5%的戊二醛溶液对细菌的细胞形态进行固定.12 h后,离心收集沉淀,通过梯度分级的乙醇溶液(体积分数25%、50%、75%、100%)对细胞进行脱水.最后,将样品用100%的乙醇溶液重悬,滴到硅晶片上,自然风干后表面喷金,并使用SEM进行观察、拍摄图像[47].
1.2.7 Live/Dead荧光染色实验 使用Live/Dead试剂盒检测Ag-AgVO3/BiVO4的抗菌活性[48].先用Ag-AgVO3/BiVO4处理细菌后,再将细菌用DAPI和PI在黑暗中染色30 min.用PBS洗涤细菌细胞,并使用倒置荧光显微镜观察样品.
1.2.8 细胞内ROS测定 荧光探针DCFH-DA在ROS存在下可被氧化生成具有绿色荧光的2′,7′-二氯荧光素(DCF),绿色荧光强度与ROS水平成正比,因此可以通过测定绿色荧光的强度来测定细胞内部ROS的水平[49].反应结束后,取1 mL反应液离心,用PBS洗涤沉淀3次,加入终浓度为10 μmol/L的DAFH-DA,于37℃避光孵育30 min,使用倒置荧光显微镜拍摄.并用酶标仪检测DCF的荧光强度,设置激发波长为488 nm,发射波长为525 nm.
1.2.9 细菌细胞内容物含量的测定 因细菌内核酸与蛋白质含量较少,且处理时会有损失,故加大了材料的浓度、菌浓度与反应时间.具体为:将3 mL细菌悬液(OD600nm=0.6)离心并用PBS洗涤沉淀3次,使用3 mL催化剂溶液(2 mg/mL)将其重悬.反应条件及过程与1.2.4节一致,光照时间为2 h.
细胞外核酸含量的测定:通过紫外分光光度计检测Ag-AgVO3/BiVO4处理前后细菌胞内核酸含量的变化[50].反应结束后,将反应液离心,取上层清液,使用紫外分光光度计记录其在260 nm处的吸光度.
细胞内蛋白质含量的检测:采用BCA法对Ag-AgVO3/BiVO4处理前后的细菌胞内蛋白含量进行研究[51].反应结束后,离心收集沉淀并用PBS清洗3次.将沉淀用1 mL PBS重悬后,置于冰水浴中,使用超声破碎仪裂解细菌.细胞破碎后,将混合物在4℃下以8000 r/min的转速离心10 min,收集上层清液,用蛋白质检测试剂盒测定上层清液中的蛋白质含量.
1.2.10 抑菌谱 为了验证Ag-AgVO3/BiVO4复合物的广谱抗菌性能,选取7种常见致病菌,包括5种革兰氏阴性菌:鼠伤寒沙门氏菌(S.typhimurium,CICC 21484)、副溶血性弧菌(V.parahemolyticus,CGMCC 11616)、铜绿假单胞菌(P.aeruginosa,PAO1)、克雷白氏肺炎杆菌(K.pneumoniae,BNCC 186113)和鲍曼不动杆菌(A.baumannii,BNCC 194496);1种革兰氏阳性菌:屎肠球菌(E.faecium,BNCC 186113);1种真菌:白色念珠菌(C.albican,CMCC 52201),进行抗菌实验.实验方法、材料浓度、菌浓度均与1.2.4节一致.
1.2.11 统计分析 所有结果均以平均值±标准偏差表示.P值小于0.05的结果被认为具有统计学意义(*代表P<0.05,**代表P<0.01,***代表P<0.001).
2 结果与讨论
2.1 Ag-AgVO3/BiVO4复合材料的形貌和晶体结构表征
首先通过XRD分析3种纳米材料的晶体结构.如图1所示,在Ag-AgVO3/BiVO4复合材料的XRD谱中同时观察到BiVO4和AgVO3的特征峰[16,35],表明BiVO4和Ag-AgVO3成功复合.图2是3种纳米材料的SEM和TEM照片.可见,单独的BiVO4长约2 μm,具有树叶状形貌;而单独的Ag-AgVO3是由长棒、丝状纳米线和纳米颗粒组成的复合结构.在Ag-AgVO3/BiVO4复合材料中,在树叶状BiVO4表面可以观察到由纳米线和纳米颗粒组成的Ag-AgVO3复合材料.
利用XPS进一步表征了Ag-AgVO3/BiVO4的元素组成及价态.图3(A)是Ag-AgVO3/BiVO4的XPS全扫描谱图,可以观察到Ag,V,Bi,O和C 5种元素的信号,其中,C的信号来源于仪器中不确定的碳[52].图3(B)是Bi4f的高分辨率XPS谱图,159.2和164.5 eV处的2个强峰分别对应Bi4f7/2和Bi4f5/2的内层电子[53],证实了Ag-AgVO3/BiVO4中铋的价态是Bi3+.图3(C)是O1s的高分辨率XPS谱图,529.9,530.4和532.2 eV处的峰分别来自Ag-AgVO3和BiVO4中的O元素以及吸附在材料表面的O[54];V2p能级的结合能是随着V离子的氧化态增加而增加的,因此XPS可以测定含V材料的价态.从V2p的高分辨率XPS光谱[图3(D)]中可以看出,由于两种材料中V2p的化学环境不同,与V2p相关的V2p1/2和V2p3/2峰处于不同的位置,对峰形进行拟合后,Ag-AgVO3在517.5和524.3 eV处产生V2p1/2和V2p3/2的峰,516.8和524.1 eV处的峰则归属于BiVO4[38].图3(E)是Ag3d的高分辨率XPS谱图,图中367.8和373.8 eV处的峰分别对应于Ag3d5/2和Ag3d3/2的结合能,对2个峰进行分峰拟合,367.6和373.7 eV的峰来自Ag-AgVO3中的Ag+,而368.3和374.3 eV的峰来自于Ag0,说明在复合物Ag-AgVO3/BiVO4中存在单质银[36].

Fig.1 XRD patterns of materials

Fig.2 SEM(A—D)and TEM(A′—D′)images of BiVO4(A,A′),Ag-AgVO3(B,B′)and Ag-AgVO3/BiVO4(C,C′,D,D′)

Fig.3 XPS spectra of Ag-AgVO3/BiVO4
2.2 Ag-AgVO3/BiVO4的类氧化酶活性
TMB溶液呈无色透明状,当其被ROS氧化成ox-TMB后,溶液由无色变为蓝色,在652 nm处有最大吸收峰[55],因此,可以通过检测OD652nm来测定Ag-AgVO3/BiVO4的光响应类氧化酶活性.通过一系列对照实验探索了Ag-AgVO3/BiVO4复合物的光响应类氧化酶活性.如图4(A)所示,在光照条件下,Ag-AgVO3/BiVO4具有优异的类氧化酶活性,且表现出比单一Ag-AgVO3或BiVO4更强的类氧化酶活性.这可能是因为形成复合物后,复合物中各单组分之间产生了协同效应.
为了进一步确认Ag-AgVO3/BiVO4为具有光响应类氧化酶活性的纳米材料,进行了稳态动力学实验,通过固定Ag-AgVO3/BiVO4的浓度,改变TMB的浓度,得到了典型的Michaelis-Menten曲线[图4(B)],将数据进行Lineweavere-Burk拟合后,发现其具有较高的吻合度[图4(C)].通过计算可以得出光响应类氧化酶Ag-AgVO3/BiVO4对TMB的米氏常数Km为0.11 mmol/L,最大反应速度vmax为10.62×10-8mol·L-1·s-1.
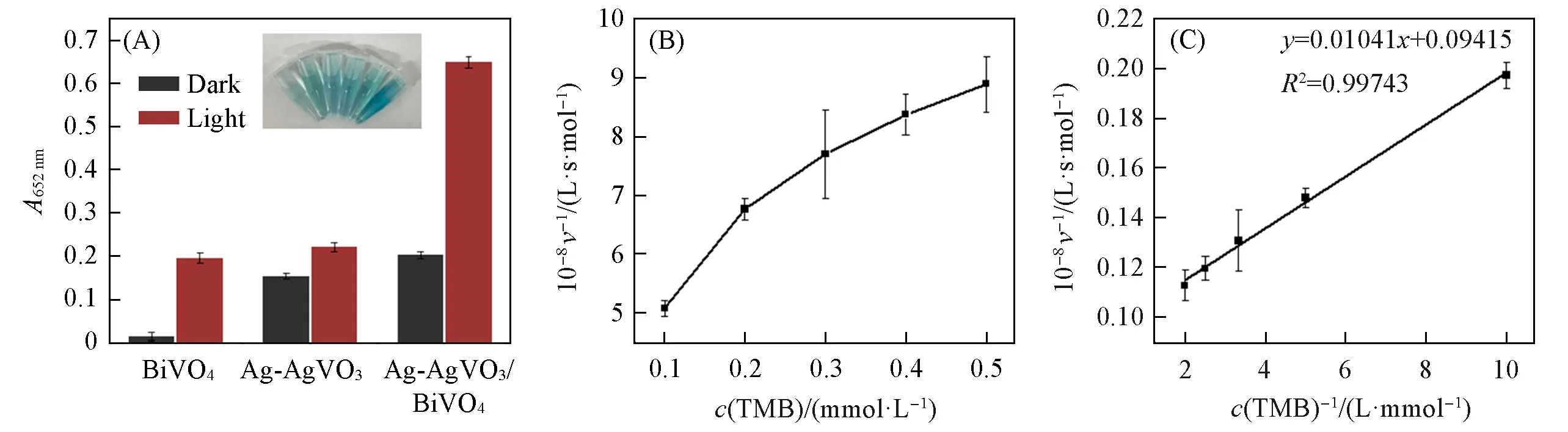
Fig.4 Oxidase-like activity(A),steady-state kinetic assays of photocatalytic activity for Ag-AgVO3/BiVO4(B)and the corresponding double reciprocal plots of TMB(C)
2.3 光学特性分析
通过UV-Vis DRS测定了纳米材料的光吸收特性.如图5(A)所示,Ag-AgVO3与BiVO4复合后,吸收边出现明显红移,增强了对可见光的吸收,说明Ag-AgVO3与BiVO4复合可以提高BiVO4的光吸收性能.对于晶体半导体来说,半导体的禁带宽度(Eg)可结合UV-Vis-DRS的数据通过公式ahυ=A(hυ-Eg)n/2得出,其中,a为吸收系数,h为普朗克常数,υ为入射光频率,Eg为禁带宽度,A为常数[56].如图5(B)所示,由(ahυ)2-hυ曲线可估算出BiVO4和Ag-AgVO3/BiVO4的禁带宽度分别为2.50和2.42 eV.以上结果表明,复合后的Ag-AgVO3/BiVO4禁带宽度减小,对光的吸收范围增大,使其在可见光照射下的光催化中具有潜在的应用价值.图5(C)显示了BiVO4、Ag-AgVO3和Ag-AgVO3/BiVO4的PL光谱,Ag-AgVO3/BiVO4的荧光强度明显低于BiVO4和Ag-AgVO3.结果表明,Ag-AgVO3和BiVO4复合后,光生电子和空穴复合效率显著降低[41].
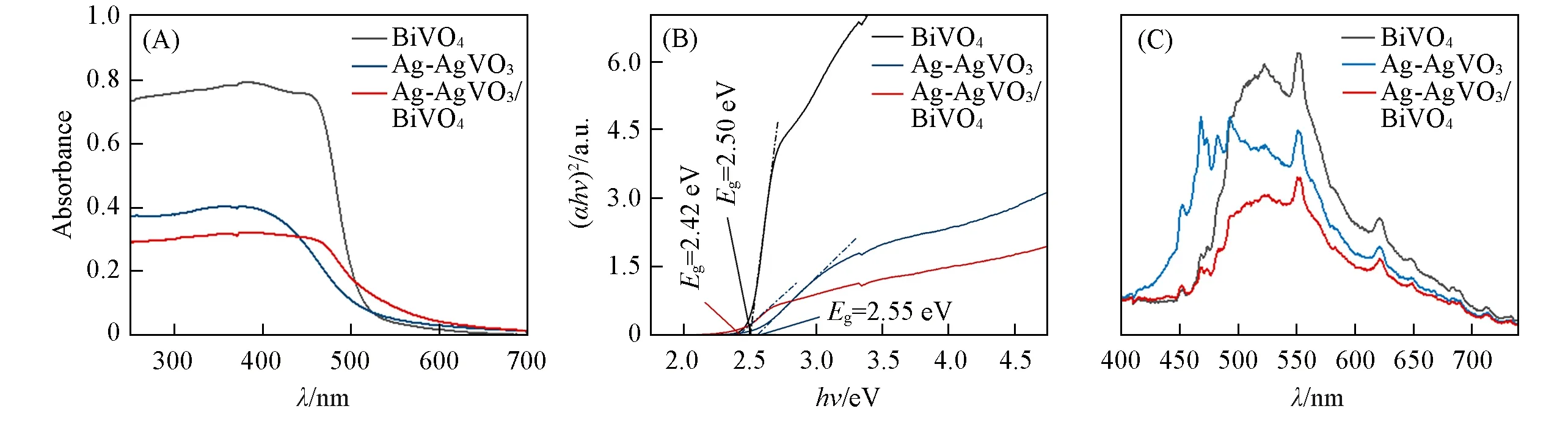
Fig.5 UV-Vis DRS spectra(A),(ahυ)2-hυ plots(B)and PL spectra of the as-prepared photocatalysts(C)
2.4 Ag-AgVO3/BiVO4的抗菌活性
S.aureus和E.coli是革兰氏阳性菌和阴性菌的典型代表致病菌株.本实验以这两种细菌为研究对象,探究了Ag-AgVO3/BiVO4纳米抗菌剂的光催化抗菌性能.选择0.5 mg/mL的浓度作为实验浓度,通过混合细菌的悬浮液和光催化剂,在可见光照射下评估了抗菌效率,结果如图6所示.首先,单独光照的抗菌效率小于5%.在光照下,Ag-AgVO3/BiVO4复合材料的抗菌率高于单独的BiVO4和Ag-AgVO3.光照2 min后,Ag-AgVO3/BiVO4复合材料对金黄色葡萄球菌的抗菌率可达到99%以上,对大肠杆菌的抗菌率可达到86%(延长时间至4 min时可达到99%以上),比单独的BiVO4的抗菌效率提高近4倍.由于革兰氏阴性菌和革兰氏阳性菌的细胞壁结构有差异,造成了在许多抗菌实验中对二者的抗菌效率差异较大.Li等[57]研究发现,相比于E.coli,光敏剂TCPP对S.aureus的抗菌效果极佳,这是因为阳性菌的细胞壁成分大多为具有网状结构的肽聚糖,ROS更易穿透相对多孔的阳性菌.为了提高对E.coli的抗菌效果,作者使用三氨基氯胍(TG)对其进行修饰,合成了稳定性好的阳离子型TCPP-TG NPs,带正电的TCPP-TG NPs可以实现对细菌的有效黏附,缩短了ROS作用的距离,从而提高了对E.coli的抗菌效果.而本实验制备的Ag-AgVO3/BiVO4对两种细菌均具有较高的抗菌效果,这表明具有异质结结构的Ag-AgVO3/BiVO4可以有效分离空穴和电子,在光照瞬间产生的大量ROS足以杀死两种细菌,具有优异的光催化抗菌性能.

Fig.6 Photocatalytic antibacterial rate for different photocatalysts in dark and irradiated by visible light for 2 min(A,B)and corresponding spread plate results of S.aureus and E.coli grown on different samples(C,D)
2.5 Ag-AgVO3/BiVO4的光催化抗菌机理
2.5.1 ROS检测ROS是生物体内新陈代谢过程中的副产物,参与整个细胞的生长、发育、衰老和凋亡的全过程.DCFH-DA本身没有荧光,进入细胞内后,可以被细胞内的酯酶水解生成DCFH,细胞内的ROS能够氧化无荧光DCFH生成有绿色荧光的DCF.DCF不具有细胞通透性,会聚集在细胞内,因此可以通过测定绿色荧光的强度来判断细胞内活性氧的水平.纳米材料通过与细菌的相互作用使细菌产生氧化应激是其主要的抗菌机理之一,光催化剂产生的ROS不仅可以破坏细胞膜完整性,在进入细胞后还会破坏线粒体膜通透性和细胞呼吸链,使细胞内调节系统紊乱[58].从图7(A)和(B)中可以看出,未经处理的细菌处于正常状态,几乎观察不到绿色荧光,表明细菌内的ROS水平极低;经过BiVO4和AgVO3处理后,荧光强度比空白对照组略有增加;而经Ag-AgVO3/BiVO4光照处理后的细胞内的绿色荧光最强.说明在光照下Ag-AgVO3/BiVO4产生的ROS水平显著上升,引起细菌内ROS调节系统紊乱,从而导致细菌的死亡.
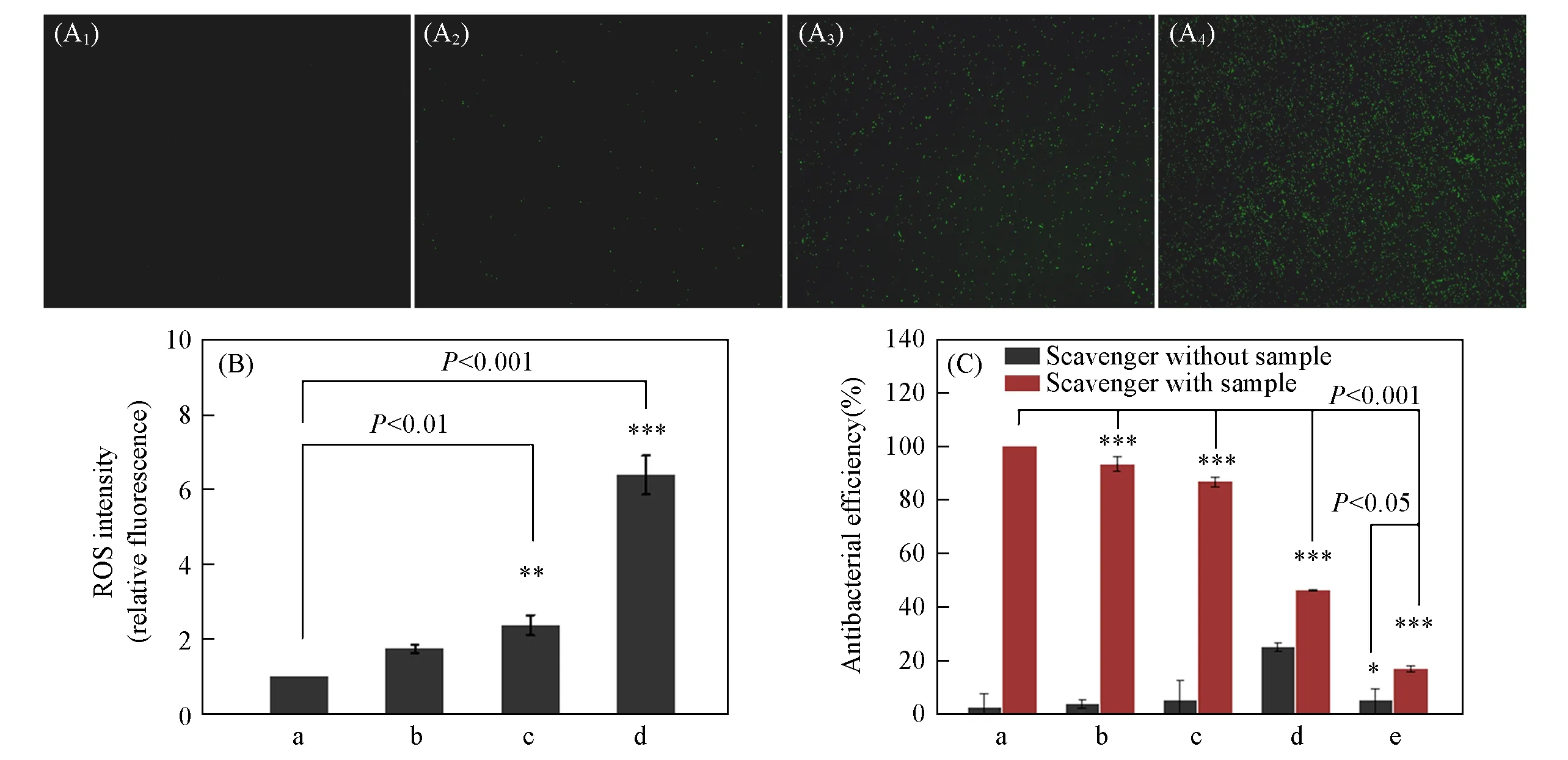
Fig.7 Fluorescence images(A1—A4)and ROS intensities(B)of bacterial cells treated with different materials and antibacterial activity of Ag-AgVO3/BiVO4 in the absence(control)or presence of different scavengers against S.aureus(C)
2.5.2 活性物种分析ROS是由光催化剂受到光照时,与周围环境中的H2O和O2发生氧化还原反应所产生的,通常被认为是导致细菌死亡的主要原因[59].捕获剂实验可以确定在光催化抗菌过程中起到主要作用的活性物种.如图7(C)所示,当反应体系中加入异丙醇(捕获·OH)和三乙醇胺(捕获h+)时,抗菌效率略有下降;加入对苯醌(捕获·O2-)和重铬酸钾(捕获e-)后,抗菌效率显著降低,说明在光照下,半导体表面的光生e-可以还原O2形成·O2-,攻击细胞膜,导致细菌死亡[60].
2.5.3 细菌细胞膜的完整性 为了进一步研究Ag-AgVO3/BiVO4的光催化抗菌机制,进行了Live/Dead实验,以验证细菌细胞膜的完整性.DAPI和PI都是可以对细胞内DNA/RNA染色的荧光染料,但PI无法通过代谢活跃的健康细胞膜,因此只可以对受损细胞或死亡细胞的核酸物质进行染色[48].如图8所示,在空白对照实验中,只有少数死细胞,表明细菌在没有光催化剂存在的条件下照射仍然可以存活.与此形成鲜明对比的是,在光照下,经Ag-AgVO3/BiVO4处理后,S.aureus和E.coli的细胞内都呈现出比空白对照组更强的红色荧光,说明Ag-AgVO3/BiVO4都能通过破坏细胞膜有效杀死细菌[61].

Fig.8 Representative fluorescence images of live(blue)and dead(red)cells after treatment
2.5.4 SEM照片进一步采用SEM直观地分析细菌的形态变化.完整的细胞结构、细菌细胞表面光滑平整是细菌生存的必要条件[62].如图9所示,在空白对照组的细菌中,E.coli细胞呈典型的棒状结构,S.aureus呈圆葡萄状,两种细菌表面光滑,说明此时细胞结构完整.经Ag-AgVO3/BiVO4处理后,可以观察到细菌细胞表面凹陷和破损,说明具有强氧化性的ROS可以造成细胞膜的氧化损伤,让其失去生物学功能,导致成细菌死亡[63].这一结果进一步证实了抗菌实验和ROS荧光检测的结果.
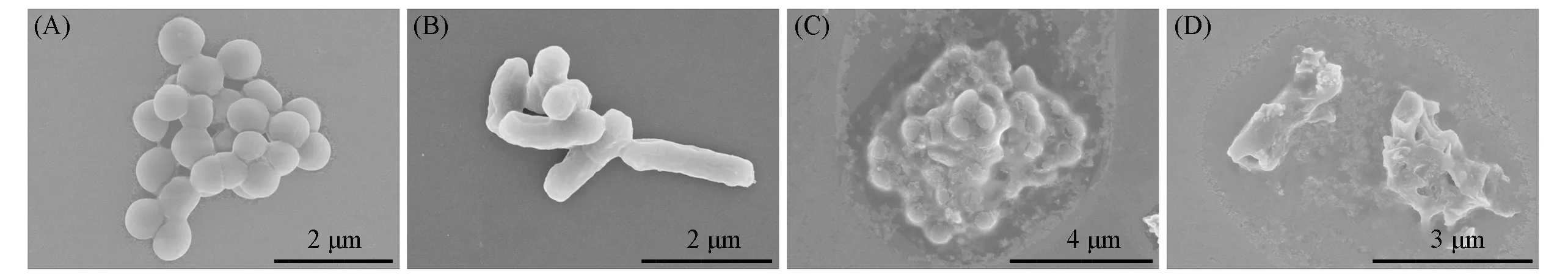
Fig.9 SEM images of bacterial in different pretreated conditions
2.5.5 细胞外大分子含量的测定和细胞内蛋白质含量检测对Ag-AgVO3/BiVO4处理前后细菌胞内的核酸和蛋白质含量变化进行了测定.由于核酸中含有嘌呤和嘧啶分子,二者具有共轭双键,在260 nm处有最大吸收峰,因此可以通过检测OD260nm来测定核酸的含量.如图10(A)所示,处理后的E.coli和S.aureus在260 nm处的吸光度均高于空白组,表明Ag-AgVO3/BiVO4破坏了细胞膜后,导致核酸流失到细胞膜外[64].采用BCA法测定细胞破碎后细胞内蛋白质含量的变化.在生命体中,蛋白质通常参与中枢代谢、基因转录并存在于周质、内膜和外膜中,维持着生命体的正常生命活动.如图10(B)所示,Ag-AgVO3/BiVO4处理后细胞内蛋白质的含量均低于未处理的,表明Ag-AgVO3/BiVO4使细胞膜破裂后,蛋白质流失到细胞外,细胞内的蛋白质含量降低.当蛋白质含量明显下降时,细菌就不能进行正常的生命活动[65].
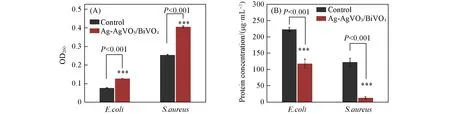
Fig.10 Changes of intracellular contents of bacterial before and after treated with Ag-AgVO3/BiVO4
2.6 广谱抗菌性
为验证Ag-AgVO3/BiVO4复合材料的广谱抗菌性能,选取7种常见致病菌进行了抗菌实验.结果(图11)表明,Ag-AgVO3/BiVO4复合材料对这7种致病菌均具有良好的抗菌效果,具有广谱抗菌性[66].

Fig.11 Antibacterial properties of Ag-AgVO3/BiVO4 against seven common pathogens
3 结 论
通过水热法和化学沉淀法制备了Ag-AgVO3/BiVO4纳米抗菌剂.Ag-AgVO3/BiVO4具有优异的光响应类氧化酶活性.光催化抗菌实验表明,Ag-AgVO3/BiVO4具有较高的抗菌效率,经过2 min的光照,对S.aureus和E.coli的抗菌率分别可以达到99%和86%.并且通过延长光照时间,可使对E.coli的抗菌率达到99%.抗菌机理研究证明,Ag-AgVO3/BiVO4受到光照所产生的e-可以还原环境中的O2生成·O2-,从而使细菌发生氧化应激,细胞膜破裂后细胞内核酸和蛋白质泄露,造成细菌死亡.此外,Ag-AgVO3/BiVO4对包括革兰氏阳性菌、革兰氏阴性菌和真菌在内的9种微生物具有高效抗菌效果,说明其具有广谱抗菌性能,有望在污水处理和抗菌涂层中得到应用.

