有氧运动对非小细胞肺癌吉非替尼耐药的延缓作用
杨 洪,刘怡文,孔金玉
1)河南科技大学体育学院 河南洛阳 471000 2)河南科技大学临床医学院;河南科技大学第一附属医院分子生物实验室;河南科技大学肿瘤研究所;河南省肿瘤表观遗传学重点实验室 河南洛阳 471000
肺癌发病率与病死率极高,其中约80%为非小细胞肺癌(non-small cell lung cancer,NSCLC)。NSCLC早期多表现为呼吸系统疾病的一般症状,易被忽略,确诊时多发展至晚期,预后极差[1]。有研究[2]报道表皮生长因子受体(epidermal growth factor receptor,EGFR)的激活突变是NSCLC的关键驱动因素,以EGFR-酪氨酸激酶抑制剂(EGFR-tyrosine kinase inhibitors,EGFR-TKIs)为主的分子靶向治疗为晚期NSCLC患者开启了“希望之门”,但耐药的产生使后续治疗无法进行。因此,研究NSCLC获得性耐药机制以及寻找延缓耐药产生的方法成为降低NSCLC病死率的有效策略。有学者[3-4]发表了关于EGFR-TKIs获得性耐药机制的研究成果,且已在肺癌中成功分离、富集出了肿瘤干细胞(cancer stem cells,CSCs)[5]。尽管传统的放、化疗对肿瘤有一定的治疗效果,但临床数据显示CSCs对各种治疗均具有抗性,CSCs被认为是肿瘤耐药、复发和转移的根源[6]。TKIs药物的长期应用可能引起CSCs大量富集,导致NSCLC获得性耐药。有研究[7-8]证实乙醛脱氢酶1(acetaldehyde dehydrogenase 1,ALDH1)可作为NSCLC优选的干细胞标记物。
近年来,有氧运动已成为肿瘤辅助治疗的新趋势。乳腺癌及前列腺癌患者治疗后进行有效的有氧运动可显著改善其生活质量,并延长其生存期[9-10];而肥胖、缺乏运动和高代谢综合征的宫颈癌患者复发和转移率则显著增加[11],提示有氧运动可作为肿瘤治疗的有效辅助措施。有研究[12-14]显示,有氧运动可加速血液循环,改善组织供氧量,有利于肿瘤组织中缺氧诱导因子1(hypoxia-inducible factor-1,HIF-1)降解,削弱其对CSCs的维持作用。
本研究首先检测NSCLC亲本细胞系及吉非替尼耐药细胞系中HIF-1、ALDH1与血管内皮生长因子(vascular endothelial growth factor,VEGF)蛋白、CSCs百分比及吉非替尼半数抑制浓度(IC50),探索NSCLC吉非替尼获得性耐药产生的潜在分子机制;然后通过有氧运动联合吉非替尼干预皮下荷瘤裸鼠,进一步研究有氧运动对NSCLC吉非替尼获得性耐药的影响,为NSCLC的临床治疗提供新思路。
1 材料与方法
1.1 主要材料、试剂与仪器人NSCLC亲本细胞系PC-9及吉非替尼诱导的人NSCLC耐药细胞系PC-9-GR(本实验室冻存);吉非替尼治疗后耐药复发的NSCLC患者肿瘤组织活检样本及血液样本(河南科技大学第一附属医院胸外科志愿者);吉非替尼(美国Selleck Chemicals公司);CCK-8试剂盒(日本同仁公司);ALDEFLUOR®干细胞检测试剂盒(加拿大Stemcell Technologies公司);PKH67细胞荧光标记试剂盒(美国Sigma-Aldrich公司);RPMI 1640培养基(美国Gibco公司);4~6周龄健康SPF级BALB/c雄性裸鼠[体重约20 g,常州卡文斯实验动物有限公司;动物许可证号:SCXK(苏)2016-0010];HIF-1、ALDH1、VEGF和内参GAPDH抗体(英国Abcam公司);二抗和BCA蛋白定量试剂盒(中国康为世纪生物科技有限公司);PVDF膜(美国Millipore公司);Trizol和ECL发光显影液(美国Invitrogen公司);凝胶成像系统和酶标仪(美国Bio-Rad公司);倒置光学显微镜(日本尼康公司);PE小动物活体光学成像系统(美国珀金埃尔默公司);流式细胞仪(美国贝克曼公司);SA101C动物跑台(江苏赛昂斯生物科技有限公司)。
1.2 细胞实验
1.2.1PC-9及PC-9-GR细胞吉非替尼IC50的CCK-8法检测 分别于96孔板中配制100 μL两株细胞悬液(每孔1 000个细胞),加入不同浓度(0.000 1、0.000 2、0.000 3、0.000 5、0.001、0.002、0.003、0.03、0.08、0.2、1.0、3.0、8.0、10.0 μmol/L)的吉非替尼,至培养箱(37 ℃,含体积分数为5%的CO2)中培养24 h。向每孔加入10 μL CCK-8溶液,酶标仪测定OD450 nm,比较吉非替尼对不同细胞的24 hIC50,具体步骤参考文献[15-16]。实验重复3次。
1.2.2HIF-1、ALDH1及VEGF蛋白表达的Western blot法检测 提取各组细胞及各组裸鼠肿瘤组织新鲜蛋白后,用BCA蛋白定量试剂盒检测浓度并定量。每泳道30 μg总蛋白,100 g/L SDS-聚丙烯酰胺凝胶电泳分离,PVDF膜转膜,50 g/L脱脂牛奶溶液封闭1 h,HIF-1、ALDH1、VEGF和内参GAPDH(用TBST按照1∶1 000稀释)抗体4 ℃孵育过夜。二抗(用TBST按照1∶2 000稀释)孵育2 h,ECL显影液检测目的蛋白条带,凝胶成像系统采集图像,Image Lab软件测定蛋白条带灰度值,以目的蛋白与内参蛋白条带灰度值比值为最终蛋白相对表达量[15-16]。实验重复3次。
1.2.3ALDH1+标记的CSCs百分比的流式细胞术检测 用ALDEFLUOR®检测缓冲液重悬细胞。每个待测样本均设置一个“检测”管(DEAB-)与一个“对照”管(DEAB+),于流式细胞仪检测ALDH1+标记的CSCs百分比,具体步骤参考说明书及文献[15-16]。实验重复3次。
1.3 裸鼠皮下荷瘤实验取24只4~6周龄雄性裸鼠。饲养环境:温度(25±2) ℃,湿度40%~60%,自然昼夜照明。饲养条件:饲料、饮水均为SPF级,裸鼠自由进食、饮水,适应性饲养 1周。随机分为对照组、吉非替尼治疗组、有氧运动组和有氧运动+吉非替尼组(联合组)4 组。每组6只,SPF级鼠笼饲养。皮肤消毒后,于每只裸鼠右侧腋下接种PKH67荧光标记后的PC-9-GR细胞5×106个。荷瘤成功后,吉非替尼治疗组和联合组裸鼠每日口腔灌注吉非替尼,剂量为75 mg/kg,至实验结束。
有氧运动组及联合组裸鼠在适应性跑台训练5 d(速度1 m/min,跑台坡度0°)后,给予运动训练[17]:①跑台速度为17 m/min(84%VO2max),每 15 d重复校准1次,跑台坡度均为 0°。②每次训练前均做10 min热身运动(速度1 m/min,跑台坡度 0°)。③运动过程中使用毛刷刺激裸鼠,将其维持在跑台跑道前1/3处。④每次实验后均需检查裸鼠是否受伤,如受伤则及时治疗和休息。⑤裸鼠运动1次/d, 60 min/次。⑥每周运动6 d,休息1 d。⑦实验周期为8周(56 d)。对照组及吉非替尼治疗组不做运动训练。
实验期间由小动物活体成像仪拍摄并检测肿瘤大小,具体测量方法参照本课题组前期研究[15]。结束后颈椎脱臼法处死裸鼠,并将瘤体剥离称重。称重后将瘤体分为两部分:一部分配制成单细胞悬液,应用ALDEFLUOR®干细胞检测试剂盒,通过流式细胞仪检测各组瘤体内ALDH1+标记的CSCs百分比。另一部分经液氮冷冻研磨,提取各组裸鼠肿瘤组织新鲜蛋白后,用于HIF-1、ALDH1及VEGF蛋白表达的Western blot法检测。
1.4 裸鼠移植瘤实验NSCLC患者用于入组标准:①病理学明确诊断为NSCLC。②吉非替尼耐药复发患者。③临床信息完整。④愿意配合并签署知情同意书。⑤经病理活检取得肿瘤组织最短径≥2 mm,且无坏死或非肿瘤组织。本研究成功入组7位吉非替尼治疗后耐药复发的NSCLC患者,并同时采集患者血液样本≥10 mL。将患者血液样本1 000 r/min离心5 min,留取血清分装至多个 EP 管内(1 mL/管)置于-80 ℃冰箱储存。患者肿瘤组织样本离体后立即用生理盐水冲洗,剔除坏死或非肿瘤组织,没入患者血清,于37 ℃、体积分数5%CO2培养箱孵育5 min后接种于裸鼠皮下。
采用25号套管针分别将患者的肿瘤组织接种于裸鼠右侧近腋窝处,每个患者的肿瘤组织接种6只裸鼠。饲养环境及条件同1.3。接种后每周检测各组裸鼠成瘤情况,此为第1代人源肿瘤(patient derived xenograft,PDX)模型。8 周后颈椎脱臼法处死裸鼠,并将瘤体剥离,接种于新一批裸鼠右侧腋下,接种方法同前,此为第2代PDX模型。直至第3代PDX模型建立成功后,进行后续实验。本研究共获取7例患者的肿瘤组织标本,其中3例患者的肿瘤标本在裸鼠腋下移植成功并成功培养至第3代(共18只)。
取第3代PTX模型鼠,采用分层随机的方法,以患者为分层因素,每个患者的移植瘤随机分为2组:1号患者移植瘤对照组(对照组1),1号患者移植瘤实验组(实验组1);2号患者移植瘤对照组(对照组2),2号患者移植瘤实验组(实验组2);3号患者移植瘤对照组(对照组3),3号患者移植瘤实验组(实验组3)。每组3只,SPF级鼠笼饲养。移植瘤成瘤后,各组裸鼠均每日口腔灌注吉非替尼,剂量为75 mg/kg,至实验结束。各移植瘤实验组裸鼠给予运动训练,方案见1.3。其余各移植瘤对照组裸鼠不做运动训练。实验期间,每7 d通过游标卡尺检测并记录肿瘤体积,肿瘤体积(cm3)=π/6×长×宽2[15];8周后颈椎脱臼法处死裸鼠,并将瘤体剥离称重。称重后检测各组瘤体内ALDH1+标记的CSCs百分比及HIF-1、ALDH1、VEGF蛋白的表达情况,方法同1.2。
1.5 统计学处理采用SPSS 26.0对数据进行统计分析,应用两独立样本的t检验比较PC-9与PC-9-GR细胞中HIF-1、ALDH1、VEGF蛋白表达和CSCs百分比、吉非替尼IC50的差异。应用2×2析因设计的方差分析比较吉非替尼治疗及有氧运动对裸鼠成瘤能力及瘤体内HIF-1、ALDH1、VEGF蛋白表达及CSCs百分比的影响。应用配对资料t检验比较同一时间点各实验组与各对照组之间移植瘤体积、质量的差异以及移植瘤组织中HIF-1、ALDH1、VEGF蛋白表达和CSCs百分比的差异。检验水准α=0.05。
2 结果
2.1 PC-9及PC-9-GR细胞的吉非替尼IC50,HIF-1、ALDH1、VEGF蛋白表达及CSCs百分比比较结果见图1、表1。由图1、表1可知,与PC-9相比,PC-9-GR中上述指标均显著增高(P<0.05)。

1:PC-9细胞;2:PC-9-GR细胞
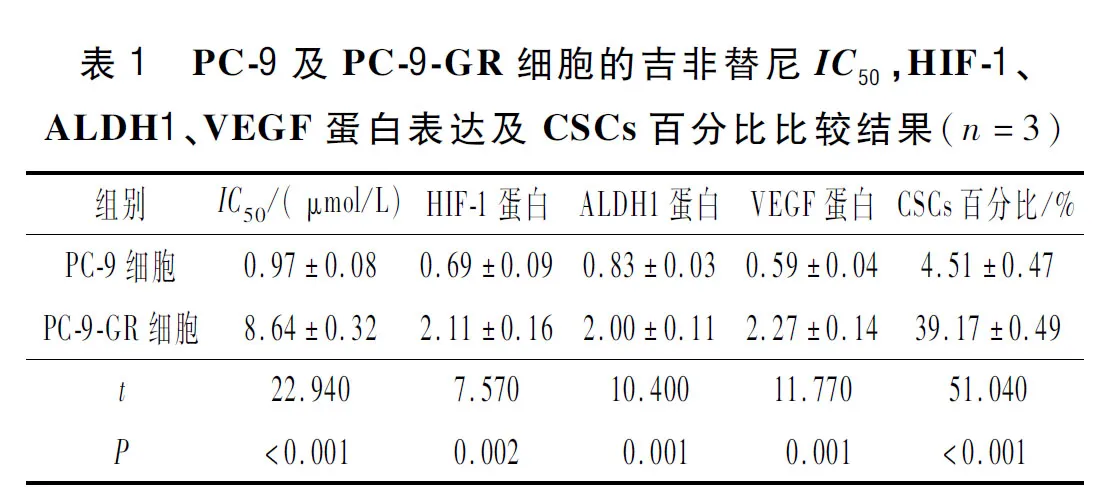
2.2 各组荷瘤裸鼠肿瘤体积和质量的比较结果见表2。由表2可知,吉非替尼治疗及有氧运动均可降低裸鼠荷瘤能力,且二者存在协同作用。
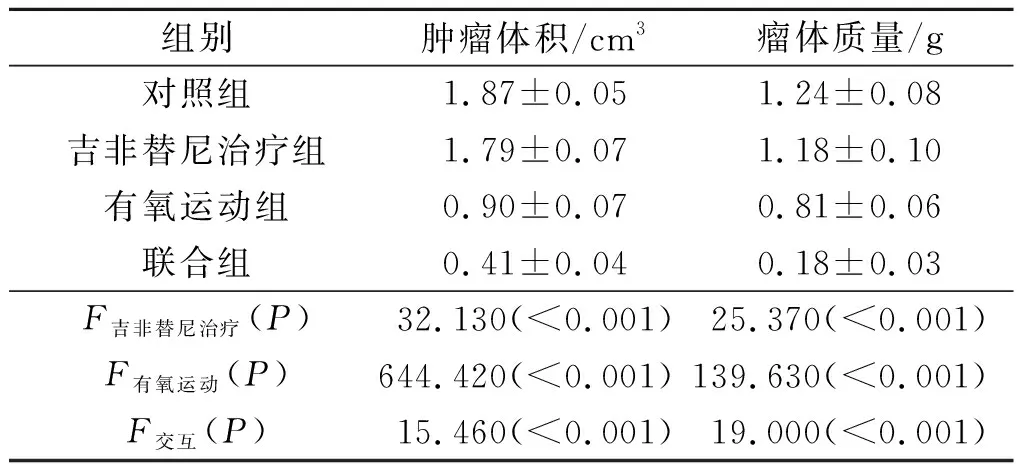
表2 各组荷瘤裸鼠肿瘤体积和质量的比较结果 (n=6)
2.3 各组荷瘤裸鼠瘤体内HIF-1、ALDH1、VEGF蛋白表达及CSCs百分比的比较结果见图2、表3。由图2、表3可知,吉非替尼对裸鼠瘤体内上述指标无影响,而有氧运动可使上述指标降低,二者不存在交互作用。

1:对照组;2:吉非替尼治疗组;3:有氧运动组;4:联合组

表3 各组荷瘤裸鼠瘤体内HIF-1、ALDH1、VEGF蛋白表达及CSCs百分比的比较结果(n=6)
2.4 各组裸鼠移植瘤体积和质量的比较结果见表4。由表4可知,与对照组相比,实验组裸鼠移植瘤体积及质量均减小,差异有统计学意义。
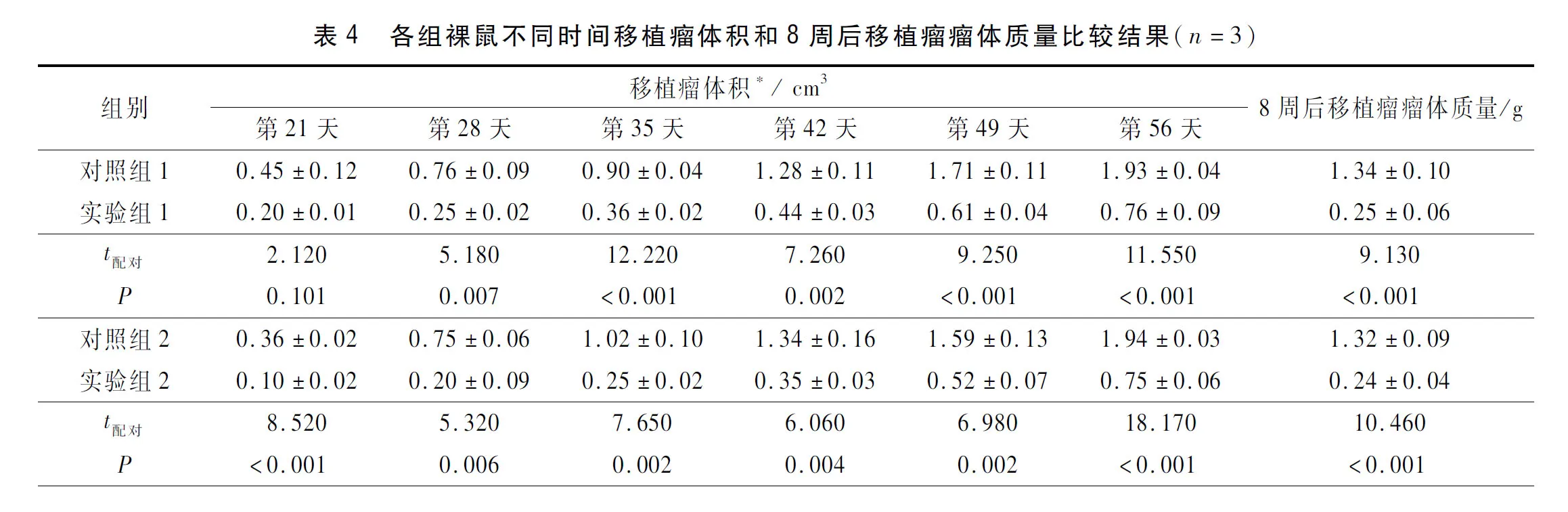
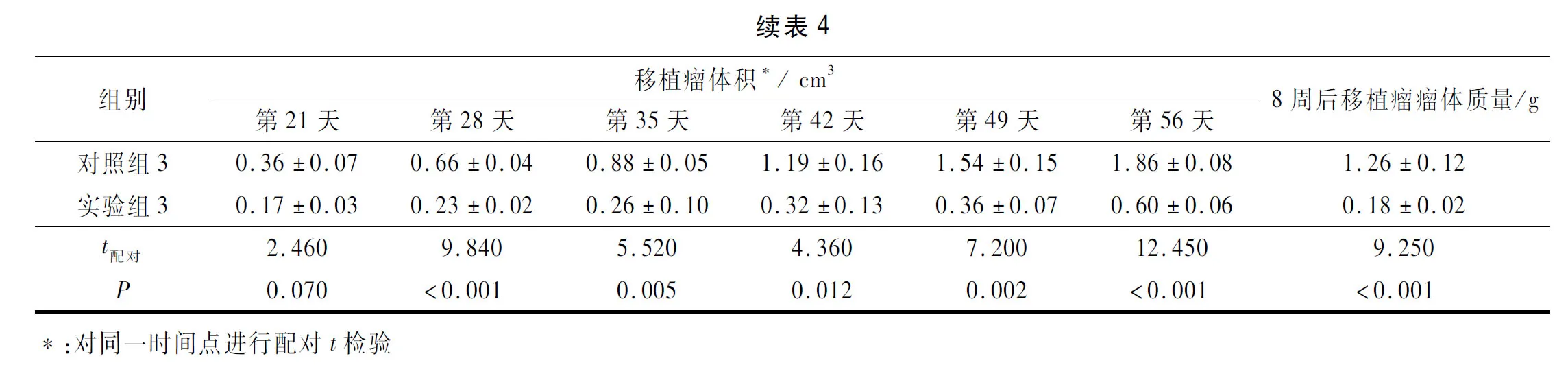
2.5 各组裸鼠移植瘤组织中HIF-1、ALDH1、VEGF蛋白表达及CSCs百分比检测结果见图3、表5。由图3、表5可知,与对照组相比,实验组裸鼠移植瘤组织中HIF-1、ALDH1、VEGF表达及CSCs均减少,差异有统计学意义(P<0.05)。

3 讨论
NSCLC目前主要的治疗手段为手术、放疗、化疗等,但治疗效果仍不理想。因此,寻找与NSCLC恶性进展密切相关的因素、为治疗提供可能的新靶点具有极其重要的意义。EGFR优势突变的NSCLC患者对TKIs药物反应良好,但易产生耐药[2]。研究[5-6]表明,目前的治疗手段主要针对已分化的细胞,而不是CSCs,恰恰这些数量极少的CSCs决定了恶性肿瘤的发生、侵袭、转移及对治疗的敏感性。CSCs的检测与分选已成为肿瘤治疗的关键。ALDH1是一种将醛类氧化成羧酸类的依赖NAD(P)+的酶,具有高度氧化活性,参与基因表达、组织分化和维持内环境稳定等功能[7-8]。2007年Ginestier等[18]发现 ALDH1 是乳腺癌干细胞的标志物,揭开了ALDH1在CSCs领域研究的篇章。此后,陆续有研究[19-21]证实ALDH1是包括NSCLC在内的多种肿瘤的CSCs标志物,且其高表达与患者临床预后密切相关。目前,已有研究团队利用荧光染料 Aldefluor,根据ALDH1在细胞中的不同荧光强度,检测分选出CSCs[15-16]。
CSCs异常增殖和分化的潜能与其所处的微环境密切相关。由于肿瘤细胞生长较快,血液供应相对不足,肿瘤组织易形成缺氧微环境。肿瘤细胞缺氧时,氧化磷酸化代谢途径受阻,线粒体内膜电子呼吸链传递异常,导致活性氧(reactive oxygen species,ROS)增多,不能被及时清除,而肿瘤细胞为适应缺氧环境,满足自身迅速生长的能量需求,其代谢过程重塑,主要通过大量ROS抑制脯氨酸羟化酶活性,阻断其对HIF-1的降解,导致HIF-1异常活化,从而调节相关靶基因及各种细胞信号通路以耐受缺氧,最终引起肿瘤细胞干性增强及放化疗抵抗[22-24]。本研究发现,与亲本细胞PC-9相比,耐药细胞PC-9-GR中HIF-1、ALDH1、VEGF蛋白与CSCs百分比均增高,提示吉非替尼长期诱导可使NSCLC细胞中HIF-1、ALDH1、VEGF蛋白高表达,导致CSCs大量富集,这可能是NSCLC吉非替尼获得性耐药产生的重要原因之一。
目前,有氧运动已成功应用于不同类型癌症的治疗阶段,对于减少发病率、控制和改善不适症状、提高患者的生理机能、改善患者的负性情绪和培养战胜癌症的信心有着显著的效果[25-26]。生理学方面,有氧运动可提高肿瘤患者心肺功能,促进血液循环,减轻肢体疼痛,缓解器官功能衰退;降低患者应激水平,提高抗氧化能力,改善机体免疫功能[27]。心理学方面,有氧运动可促进患者心理压力转移,提高自我掌控感,增强应对疾病的自信心及主观幸福感,进一步提高患者生活质量[28]。资料[12]显示,有氧运动可使ROS生成减少,上调内源性抗氧化酶如谷胱甘肽过氧化物酶和线粒体超氧化物歧化酶,加速HIF-1降解。同时,有氧运动可抑制HIF反应基因TGF-β、VEGF、IL-6、IGF等细胞因子的生成,调节多个信号通路,抑制肿瘤细胞干性,提高肿瘤患者生存率[13]。
裸鼠皮下荷瘤实验中,吉非替尼治疗及有氧运动均可降低裸鼠荷瘤能力,且二者存在协同作用;吉非替尼对裸鼠瘤体内HIF-1、ALDH1、VEGF蛋白表达及CSCs百分比无影响,而有氧运动可使上述指标降低,二者不存在交互作用;提示有氧运动可通过抑制HIF-1、ALDH1、VEGF表达及CSCs富集,抑制肿瘤恶性增殖。本研究结果表明在吉非替尼耐药的情况下,进行有效的有氧运动,可通过引起HIF-1、ALDH1、VEGF及CSCs减少,从而使肿瘤细胞重新对吉非替尼敏感,且有氧运动联合吉非替尼治疗可更有效地抑制肿瘤的恶性增殖。裸鼠移植瘤实验中,与对照组相比,实验组裸鼠成瘤能力显著降低,提示有氧运动可有效增强耐药瘤体对吉非替尼的应答效力,从而抑制其恶性增殖;且实验组裸鼠瘤体内HIF-1、ALDH1、VEGF蛋白的表达及CSCs百分比均显著降低,提示有氧运动可通过抑制耐药细胞HIF-1、ALDH1及VEGF表达,导致CSCs减少,从而使耐药瘤体重新对吉非替尼敏感。由此可见,有氧运动可作为NSCLC治疗中的有效辅助措施。
综上所述,NSCLC吉非替尼获得性耐药的产生与药物引起CSCs大量富集密切相关,而合理有效的有氧运动对CSCs的抑制作用有助于增强耐药细胞对吉非替尼的应答效力。资料[2]显示,EGFR-TKIs激发耐药的主要分子机制有EGFR T790M突变、KRAS突变、c-MET扩增以及小细胞肺癌表型转化等。由于疾病的多样性和复杂性,有氧运动逆转EGFR-TKIs耐药的分子机制有待进一步探讨,但进行合理有效的有氧运动,对患者的临床治疗具有非常重要的意义。因动物实验周期短,裸鼠未出现恶病质状态,可更好地执行运动方案,而临床患者各方面功能状态较差,需制定个性化运动方案。

