不同地区花色腐乳真菌多样性分析
赵恒,陈富安,赵慧君,王玉荣,郭壮,张振东*
(1.湖北文理学院 湖北省食品配料工程技术研究中心,湖北 襄阳 441053;2.谷城农韵土特产品开发有限公司,湖北 襄阳 441053)
腐乳也被称为“东方奶酪”,是一种发酵豆制品,其历史最早可追溯到三国时期[1]。由于腐乳独特的风味与营养价值,通常被用作日常调味,每年在中国的产量可达300万吨[2]。根据制作腐乳所使用的微生物类型,腐乳可被分为毛霉型(包括根霉、毛霉)腐乳、细菌型腐乳(用芽孢杆菌或者微球菌发酵)、自然发酵型腐乳(发酵过程中未人工接种特定的微生物)。根据腐乳的色泽与风味,又可以将腐乳分为红方腐乳、青方腐乳、白方腐乳、酱腐乳、花色腐乳等[3]。
近年来,由于高通量测序技术的成本低、通量高、可以快速产生大量的数据,且可以避免培养条件的限制,能客观地反映微生物多样性,被用于分析微生物的群落结构,该技术也被引入对腐乳的研究[4]。类似其他类型的发酵食品[5-7],腐乳中常见的微生物有霉菌(包括毛霉、根霉等)、酵母(包括裂殖酵母、假丝酵母、毕赤酵母),细菌有乳球菌属、四球菌属、链球菌属、肠杆菌属、不动杆菌属和短杆菌属[8-9]。这些微生物可以通过代谢作用,代谢蛋白质、氨基酸、肽、有机酸、酯类等产生呈味小分子化合物。然而,不同地区制作腐乳的工艺与加工环境的差异,使得不同地区与不同类型的腐乳微生物多样性差别均较大。不同腐乳的微生物差异大多与化学特征相关联,例如盐度、乙醇含量和一些营养元素含量,而微生物的代谢作用又能影响腐乳化学成分的组成,导致不同腐乳的风味差异。
湖北襄阳市茨河镇与恩施州利川地区出产的花色腐乳风味较好,远近闻名,可能蕴含独特的菌群结构,然而对其研究尚少。因此,本研究以采集到的利川和茨河花色腐乳为研究对象,基于高通量测序技术分析这两个地区腐乳的菌群结构,并对它们的菌群进行比较。
1 材料与方法
1.1 材料与试剂
花色腐乳:茨河与利川花色腐乳,分别采集自湖北省襄阳市谷城市茨河镇和恩施市利川县。
试剂:引物SSU0817F/SSU1196:武汉天一辉远生物科技有限公司;dNTPs Mix、PrimeSTAR HS DNA Polymerase、5×PrimeSTAR Buffer:宝生物工程(大连)有限公司;E.Z.N.A.®土壤DNA试剂盒:美国Omega Bio-Tek公司。
1.2 主要仪器与设备
Vetiri型梯度基因扩增仪 美国ABI公司;WD-9413B型化学发光凝胶成像系统、DYY-6C型电泳仪 北京六一生物科技有限公司;ND-2000C型微量紫外分光光度计 美国Nano Drop公司。
1.3 方法
1.3.1 样品采集
样品分别采集于湖北省襄阳市谷城市茨河镇和恩施市利川县,且不同编号样品采集于不同商家或者农户家中。首先取无菌瓶装入无异味的花色腐乳样品,然后放入样品箱中,迅速带回微生物实验室备用。茨河腐乳14个样品编号记录为CH1~CH14,利川腐乳8个样品编号为LC1~LC8。
1.3.2 腐乳样品DNA提取、PCR扩增与高通量测序
腐乳样品的DNA提取使用E.Z.N.A.®土壤DNA试剂盒,按照说明书进行。将提取到的DNA使用琼脂糖凝胶电泳检测合格后,参照Li等[10]的方法,以真菌18S核糖体小亚基RNA(small subunit ribosomal RNA,SSU rRNA)817~1196区带有barcode的通用引物SSU0817F与SSU1196进行PCR扩增。PCR程序与体系均参照Li等的方法进行。PCR产物使用琼脂糖凝胶电泳仪与微量紫外分光光度计检测,然后在上海美吉生物医药科技有限公司基于Illumina MiSeq第二代测序平台完成测序。
1.3.3 生物信息学分析
将MiSeq测序平台产生的原始序列基于Qiime 1.9.2平台进行生物信息学分析[11],大致步骤如下:首先去掉低质量序列,使用FLASH将双末端序列基于重叠区域合并,去掉接头;按照97%的相似度使用UCLUST聚类产生分类操作单元(operational taxonomic unit,OTU),使用UCHIME去掉嵌合体,使用RDP分类器基于Silva的18S 核糖体RNA数据库对OTU的代表性序列进行分类鉴定。使用QIIME平台自带程序计算腐乳样品的α与β多样性。
1.3.4 统计分析与作图
使用非参数克鲁斯卡尔-沃利斯检验(Kruskal-Wallis test)对组件差异进行检验;使用R包vegan v2.5-7(https://cran.r-project.org/web/packages/vegan/index.html)进行非度量多维尺度分析(non-metric multidimensional scaling,NMDS)分析与非参数多元方差分析(PerMANOVA)分析;使用R包randomForest v4.6-14进行随机森林分析(https://cran.r-project.org/web/packages/randomForest/)。文中所有图使用Origin V8.5或者R包ggplot2完成。
2 结果与分析
2.1 腐乳微生物多样性分析
本研究共采集了22个腐乳样品,分别来自茨河镇(n=14)和利川市(n=8),以真菌的18S序列为靶点,进行MiSeq测序,将低质量序列去除,去掉嵌合体后,共得到630条和234条序列,茨河的腐乳样品平均27585条,而来自利川的腐乳平均每个样品30504.88条序列(见表1)。经过分类操作单元(operational taxonomic unit,OTU)聚类后,茨河腐乳样品平均得到623个OTU,而利川腐乳样品平均得到286个OTU。然后选择每个OTU的序列进行鉴定,两个地区的腐乳样品得到平均的分类单元相近,结果见表1。

表1 茨河与利川花色腐乳样品的序列与微生物多样性
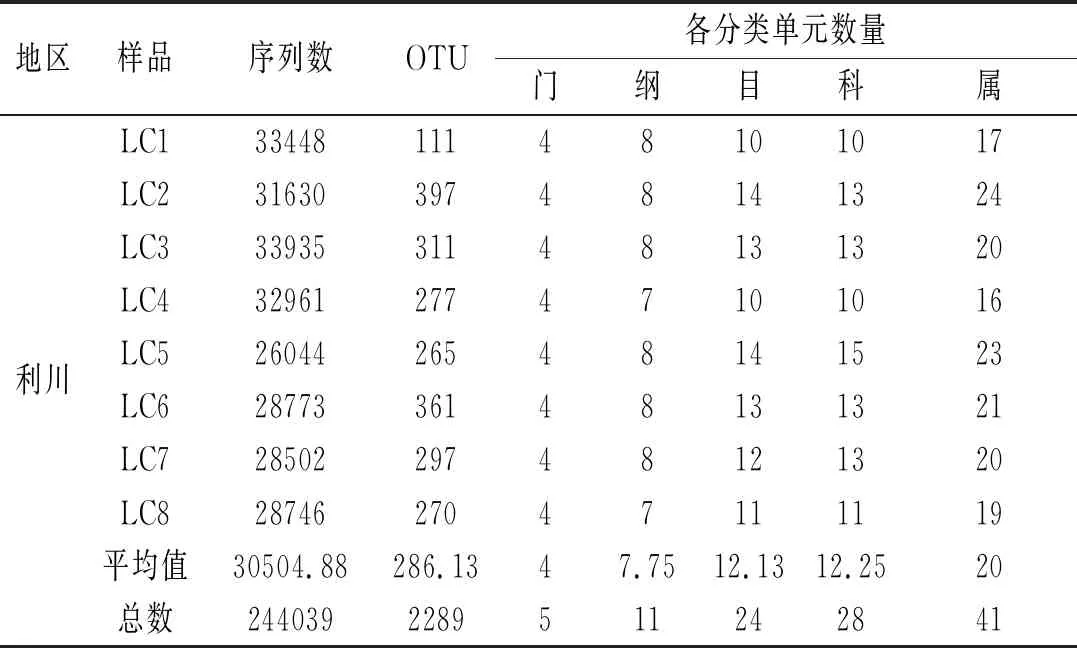
续 表
对来自襄阳市茨河镇和恩施市利川县的腐乳样品α多样性进行了计算,当测序深度为20010条时,香浓曲线变得平缓,表明当前样品的测序数量能够反映实际样品菌群结构。两个地区腐乳样品的α多样性指数的分析结果见图1。
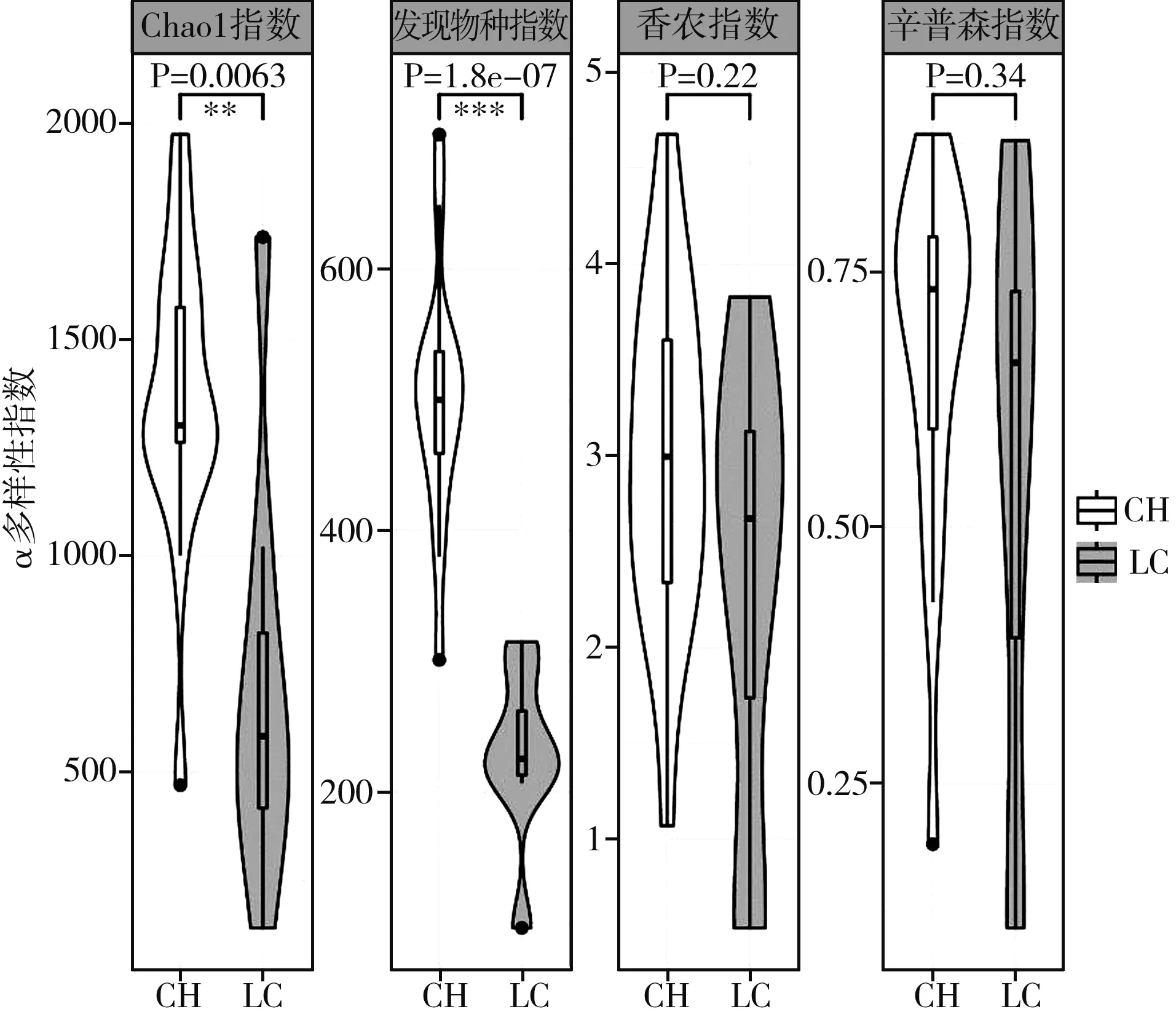
图1 茨河和利川两地腐乳α多样性
由图1可知,采集自茨河的腐乳样品的Chao1指数和发现物种指数显著高于利川腐乳样品,而它们之间的香农指数和辛普森指数没有显著差异,表明这两个地区的腐乳真菌多样性存在差异,茨河腐乳物种丰富度较高,后续进一步通过菌群分析来明确其差异的真菌物种组成。
2.2 腐乳群体结构分析
将相对含量大于1%的分类单元定义为优势分类单元。对两地的腐乳样品真菌分析见图2。采集自茨河的样品共有3个优势菌门,分别为子囊菌门(Ascomycota,82.75%)、担子菌门(Basidiomycota,10.63%)、毛霉菌亚门(Mucoromycotina,5.76%),而利川腐乳样品共有2个优势菌门,分别是子囊菌门(90.34%)、担子菌门(8.78%),由此可知子囊菌门是茨河与利川腐乳样品共有的绝对优势菌门。使用克鲁斯卡尔-沃利斯检验(Kruskal-Wallis test),结果表明,茨河与利川腐乳样品间的这3个菌门的相对含量差异均不显著(P>0.05)。

图2 茨河与利川花色腐乳优势门组成
对两个地区的花色腐乳进行统计分析,发现来自茨河的腐乳样品共有9个优势属:Galactomyces(37.80%)、毕赤酵母属 (Pichia,25.32%)、德巴利酵母属(Debaryomyces,6.45%)、巴克斯霉属(Backusella,5.57%)、丝孢酵母属(Trichosporon,5.32%)、假丝酵母属(Candida,4.70%)、Guehomyces(4.63%)、威克汉姆酵母属(Wickerhamomyces,4.06%)、镰刀菌属(Fusarium,1.14%);而利川腐乳样品优势属为Galactomyces(31.25%)、德巴利酵母属(Debaryomyces,28.20%)、毕赤酵母属(Pichia,10.95%)、威克汉姆酵母属(Wickerhamomyces,9.53%)、丝孢酵母属(Trichosporon,5.02%)、曲霉属(Aspergillus,3.96%)、节担菌属(Wallemia,2.83%)、镰刀菌属(Fusarium,1.78%)、假丝酵母属(Candida,1.41%)。

图3 茨河与利川花色腐乳优势属组成
尽管茨河和利川花色腐乳都有9个优势菌属,但是它们的优势属组成并不相同,茨河腐乳与利川腐乳相比少了节担菌属,而利川腐乳与茨河腐乳相比少了巴克斯霉属。真菌是腐乳发酵制作过程中起主要作用的微生物菌种之一[12],然而目前报道较少。石黎琳等[13]对重庆地区的腐乳分析表明,腐乳成品中优势真菌为子囊菌门(Ascomycota),优势真菌属为链格孢属(Alternaria)和赤霉菌属。另一项针对毛霉型腐乳的研究显示[14],假丝酵母属、毛霉属、曲霉属、丝孢酵母属和红曲霉属为优势真菌。红腐乳成品中优势真菌为红曲霉属和曲霉属[15]。湖南白溪腐乳的优势真菌为地霉菌属(Geotrichum)和被孢霉属(Mortierella)。由此可见,不同地区及类型的腐乳中真菌类群差异很大,而花色腐乳与这些腐乳相比,优势真菌的数量更多,菌群组成更为多样,且值得注意的是,花色腐乳中相对含量最高的优势属为Galactomyces,在其他腐乳中并未报道过。
Galactomyces在利川与襄阳的花色腐乳中都是主要真菌。该属一些真菌如Galactomycescandidum,Galactomycesgeotrichum等是常见的腐败霉菌,能在牛乳和奶酪等乳制品及一些酿造酒中被分离到,因此这些种能在较低的pH和水分活度的环境中生存,也有研究将这种霉菌与其他真菌一起使用来制作奶酪。原因是该菌能降解奶酪中的苦味肽,减少奶酪的苦味,还能形成大量的风味物质[16-17]和一些营养物质如维生素B2、麦角甾醇和海藻糖[18],因此该属一些种是食品发酵的重要菌种。然而,该菌也能引起食品的腐败和植物病害,是常见的腐败菌[19]。因此,我们推测,Galactomyces可能含有丰富的蛋白酶和肽酶,能适应腐乳这种较低水分活度的环境,并可能对腐乳特殊风味的产生具有重要的作用,遗憾的是目前针对该菌对富含植物蛋白的发酵食品的作用研究尚少。
相对含量排在Galactomyces之后的真菌是毕赤酵母属和德巴利酵母属,在利川与茨河花色腐乳中的相对含量都超过了5%。德巴利酵母和毕赤酵母通常能从食品、土壤、水、植物和一些感染的临床样本中分离到。毕赤酵母属和德巴利酵母属都属于油脂酵母,能在细胞内积累油脂,少数德巴利酵母能在细胞内积累自身生物量20%~70%的油脂,因此能耐受高渗环境,如在含有高达4 mol/L氯化钠和5%葡萄糖的培养基和食物中生长[20-21]。腐乳中常见的毕赤酵母属、德巴利酵母和威克汉姆酵母属也是亚洲和非洲谷物发酵食品中起到主要作用的微生物类群,有助于改善不含酒精类发酵食品的滋味、风味、酸度、消化性和质构[22]。
基于非参数的克鲁斯卡尔-沃利斯检验(Kruskal-Wallis test)对这两个地区的优势真菌属的相对含量进行了统计分析,结果表明,茨河与利川两个地区的腐乳样品间3个菌属的相对含量存在显著差异,它们分别是曲霉属、巴克斯霉属和威克汉姆酵母属。茨河腐乳中的曲霉属、威克汉姆酵母属的相对含量显著低于利川腐乳,而茨河腐乳中的巴克斯霉属相对含量则极显著高于利川腐乳样品。我们基于两个地区的真菌OTU表,利用Bray-Curtis距离矩阵进一步做了非度量多维尺度分析(non-metric multidimensional scaling,NMDS)分析。
2.3 茨河与利川腐乳菌群差异分析
由茨河与利川的物种多样性与菌群组成分析可知,这两个地区的腐乳菌群在属水平上存在差异,进一步对茨河与利川腐乳样品基于OTU相对含量进行非度量多维尺度分析,结果见图4。

图4 茨河与利川花色腐乳NMDS(a)与随机森林分析(b)
由图4中a可知,茨河腐乳样品与利川腐乳样品呈现分离的趋势,且没有交集产生,进一步证实了两地腐乳菌群结构的差异。同时通过非参数多元方差分析(PerMANOVA)证实了茨河与利川腐乳样品菌群组成差异显著(P<0.05)。由图4中b可知,使用随机森林分析寻找属水平上导致茨河地区与利川地区菌群差异的标志物种。结果显示,导致两个地区腐乳样品菌群差异的主要菌属有巴克斯霉属、曲霉属和威克汉姆酵母属。前面的统计分析显示茨河与利川腐乳样品间这3个真菌属的相对含量存在差异。结合图4中b,它们的贡献度中巴克斯霉属最高,曲霉属次之,紧接着是威克汉姆酵母属。
巴克斯霉属在进化关系上与毛霉相近,该属目前有14种水平的分类单元,其分离来源多数为土壤、落叶和食草动物的粪便[23-24]。值得注意的是,本研究首次从发酵食品腐乳中发现大量存在这种菌,该属微生物多数能以葡萄糖为唯一碳源进行生长,但仅部分种能利用蔗糖。腐乳富含植物蛋白,然而目前尚没有关于巴克斯霉对于蛋白质、多肽和氨基酸的代谢研究,也没有该菌对食品品质的研究。
3 结论
襄阳市茨河与利川花色腐乳的真菌多样性具有显著差异,它们的共同优势菌门为子囊菌门和担子菌门,共同优势属为Galactomyces、毕赤酵母属、德巴利酵母属、丝孢酵母属、假丝酵母属、Guehomyces、威克汉姆酵母属和镰刀菌属。对茨河与利川腐乳菌群差异贡献度最高的3个真菌属为巴克斯霉属、曲霉属和威克汉姆酵母属,可能是两者风味差异的重要因素。

