载脂蛋白B与非高密度脂蛋白胆固醇在ASCVD防控中的应用价值
安海英 涂建成
(武汉大学中南医院检验科,湖北 武汉 430071)
动脉粥样硬化性心血管疾病(atherosclerotic cardiovascular disease,ASCVD)是心血管疾病(cardiovascular disease,CVD)的重要亚型,虽然近年来在改善其预后方面有了明显进步,但其仍是造成世界范围内人口死亡的主要原因之一[1]。病理生理学、流行病学、遗传学以及药物干预等层面的研究公认低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)是ASCVD的关键危险因素,且干预LDL-C可使ASCVD的临床防控显著获益,因此其成为众多血脂异常管理指南中ASCVD的首要防控靶标[2-3]。然而,有研究[4]发现,仍有部分LDL-C水平正常的人群发生主要不良心血管事件(major adverse cardiovascular event,MACE)。此外,有研究[5]发现用非高密度脂蛋白胆固醇(non-high-density lipoprotein cholesterol,non-HDL-C)和载脂蛋白B(apolipoprotein B,ApoB)作为ASCVD的风险预测指标,显示出较高的预测价值并且可降低LDL-C无法估计的残余心血管风险,因而部分血脂异常防控指南中推荐其作为替代或补充LDL-C的靶标。为回答non-HDL-C和ApoB能否替代LDL-C,以及non-HDL-C和ApoB哪个更适合作为次要指标,本综述从病理生理机制、流行病学、药物干预三方面展开论述,并总结和讨论其在ASCVD防控中的机遇和挑战。
1 病理生理机制研究
ASCVD是指由于动脉粥样硬化所导致的急性或慢性血管缺血性病变,主要包括冠心病和缺血性卒中等[6]。在动脉粥样硬化形成过程中,直径<70 nm且含ApoB的脂蛋白跨过内皮屏障后被滞留在动脉壁的血管内膜中造成脂质沉积,并与炎症和免疫反应一起导致动脉粥样硬化斑块的发生与发展[7]。可见,ASCVD的风险与进入并被困在动脉壁内的含ApoB的脂蛋白颗粒数量密切相关。在大多数个体空腹状态下,血液循环中90%含ApoB的脂蛋白都是由低密度脂蛋白(low-density lipoprotein,LDL)颗粒构成,但这些颗粒是大小和组成各不相同的异质性颗粒,因此难以开发特定的LDL颗粒检测方法[8]。由于LDL是富含胆固醇的脂蛋白,于是有学者猜想脂蛋白中的胆固醇与ASCVD密切相关。经过长期的遗传学、生物学、循证医学以及流行病学的研究探索,学者们发现胆固醇质量是动脉粥样硬化的关键危险因素之一,能显著影响ASCVD患者的发病率和死亡率,因此提出了动脉粥样硬化发病机制的“胆固醇假说”,且将LDL-C作为ASCVD风险评估的基石[9]。然而,近年来随着研究的不断进展,发现脂蛋白a[Lipoprotein(a),Lp(a)]、极低密度脂蛋白(very low-density lipoprotein,VLDL)、中间密度脂蛋白(intermediate-density lipoprotein,IDL)、乳糜微粒(chylomicron,CM)及其残粒在动脉粥样硬化的形成中也发挥着不小的作用[10-11]。美国国家胆固醇教育计划[12]因而在2001年首次提出non-HDL-C的概念,将其定义为除高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)之外的所有脂蛋白胆固醇,包含Lp(a)、VLDL、IDL、LDL、CM及其残粒中的总胆固醇(total cholesterol,TC)含量,是一种比LDL-C更广泛的促动脉粥样硬化脂蛋白胆固醇含量的评测指标,在病理生理学角度要优于LDL-C。尽管non-HDL-C包含对残余脂蛋白胆固醇的评估,但因只有包裹在含ApoB的脂蛋白中的胆固醇才能进入动脉壁;其次,由于每个脂蛋白中胆固醇质量是可变的,因此沉积在动脉壁内的胆固醇质量取决于被捕获在动脉壁内的含ApoB颗粒的脂蛋白数量,即导致动脉粥样硬化的脂蛋白中的胆固醇含量与ASCVD的相关性远不如脂蛋白颗粒的数量,于是寻找能反映脂蛋白颗粒数量的指标显得十分重要[13]。随着研究的不断深入,学者们发现了能反映导致ASCVD的总脂蛋白颗粒数量的指标ApoB[14]。有研究[13]发现,ApoB存在于除HDL之外的所有脂蛋白表面,且每一分子脂蛋白中仅含有一分子ApoB(见图1)。ApoB主要以ApoB48和ApoB100两种形式存在,在肠上皮细胞中合成的ApoB48是CM和CM残粒的结构蛋白,在肝细胞中合成的ApoB100则是VLDL、IDL、LDL、Lp(a)的结构蛋白,表明ApoB能反映导致ASCVD的总脂蛋白颗粒数量,在病理生理学角度是最准确的ASCVD风险指标,可直接替代non-HDL-C和LDL-C[13,15]。
2 流行病学研究
为期26个月随访急性冠脉综合征(acute coronary syndrome,ACS)患者的研究[16]发现,当LDL-C平均水平从1.80 mmol/L降至0.78 mmol/L时,MACE的风险可降低15%。此外,LDL-C>1.80 mmol/L的ACS患者,LDL-C水平降低至0.60~1.30 mmol/L时也会降低MACE风险[17]。并且,以LDL-C<0.39 mmol/L作为ACS患者降脂治疗的分界值,患者的MACE风险会显著降低[18]。其次,有研究[19]发现,糖尿病患者发生ACS后,控制LDL-C水平会大幅度地降低患者发生MACE的风险。Egan等[20]研究发现LDL-C水平与ASCVD事件的发生呈线性相关,其水平每降低1 mmol/L,可使ASCVD事件下降22%。可见,目前大量流行病学证据支持LDL-C在ASCVD风险防控方面毋庸置疑的临床价值。尽管有些流行病学研究[21-22]发现在高甘油三酯(triglyceride,TG)、2型糖尿病(type 2 diabetes mellitus,T2DM)、代谢综合征(metabolic syndrome,MS)等特殊人群中,ApoB和non-HDL-C都比LDL-C具有更强的风险预测能力。然而,目前并无充足的流行病学证据证实ApoB或non-HDL-C能带来优于LDL-C的临床效益,因此LDL-C在众多指南中仍占据ASCVD风险防控的主导地位,但指南也推荐在特殊人群中应使用non-HDL-C或ApoB作为替代或次要防控靶标。
2.1 高TG人群
大型流行病学研究[22-23]发现,中国成年人空腹血清中表现为高TG的人群为13.8%,提示高TG人群应作为ASCVD防控的重要群体,然而LDL-C在此类群体中的ASCVD防控作用似乎并不理想。LDL-C虽然可通过直接测量或公式计算得出结果,但直接测量LDL-C在严重的高TG(>5 mmol/L)人群中并不可靠[24]。此外,有研究[5]还发现当采取目前使用最广泛的Friedewald方程“(TC-HDL-C-TG/2.2)mmol/L”计算LDL-C时,其结果在TG处于正常取值范围的人群中很接近真实值,然而在TG>4.5 mmol/L的人群中却与真实值相距甚远。可见,在高TG人群中使用LDL-C会错误估计ASCVD的发生风险,错失及时降低风险的时机。与LDL-C相比,non-HDL-C的Friedewald方程“(TC-HDL-C)mmol/L”中并不涉及TG,似乎并不会受到高TG的影响。然而,有研究[22]发现non-HDL-C中包含了VLDL、IDL、CM等富含TG的脂蛋白的胆固醇含量,且这些脂蛋白胆固醇的促动脉粥样硬化能力与LDL-C有差异,但non-HDL-C却无法区分以至于误将其与LDL-C等同,在严重的高TG人群中会对ASCVD风险评估的准确性造成较大影响,以至于其并不适合在高TG人群中替代LDL-C,但轻至中度高TG(2~10 mmol/L)人群中non-HDL-C受到影响较小,准确性高于LDL-C,可替代LDL-C或作为LDL-C达标的次要靶标。此外,有研究[22,25]还发现轻至中度高TG人群中,ApoB有助于识别LDL-C和non-HDL-C都不能反映的小而密集的LDL颗粒,提示ApoB优于non-HDL-C和LDL-C,应作为轻至中度高TG人群的首选ASCVD风险指标。
2.2 T2DM人群
CVD是T2DM患者的主要并发症之一,治疗T2DM患者CVD并发症的费用远高于单独糖尿病治疗,因此有效预测T2DM患者CVD的风险,并对高危人群采取有效的前期干预将极大地减轻社会医疗的经济负担[26]。有研究[27]发现,即使把LDL-C控制在目标范围内,相当一部分的T2DM患者仍会发生CVD事件,其中部分患者还出现ApoB或non-HDL-C增高,表明仅针对LDL-C可能会低估T2DM患者的CVD风险,进而对部分患者错失降低风险的有利时机,ApoB和non-HDL-C则可用于补充评估LDL-C无法估计的残余风险。还有研究[28]发现在T2DM患者中,ApoB是比non-HDL-C更强的冠心病风险预测因子(P<0.05),且这二者都强于单独用LDL-C,提示二者都有潜力替代LDL-C。另一项研究[29]还发现,LDL-C水平升高的T2DM患者中,有部分患者其ApoB水平正常且最终不会发展为ASCVD,表明ApoB比LDL-C对T2DM患者的ASCVD风险预测可能更准确。可见,ApoB和non-HDL-C,尤其是前者,可替代LDL-C作为T2DM患者ASCVD风险的首选指标。
2.3 MS人群
MS被世界卫生组织(WHO)定义为以腹部肥胖、胰岛素抵抗、高血压和高脂血症为特征的病理状态,这些病理状态都是ASCVD的独立危险因素,可见MS是一种众多ASCVD风险因素集合的疾病[30]。危险因素的组合会提高ASCVD的发病率和死亡率,因此临床医生应更加重视MS人群的ASCVD防控。有研究[31]发现MS的发生率在non-HDL-C正常和异常的人群中存在显著差异,提示non-HDL-C可能是防控MS人群ASCVD风险的靶点。Elhadad等[32]通过全面的生物信息学分析发现ApoB与MS存在因果关系,并认为ApoB有潜力作为MS人群的ASCVD标志物和治疗靶点。更重要的是,进一步的研究发现在MS人群中,ApoB比LDL-C更能代表致动脉粥样硬化的脂质负担,进而实现对LDL-C正常或异常的MS人群的ASCVD风险再分层。此外,另一项研究[22]也表明对于MS人群,ApoB优于non-HDL-C,且二者都优于LDL-C。由上可见,对于MS人群,ApoB可取代LDL-C成为预测ASCVD风险的首要靶标或作为比non-HDL更优越的LDL-C补充靶标。
3 药物干预研究
尽管流行病学研究发现ApoB和non-HDL-C有良好的风险预测价值,但确定通过各种药物降低non-HDL-C和ApoB水平与控制ASCVD风险的相关关系是其能否应用到临床实践中最关键的一步。Robinson等[33]对他汀类药物、贝特类药物和烟酸的研究进行荟萃分析后发现,在他汀类药物和贝特类药物作用下,non-HDL-C降低幅度与心血管风险降低之间存在正相关关系,即non-HDL-C降低1%,冠心病相对风险降低1%。Khan等[34]在2018年进行了一项荟萃分析,纳入涉及33万余例患者的29项研究,结果显示使用上调LDL受体来清除ApoB的他汀类、依折麦布、前蛋白转化酶枯草溶菌素9等药物可减少MACE的发生。进一步研究[35-36]分别以ApoB和non-HDL-C作为指导降脂治疗的指标,在10年期间分别比LDL-C多预防了50万和30万起MACE,提示ApoB和non-HDL-C在指导现有药物干预方面优于LDL-C,特别是ApoB应取代LDL-C成为指导他汀类药物/依折麦布/前蛋白转化酶枯草溶菌素9疗法的主要指标。
4 机遇和挑战
随着对LDL-C、non-HDL-C和ApoB等血脂指标的认识,学者们通过不断的研究发现目前这些指标在ASCVD风险防控中面临的机遇和挑战(见表1)。
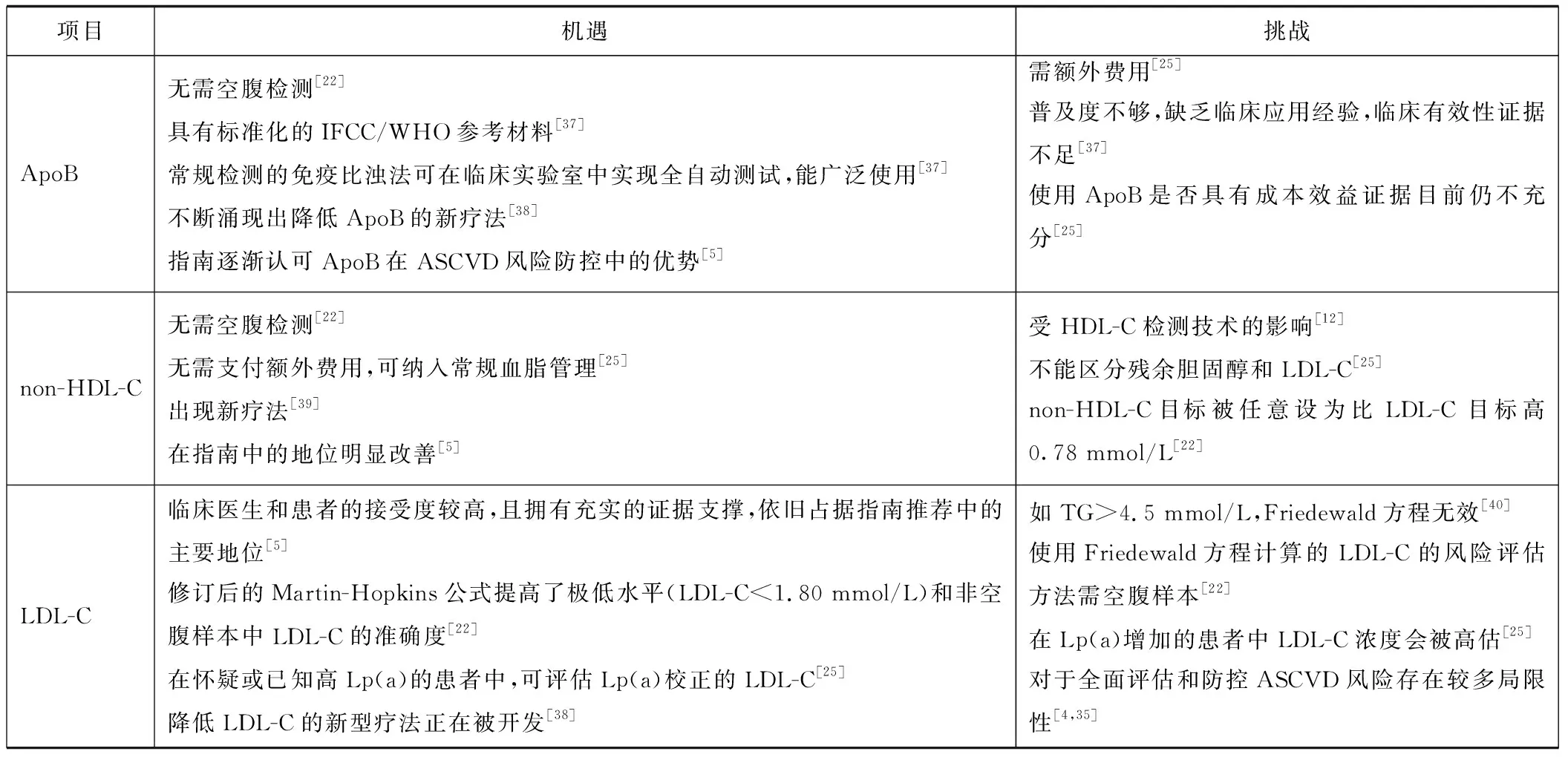
表1 LDL-C、non-HDL-C和ApoB的机遇和挑战
5 总结与展望
科学的进步并不是一蹴而就的,而是一个渐进的过程。尽管ApoB和non-HDL-C具有良好的应用前景,但由于目前尚无能有效降低Lp(a)的相关药物,加之现有检测手段、临床医生和患者接受度的限制,导致ApoB和non-HDL-C的检测未能普遍开展,在常规人群中仍旧不能代替LDL-C,但对于高TG、T2DM、MS等特殊人群,ApoB和non-HDL-C可替代LDL-C,且应首选ApoB。此外,在LDL-C作为首要风险防控靶标的人群中,ApoB作为次要靶标的临床意义要优于non-HDL-C。相信未来随着Lp(a)、ApoB以及non-HDL-C等特效药的问世以及相关检测手段的优化,ApoB和non-HDL-C在ASCVD防控中的应用会逐渐普及。当然,本文旨在告知二者的临床应用价值而非干预医生的临床决策,最终需临床医生综合考虑每个人的实际情况,采用合适的防控指标。建议在检测技术有待加强且患者经济条件不太乐观的基层医院将non-HDL纳入常规血脂谱。在技术过硬的三甲医院,可结合患者自身的意愿选择多元化指标。由此可见,血脂指标未来的研究重点应放在添加新的风险标志物后的临床获益以及探索和评估个性化精准指标,避免不准确的风险评估导致错失高危人群的有效治疗或低风险人群的过度治疗。

