三突变型缺氧诱导因子-1α对老年小鼠缺血后肢的促血管生成作用
谢佳佳 廖文君 吴碧君 唐其东 李瑜辉
(1.广东省第二人民医院心内科,广东 广州 510317;2.广东省第二人民医院超声科,广东 广州 510317)
缺氧诱导因子-1(hypoxia-inducible factor-1,HIF-1)是细胞对低氧作出适应性反应的关键性转录因子,在低氧状态下可稳定表达,调控血管内皮生长因子、血管生成素-1等上百种靶基因的转录而促进这些基因表达,诱导生理功能完整的新生血管,促进侧支血管的灌注,在动脉粥样硬化性心血管疾病等涉及治疗性血管生成的疾病研究中,被认为是最具有临床治疗前景的基因[1-3]。HIF-1由氧调节亚单位HIF-1α和组成性表达的亚单位HIF-1β构成,HIF-1α受低氧诱导,决定HIF-1的活性。然而,在常氧状态下,HIF-1α容易被降解,而且其转录活性受到抑制[4-5],通过对HIF-1α的Pro402、Pro564位点进行定点突变可避免HIF-1α的蛋白降解,而对其Asn803位点进行定点突变可增强其转录活性[6]。既往研究显示Pro402、Pro564、Asn803三位点突变型HIF-1α可有效促进小鼠或大白兔缺血后肢血管生成[7-8],然而,临床上发生下肢缺血的多为老年人,且常合并有高血压、糖尿病、血脂异常等动脉硬化危险因素,自身修复能力差[9-10],在自身修复能力较强的幼年或成年动物模型中评价其促血管生成效应并不能很好地模拟临床情况。为更好地模拟临床情况,本研究将构建老年小鼠后肢缺血模型并利用超声灌注成像、运动功能评价及免疫荧光检查等方法进一步评价三突变型HIF-1α的促血管生成效应。
1 材料与方法
1.1 主要试剂和仪器
六氟化硫超声微泡(声诺维,Bracco,瑞士),生物素标记的Bandeiraea Simplicifolia-1(BS-1)凝集素(Sigma,德国),兔抗人多克隆α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)(Abcam,英国),FITC标记的亲和素(Molecular Probes,美国),Cy3标记的羊抗兔二抗(Abcam,英国)、Sequoia 512超声心动图仪(Siemens,德国),MCE图像分析软件(Cardiovascular Division,University of Virginia Medical Center,美国)。
1.2 动物模型制备及基因转染
昆明小鼠24只,18~20月龄,雄性,30~40 g。实验小鼠行麻醉后仰卧位四肢固定于鼠板上,双侧后肢及腹股沟区备皮,在左侧腹股沟部位切开皮肤后钝性分离并切断股动脉及其分支血管[11],模型制备后,将实验小鼠随机等分为3组:腺病毒包裹的β-半乳糖苷酶基因(Ad-LacZ)组,腺病毒包裹的Pro402、Pro564 双位点突变型HIF-1α基因(Ad-DM)组,腺病毒包裹的Pro402、Pro564、Asn803三位点突变型HIF-1α基因(Ad-TM)组,分别经内收肌多点注射溶于0.2 mL生理盐水的Ad-LacZ、Ad-DM或Ad-TM各4×108OPU。
1.3 对比超声灌注成像[12]
应用对比超声灌注成像评价小鼠术前,术后0、7、14、21、28 d缺血后肢骨骼肌血流灌注情况(缺血后肢/对侧非缺血后肢)。小鼠麻醉并仰卧位四肢固定于鼠板上,尾静脉插管用于注射超声微泡。固定超声探头(17L5)于小鼠双侧后肢上,调整探头位置获得良好后肢显像后保持在整个实验过程中不变,超声造影采用二次谐波成像技术,探头发射频率为7.0 MHz,机械指数为0.18,超声发射间隔时间设定为200 ms,仪器的各项参数在整个实验过程中保持不变。由尾静脉持续注射微泡(5×106个/min),待骨骼肌充盈达最大显影强度后立即给予高机械指数2~3 s破坏微泡,采集本底图像后,持续超声造影至骨骼肌达最大超声显影。全部声学造影图像存于CD盘,以备脱机分析。
1.4 造影图像血流情况分析
应用MCE图像分析软件对超声灌注成像进行定量分析,选择造影前的1帧图像作为本底图像,每个时间间隔中选取1帧造影图像,分别勾画出骨骼肌感兴趣区。感兴趣区勾画完毕后,首先由程序自动对所选择的图像进行排列和对齐,然后再逐一回放每帧图像,在自动对图基础上手工对齐不满意的图像。根据每个兴趣区各时间点的平均视频强度扣除图像本底相应部位的视频强度,程序自动绘出不同区域的触发间隔-声强度曲线,并给出最大微泡数量(A值)、局部填充速度(β值)和A×β值。后肢骨骼肌蓄积的A值反映的是局部骨骼肌微血管密度,而β值反映的是局部骨骼肌的血流速度,A×β值反映了局部骨骼肌的血流量;将缺血后肢骨骼肌的A×β值和对侧非缺血后肢骨骼肌的A×β值相比得到缺血后肢骨骼肌的血流灌注比值。
1.5 运动功能评价
术后28 d,利用运动评分评价各组缺血后肢的运动功能,将缺血后肢的运动功能分为1~4分,1分:仅可使用腿活动;2分:可使用脚活动;3分:脚活动不受限,脚趾活动部分受限;4分:活动不受限制[13]。
1.6 免疫荧光检查
术后28 d超声灌注成像结束后,立即处死小鼠并取缺血后肢骨骼肌行BS-1凝集素和α-SMA免疫荧光染色分别标记微血管和小动脉。制备5 μm冰冻切片,按操作说明书孵育生物素化标记的BS-1凝集素及FITC标记的亲和素或α-SMA及Cy3标记的羊抗兔二抗,最后封片并在显微镜下观察、拍照。每组随机挑选5个不相互重叠的视野,计算每个视野的微血管、小动脉及肌纤维个数,用微血管个数/肌纤维个数表示微血管密度,用小动脉个数/高倍视野表示小动脉密度。
1.7 统计学分析
2 结果
2.1 对比超声灌注成像
前双下肢血流量基本相等。术后0 d,缺血后肢的血流量在Ad-LacZ组、Ad-DM组和Ad-TM组分别为对侧非缺血后肢血流量的(15.1±4.2)%、(16.3±3.7)%和(15.5±3.4)%,三组之间差异无统计学意义(P=0.811)。随时间的推移,缺血后肢的血流均有所恢复,但Ad-TM组的血流恢复速度明显快于其他两组。术后28 d,Ad-TM组中缺血后肢的血流量达到对侧非缺血后肢血流量的(67.4±8.1)%,较Ad-LacZ组的(33.2±5.2)%和Ad-DM组的(48.4±5.3)%显著增加(P<0.001)(见图1)。
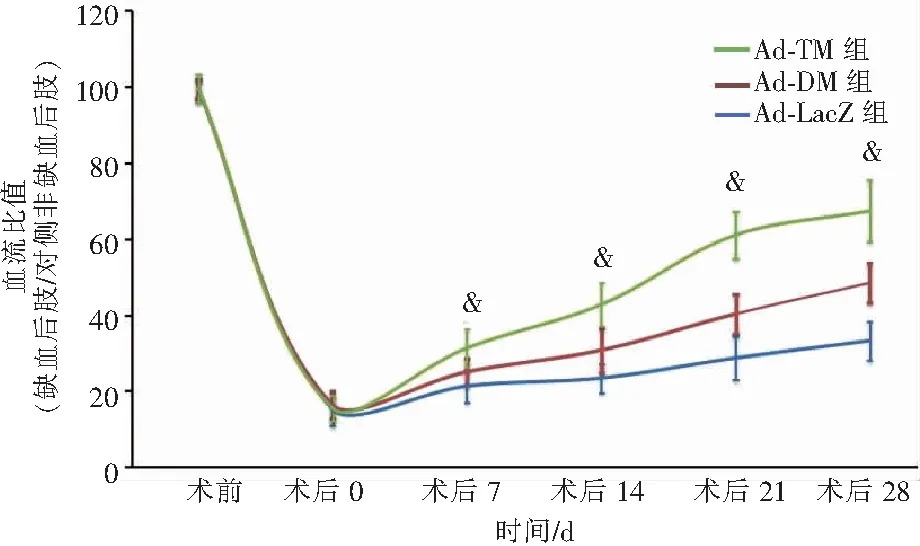
注:和其他组相比,&表示P<0.001。
2.2 运动功能评价
术后28 d,Ad-TM组的运动评分(3.4±0.7)分较Ad-LacZ组的(1.8±0.6)分和Ad-DM组的(2.5±0.5)分显著增加(P=0.001)(见图2)。

注:和其他组相比,&表示P=0.001。
2.3 免疫荧光染色
术后28 d,Ad-TM组的微血管(绿色荧光标记)密度(3.1±0.6)较Ad-LacZ组的(1.6±0.4)和Ad-DM组的(2.0±0.5)显著增加(P<0.001)(见图3)。Ad-TM组的小动脉(红色荧光标记)密度(10.6±2.2)较Ad-LacZ组的(5.7±1.0)和Ad-DM组的(6.7±1.5)显著增加(P<0.001)(见图4)。

注:图A、B、C为不同治疗组缺血后肢微血管染色(绿色荧光)的显微镜下图片,标尺为50 μm;图D为微血管密度对比图。和其他组相比,&表示P<0.001。

注:图A、B、C为不同治疗组缺血后肢小动脉染色(红色荧光)的显微镜下图片,标尺为50 μm;图D为小动脉密度对比图。和其他组相比,&表示P<0.001。
3 讨论
随着人们生活水平的不断提高,饮食结构和生活方式的改变,以及社会人口老龄化趋势等因素,糖尿病足、下肢动脉硬化闭塞症、血栓闭塞性脉管炎等慢性下肢缺血性疾病的发病率也与日俱增。常规的药物、血管旁路移植术或腔内介入等治疗方法疗效欠佳,患者往往被迫行截肢(趾)手术,严重影响患者的生存及生活质量[14-15]。治疗性血管生成的出现,即通过人为地向局部组织输送血管生长因子基因或重组蛋白的方式促进局部缺血组织血管生成,改善组织缺血缺氧及患者预后,为缺血性心血管疾病的治疗提供了新的途径[16-17]。既往已成功构建了腺病毒包裹的不同位点突变型HIF-1α基因,并在体外及在体实验中证明了不同突变位点突变型HIF-1α基因的促血管生成效应[7-8]。然而,在既往的动物实验中,多采用幼年小鼠或大白兔后肢缺血模型作为研究对象,其自身修复能力强。而临床上发生慢性下肢缺血性疾病的通常为老年人,其血管生成能力随年龄增大而减弱,且常合并吸烟、高血压、血脂异常、糖尿病等动脉硬化危险因素,修复缺血和受损组织的能力明显减弱[18]。因此,仅在幼年小鼠或大白兔后肢缺血模型上评价突变型HIF-1α的促血管生成效应是不充分的,在更符合临床情况的老年小鼠后肢缺血模型中可更充分地评价它的治疗效果。
本研究通过结扎老年小鼠一侧后肢股动脉构建后肢缺血模型,模型构建后立即行超声灌注成像提示缺血后肢血流量仅为对侧非缺血后肢血流量的15%,提示后肢缺血模型构建成功,且3组之间的缺血程度相当。动态的超声灌注成像提示:随术后时间的推移,缺血后肢的血流灌注不断恢复。利用MCE软件分析超声灌注图像发现:A值和β值均随术后时间的推移而增加,这表明缺血后肢血流的恢复来源于局部微血管密度的增加以及局部血流速度的加快。
下面将进一步从病理学角度探讨其血流恢复的机制。在成年期,血管生成主要包括血管发生和小动脉生成[19]。血管发生是指从已存在的血管上,通过成熟血管内皮细胞增殖、游走,形成新的毛细血管网的过程。它是组织损伤、伤口愈合、组织缺氧等病理情况下的一种代偿反应。在成人缺血性心血管疾病和肿瘤的缺血缺氧组织中都会有血管数量的增多,低氧诱导的HIF-1α激活是血管发生的主要分子机制[20]。在本研究中,A值随术后时间的推移而增大,表明缺血后肢局部微血管密度增加,也说明血管发生在老年小鼠缺血后肢血流恢复中担当重要的角色[11]。且在本团队的研究中,血流灌注恢复更好的Ad-TM组其微血管密度明显高于其他两组,这表明Ad-TM可有效促进老年小鼠缺血后肢的血管发生。而小动脉生成是固有侧支循环生成的重要机制之一,当血管发生阻塞时,侧支血管血流速度加快,管腔切应力相应增加,侧支血管最终形成较大管径动脉,即侧支血管的生长[21]。侧支循环的形成可能是缺血下肢血流恢复的重要机制[22]。在本团队的研究中,β值随术后时间的推移而增大,这表明缺血后肢局部血流速度加快,也支持小动脉生成在小鼠缺血后肢血流的恢复中占据重要的地位[22]。虽然侧支循环的形成主要与局部血管的剪切应力相关,然而,炎症也参与侧支循环的形成[23]。HIF-1α能促进中性粒细胞、单核细胞等细胞的迁移、浸润和激活,介导炎症反应,从而促进侧支循环的形成[24]。而且Ad-TM组的小动脉密度明显高于其他两组,这表明Ad-TM可通过促进小动脉生成/侧支血管形成改善老年小鼠后肢缺血。本团队推测这可能是在Ad-TM组中,即使在常氧状态下,三突变型HIF-1α仍可避免被降解,且转录活性增强,大量激活下游血管内皮生长因子、血管生成素-1、血管生成素-2、胎盘生长因子、血小板衍生生长因子等血管生长因子的表达,促进血管内皮细胞增殖、迁移、浸润和激活,以及对内皮细胞、平滑肌细胞和周细胞的调节,从而促进血管发生和侧支血管形成的增加,促进缺血后肢血流恢复及运动功能改善,病理学上则表现为微血管及小动脉密度增加,这与既往的研究一致[2]。
综上所述,三突变型HIF-1α可通过血管发生和小动脉生成的机制有效地促进老年小鼠缺血后肢血管生成,改善缺血后肢的血流灌注及其运动功能。
当然,本研究也存在一定局限性,如未进一步探讨三突变型HIF-1α基因更好地促进缺血后肢血管生成的分子机制,这将在后续的研究中进一步探讨。