探讨恶性肿瘤患者血栓弹力图(TEG)以及常规凝血指标的变化
沈蓉
启东市人民医院输血科,江苏启东 226200
恶性肿瘤患者机体常呈高凝状态,易发生血栓栓塞性疾病,其也是导致患者发生死亡的常见并发症因素[1]。有研究报道称,肿瘤患者高凝血症发生率为60%,肿瘤细胞可在高凝状态以及静脉血栓栓塞症背景下,进行持续生长、浸润与转移,不利于疾病预后改善[2]。当机体呈现为高凝状态时,通常不会导致明显的临床症状出现,需为患者实施实验室检查,而常规凝血指标检测为主要检测方法[3]。血栓弹力图(thrombelastograghy,TEG)检查可对凝血全貌予以评估,目前对于TEG应用于恶性肿瘤患者机体凝血状态评估的相关研究较少,同时当临床上常规凝血指标与TEG检测结果存在差异时,如何评价对两种检测方法结果差异,准确评估患者的凝血功能,仍是需要解决的问题[4]。本研究就选取2020年10月—2021年6月启东市人民医院收治的恶性肿瘤患者89例,探讨恶性肿瘤患者TEG以及常规凝血指标的变化。现报道如下。
1 资料与方法
1.1 一般资料
选取本院收治的恶性肿瘤患者89例,其中男62例,女27例;年龄35~85岁,平均(67.40±10.72)岁。研究对象同意并签署知情同意书,本研究经医院医学伦理委员会审核并批准。
1.2 纳入与排除标准
纳入标准:①恶性肿瘤均经临床病理组织或细胞学确诊;②年龄18~89岁。排出标准:①肝肾功能明显异常患者;②合并自身免疫性疾病患者;③存在血液系统疾病患者。
1.3 方法
常规凝血指标检测:采集患者的静脉血于血凝管至刻度,采集量约3 mL,放入离心机内,以3 000 r/min速度离心15 min,取血浆开展检测,检测仪器为CS5100全自动凝血分析仪,检测指标包括凝血酶原时间(prothrombin time,PT),活化部分凝血活酶时间(activated partial thromboplastin time,APTT),凝血酶时间(thrombin time,TT),纤维蛋白原(fibrinogen,FIB),D-二聚体(D-dimer,D-D),纤维蛋白降解产物(fibrin degradation products,FDP),抗凝血酶原Ⅲ(antiprothrombin-Ⅲ,AT-Ⅲ);TEG检测:采集患者的静脉血于血凝管至刻度,采集量约3 mL,在2 h内采用西芬斯(CFMS)血栓弹力图仪进行检测,检测指标包括凝血因子活性(R),纤维蛋白原功能(K),血小板功能(MA),凝血综合指数(CI),纤溶指标(EPL),纤溶指标(LY30)。
1.4 观察指标
①本组患者常规凝血参数与TEG参数的统计描述;②TEG参数与常规凝血参数的相关性;③CFMS指标与临床结果的一致性分析;④TEG联合常规凝血指标预测恶性肿瘤患者血栓的灵敏度、特异度。
1.5 统计方法
采用SPSS 22.0统计学软件进行数据处理,符合正态分布的计量资料以(±s)表示;计数资料以频数表示;不同检查结果采用一致性分析。P<0.05为差异有统计学意义。
2 结果
2.1 患者常规凝血参数与TEG参数的统计描述
本组患者的R为(5.60±0.58)min,K为(1.90±0.21)min,MA为(61.75±5.28)mm,CI为(0.40±0.08),EPL为(0.25±0.10)%,LY30为(0.21±0.08)%,PT为(11.63±2.85)s,APTT为(31.85±6.35)s,TT为(21.12±3.25)s,FIB为(3.52±1.01)g/L,D-D为(0.55±0.12)mg/L,FDP为(8.45±2.50)μg/mL,AT-Ⅲ为(122.63±25.35)%。
2.2 TEG参数与常规凝血参数的相关性
R与APTT为正相关;K与FIB为负相关,K值缩短,FIB值增大;MA与FIB为正相关,MA值增大,FIB值增大。见表1。
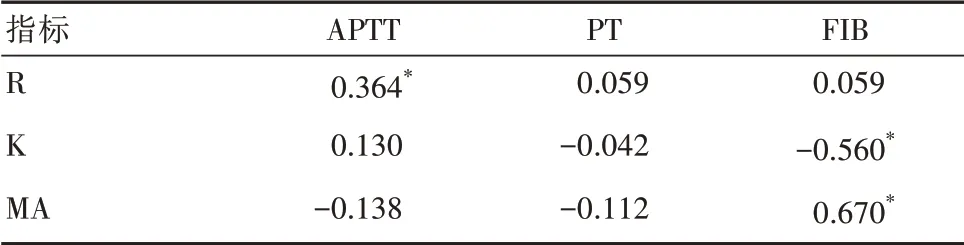
表1 TEG参数与常规凝血参数的相关性
2.3 CFMS指标与临床结果的一致性分析
一致性分析显示,R、K及MA与凝血结果之间具备较好的一致性,差异有统计学意义(P<0.05);PT、APTT与FIB与凝血结果之间的一致性分析,差异无统计学意义(P>0.05)。见表2。
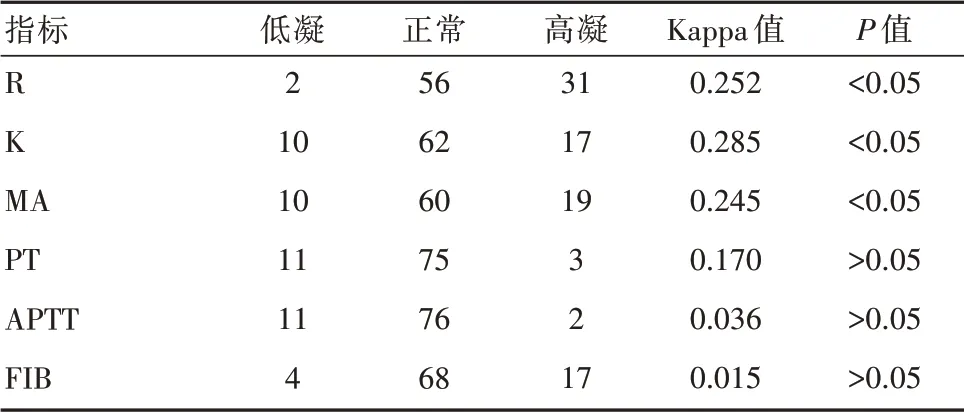
表2 指标与临床结果的一致性分析
2.4 TEG联合常规凝血指标预测恶性肿瘤患者血栓的价值
根据临床情况本组患者中发生血栓6例;检测指标结果根据参考范围,分为高凝与非高凝;血栓患者中TEG检测结果提示结果为高凝的患者共3例,常规凝血指标检测结果提示结果为高凝的患者共1例,两项同时提示为高凝的患者为4例。TEG联合常规凝血指标预测恶性肿瘤患者血栓的灵敏度为67%,特异度为52%。见表3。

表3 TEG联合常规凝血指标预测恶性肿瘤患者血栓的价值
3 讨论
高凝状态也被称为血栓前状态,是多种因素导致的血管凝血、抗凝与纤溶过程中平衡紊乱的动态失衡状态。目前临床上在对血液高凝状态进行诊断时,尚无统一规范的标准[5]。部分学者认为可将弥散性血管内凝血前期的指标,作为对恶性肿瘤患者血凝提高进行判断的指标,但弥散性血管内凝血前期发生的时间,集中在恶性肿瘤患者病情中晚期或急性加重的过程中,而血栓前状态的出现不受疾病状态的影响,所以二者具备不同的病理基础和诊断时间。因此弥散性血管内凝血前期标准,用于恶性肿瘤血栓前状态诊断,并无较高的适用性[6]。除此之外,国际认为的弥散性血管内凝血前期诊断标准参考的指标,不仅包括TEG、常规凝血指标,还包括组织因子活性、凝血酶-抗凝血酶复合物、抗凝血酶原Ⅲ、纤溶酶-抗纤溶酶复合物等,但目前在国内,上述指标检测尚未得到完全推广普及,因此通过上述指标对恶性肿瘤患者自身机体血凝状态进行判断,仍存在推广难度[7-8]。
R可反应凝血因子的质与量,缩小则表明血液具备的凝固度提高,提高则表明凝血因子具备的活性减弱,或是应用了抗凝剂[9]。本研究结果显示,本组患者的R水平为(5.60±0.58)min,APTT为(31.85±6.35)s,R和APTT表现为线性正相关(r=0.364),但其不具备较高的相关度,表现为中度相关,可能是由于TEG是依靠全血实施凝血功能检测,而常规凝血检测是将抗凝血内的血浆进行分离后,检测部分凝血因子具备的功能,减弱二者具备的相关性[10]。有研究报道称,R和APTT表现为中度正相关(r=0.411,P=0.038)[11],本研究与其报道结果基本相符。临床上在开展TEG检查时,患者自身的R和APTT、TT均表现出明显的相关性,但多元分析显示仅APPT对R值有明显贡献[12]。R和PT无明显相关性,可能是由于在检测PT值时,主要是依靠组织因子(tissue factor,TF)来对外源性凝血旁路进行活化,但TEG是通过高岭土来激发此旁路,但高岭土不具备TF,因此R无法对外源性凝血过程予以体现,表明TEG和常规凝血指标检测可能是采用的激活物不一致,从而使得R和PT之间不具备相关性[13]。除此之外,或是由于肿瘤导致患者机体血液呈高凝状态,肿瘤细胞具备促凝功效,比损伤内皮细胞对凝血系统产生的影响更小。K值为血凝块直径达到20 mm需要的时间,K值缩小是受到FIB升高的影响,通过采用抗凝剂,可延长K值[14]。M值是对PLT经由膜糖蛋白粘附形成血凝块的最大强度与稳定性,其受到FIB、PLT数量与功能的直接影响[15]。本研究中,R与APTT为 正 相关;K与FIB为 负 相 关,K值缩 短,FIB值增 大;MA与FIB为正 相关,MA值增大,FIB值增大,一致性分析显示,R、K及MA与凝血结果之间具备较好的一致性。由此表明,MA不但由血小板与纤维蛋白原的质与量决定,同时也受到内外源性途径中的凝血因子的影响,提示在血小板活化过程中有凝血酶的参与[16]。本研究结果显示,TEG联合常规凝血指标预测恶性肿瘤患者血栓的灵敏度为67%,特异度为52%。表明TEG联合常规凝血指标在恶性肿瘤患者血栓发生风险预测中具备一定作用。当恶性肿瘤患者出现血栓栓塞,且其预后通常较差,且生存周期较短,其自身机体常规凝血指标中的APTT以及PT不会发生明显变化,主要为FIB以及D-D水平升高,常规凝血无法对静脉血栓进行预测[17-18]。通过加用TEG检测,可使恶性肿瘤患者的凝血状态得到更为全面地反映。
综上所述,TEG与常规凝血检测具备明显相关性,但不具备较高的吻合度,无法直接替代应用,TEG联合常规凝血指标在恶性肿瘤患者血栓发生风险预测中具备一定作用。

