HPLC 法测定人血清中游离比阿培南浓度及其在重症感染中的临床应用
李博涵,彭秘,封传华,任琦,陈集志,徐兰
1.南昌大学江西医学院,江西 南昌 330006;2.中国人民解放军联勤保障部队第908 医院,江西 南昌 330002;3.江西中医药大学,江西 南昌 330004;4.江西省药品检验检测研究院,江西 南昌 330029
比阿培南是一种新型1β-甲基碳青霉烯类抗菌药物,通过结合细菌细胞壁上的青霉素结合蛋白,能有效地经细菌外膜渗透进入周质间隙,发挥强大的杀菌活性[1],对革兰阳性菌(G+菌)、革兰阴性菌(G-菌)和厌氧菌等能发挥广谱、强大的抗菌活性[2],被广泛用于特殊病理生理状况的重症感染患者的经验性治疗、产超广谱β-内酰胺酶G-杆菌引起的急慢性感染,临床上较多地用于腹腔感染、呼吸道感染、败血症、妇产科感染、心内膜炎及尿路感染[3]。比阿培南为时间依赖性抗菌药物,发挥杀菌活性的前提是抗菌药物浓度要达到某水平并维持较长时间。比阿培南血清稳态浓度高于大多数G+菌、G-菌和厌氧菌的MIC90(抑制90%细菌生长的最低药物浓度),对非产酶肠杆菌科和敏感金葡菌的敏感率均大于90%[4],但鲍曼不动杆菌和铜绿假单胞菌这两种病原菌的MIC90 可达到64、16 μg/mL[1],高于比阿培南血清稳态浓度。因此,需监测重症感染患者中比阿培南的血药浓度,按监测结果制定个体化的给药方案,提高临床治疗成功率。
药物在血中呈游离状态的部分能产生药理效应,能被机体转化和排泄,更为准确的做法是采用游离药物浓度来评价药效学和药物不良反应。本研究参考文献[5-7],建立了一种快速、简便、准确度高的HPLC 法测定人血清中游离比阿培南浓度,并应用于监测ICU 患者比阿培南的血清浓度,为安全合理使用比阿培南提供参考。
1 仪器与试药
LC-15C 型高效液相色谱仪(日本岛津);Millipore 超纯水仪(美国Millipore 公司);DL-360D型智能超声波清洗器(上海之信仪器有限公司);AUW220D 型电子分析天平(日本岛津);TGL-16 型高速离心机(山东百欧医疗科技有限公司);XH-B型微量涡旋混合器(上海汗诺仪器有限公司);ST 3100 型pH 计(常州奥豪斯仪器有限公司);移液枪(Thermo Fisher 公司);超滤离心管(10kD,聚醚砜膜,美国Millipore 公司)。比阿培南对照品(批号:A137321337769,纯度98.00%,APEXBio 公司);注射用比阿培南(批号:201116125,规格:0.3 g,正大天晴药业集团股份有限公司);3-(N-吗啉)丙磺酸(MOPS,批号:BCB28902,纯度≥99.5%,美国sigma-Aldrich 公司);醋酸铵(批号:20190620,国药集团化学试剂有限公司);硫酸锌(批号:202031099,天津市致远化学试剂有限公司);灭菌注射用水(四川科伦药业,批号:M14101008,规格:500 mL);乙腈、甲醇为色谱纯,水为纯化水,其他试剂均为分析纯。
2 方法与结果
2.1 色谱条件
色谱柱为Waters Atlantis T3 色谱柱(4.6 mm×150 mm,5 μm);流动相为乙腈-0.01 mol/L 醋酸铵缓冲液(pH4.6)(2∶98);流速为1.0 mL/min;检测波长为300 nm;柱温为30 ℃;进样量为20 μL。
2.2 溶液的配制
MOPS 溶液:精密称取MOPS 25 mg,置50 mL棕色量瓶中,加适量水溶解,用2 mol/L NaOH 溶液调pH 值为7,再加水定容至刻度,摇匀,即得浓度为0.5 mg/mL 的MOPS 溶液,4 ℃冷藏保存;比阿培南对照品储备液:精密称取比阿培南对照品0.021 1 g,置25 mL 棕色量瓶中,用0.5 mg/mL MOPS(pH 7.0)溶液溶解并定容至刻度,摇匀,即得校准后浓度为0.827 1 mg/mL 的比阿培南对照品储备液,分装于1.5 mL EP管中,-20 ℃冷冻保存。
2.3 样品的处理
精密量取血清210 μL,加入0.5 mg/mL MOPS(pH 7.0)溶液160 μL,涡旋混匀1 min,转移至超滤离心管中,15 000 r/min离心10 min,取下层滤液,进样分析。
2.4 专属性试验
A:取空白血清160 μL,加入0.5 mg/mL MOPS溶液(pH 7.0)210 μL,涡旋混匀1 min,转移至超滤离心管中,15 000 r/min 离心10 min,取下层滤液,进样分析。B:取空白血清160 μL,加比阿培南对照品储备溶液50 μL,加入0.5 mg/mL MOPS(pH 7.0)溶液160 μL,涡旋混匀1 min,转移至超滤离心管中,15 000 r/min 离心10 min,取下层滤液,进样分析。C:取患者用药后的血清,按“2.3”项下方法操作,进样分析。结果见图1,比阿培南保留时间约为5.4 min,色谱峰形较好,2.5 min 左右的杂质峰和其他内源性杂质对比阿培南峰型均不造成干扰。
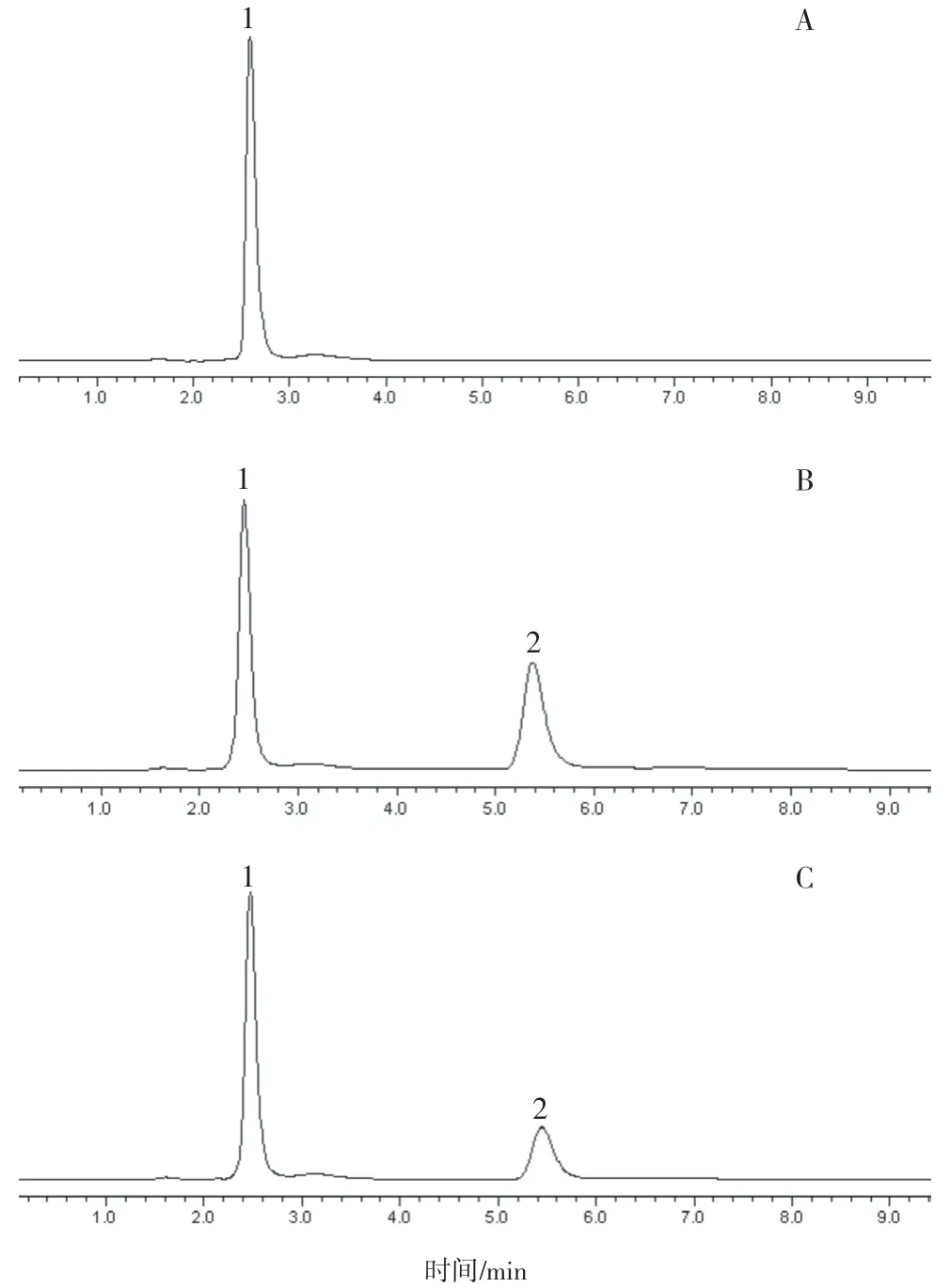
图1 HPLC色谱图:A.空白血清;B.空白血清+比阿培南;C.患者血清
2.5 标准曲线的建立
取比阿培南对照品储备液适量,用0.5 mg/mL MOPS 溶液(pH 7.0)稀释并配制系列对照品浓度分别为0.81、1.62、6.46、12.92、25.85、51.69、103.39、206.77 μg/mL。精密量取空白血清160 μL,分别加入上述系列对照品溶液各50 μL,使比阿培南血清浓度分别为0.20、0.40、1.58、3.16、6.32、12.65、25.30、50.59 μg/mL,按“2.3”项处理,记录色谱图。以峰面积(A)为纵坐标,血清中比阿培南浓度(C,μg/mL)为横坐标,建立标准曲线,得比阿培南的线性回归方程为A=19 558C+531.15,r=0.999 9。定量下限为0.20 μg/mL。结果表明,比阿培南血清浓度在0.20~50.59 μg/mL 与峰面积线性关系良好。
2.6 回收率试验
分别配制低、中、高浓度为1.54、6.15、24.62 μg/mL 的对照血样,每个浓度各5 份,按“2.3”项处理,记录色谱图,由回归方程计算得出测定浓度,方法回收率=测定浓度/理论浓度×100%,结果见表1。结果表明方法回收率均符合生物样品分析要求。
2.7 精密度试验
分别配制浓度为1.54、6.15、24.62 μg/mL 的比阿培南对照血样,每个浓度各5 份,按“2.3”项处理,分别在同一天内测定5 次、每天测1 次连续3 天,计算日内、日间精密度,结果见表1。比阿培南的日内、日间精密度RSD 均<8%,表明精密度符合生物样品分析要求。
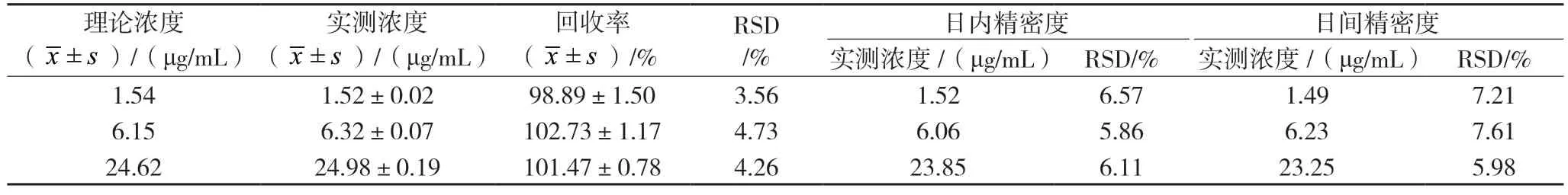
表1 回收率及精密度试验结果
2.8 稳定性试验
分别配制低、中、高浓度为1.54、6.15、24.62 μg/mL 的比阿培南对照血样,每个浓度各3 份,按“2.3”项下方法处理。室温稳定性:室温放置0、2、4、6、8、12 h;冷藏稳定性:4 ℃冰箱冷藏放置48 h;冻融稳定性:-20 ℃冰箱冻存,取出置室温自然融化,再置-20 ℃冻存24 h,此步骤重复2 次,共进行3 次。以上样品均按“2.3”项下方法处理。结果显示样品连续冻融3 次后,比阿培南稳定性有一定幅度下降,而冻融2 次稳定性良好;室温放置12 h、4 ℃下放置48 h、-20 ℃放置15 d 稳定性良好(比阿培南浓度变化<15%,RSD<6.65%)。
3 治疗药物监测
3.1 入选病例
本研究共纳入病例69 例,药敏试验提示为多重耐药菌感染或(和)对碳青霉烯类敏感的重症患者,年龄≥18 岁,使用比阿培南≥3 d。
3.2 样本收集及疗效判定
给药方案为比阿培南0.6 g,加入50 mL 0.9%氯化钠注射液中,输液泵泵注2~3 h,每8 小时给药一次。比阿培南血药浓度达稳态(用药2 d)后,于给药前30 min,外周静脉采血,测定谷浓度。本院伦理委员会已批准通过本试验方案。根据《抗菌药物临床应用指导原则》(2015 年版)制定临床疗效和微生物学疗效的评定标准。临床疗效:评定为治愈的标准为症状、体征均已消失或完全恢复正常,且非微生物学指标如影像学和实验室等均已恢复正常;微生物学疗效:微生物清除或未清除但临床症状及体征好转评定为好转。总有效率=(临床治愈+好转)/总例数×100%。
3.3 结果
参考相关文献[8-9],本研究将比阿培南谷浓度目标设定为1~10 μg/mL,测定结果见图2。低于最低检测限的患者有5 例;有16 例低于1 μg/mL,根据《抗菌药物临床应用指导原则》(2015 年版)制定的临床疗效和微生物学疗效评定标准,其中有13例治疗效果不佳,调整比阿培南用药方案比如加大单次使用剂量为0.6 g、增加给药频次至4 次/日、延长泵注时间等,再次监测谷浓度均有明显上升,均在1~10 μg/mL范围内,最终有12例临床治疗有效,1 例患者死亡;46 例在目标范围(1~10 μg/mL)内,临床治疗有效率为86.96%;有7 例大于10 μg/mL,其中2 例治疗无效。
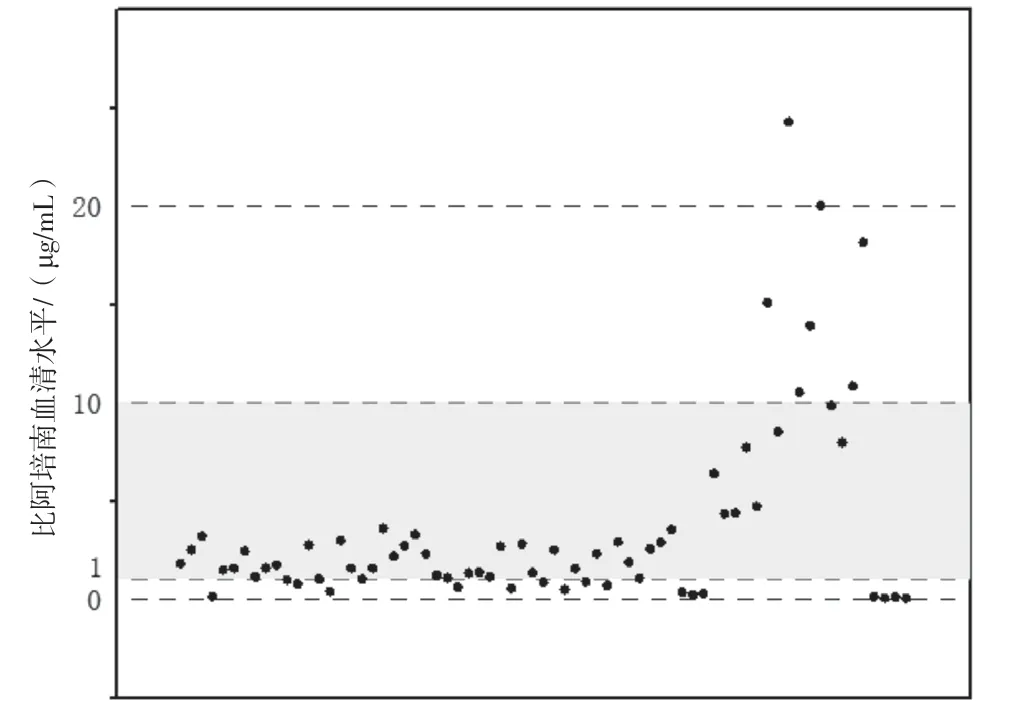
图2 比阿培南血清游离谷浓度(实线表示为目标浓度范围1~10 mg/L)
4 讨论
4.1 色谱柱的选择
比阿培南的水溶性大,在反相色谱柱上,特别是在非极性的C18 色谱柱上保留非常弱。在前期试验中为了获得适当的色谱保留,使用乙腈-0.01 mol/L醋酸铵缓冲液(pH4.6)(2∶98)为流动相,因采用的C18 色谱柱不是耐水色谱柱,高水比例的流动相引起色谱柱硅胶基质发生降解、修饰碳链倒伏断裂,导致C18 色谱柱柱效快速下降、色谱峰型变差或拖尾等。因此,本研究换用了对极性大的化合物保留能力强、在水流动相中性能稳定的Waters Atlantis T3色谱柱,解决了普通C18 色谱柱难以保留极性化合物这种难题。
4.2 样品处理方法的选择
目前关于比阿培南血清浓度测定方法包括微生物效价法[10]、硫酸锌或硫酸铵蛋白沉淀法[6,8,10]、沉淀蛋白后反洗法[11]、超滤离心法[6-7]、固相萃取法[12]等,但考虑到微生物效价法干扰因素较多,准确性、重现性较差,而固相萃取法因操作步骤繁琐,且衍生化试剂和衍生化产物的不稳定性易影响到测定结果,两种方法均无法快速有效监测比阿培南血清浓度。本研究选择并比较了硫酸锌蛋白沉淀法和超滤离心法对血样分离效果的影响。经硫酸锌沉淀蛋白后的样品,虽然处理过程简便、成本低,但可能是因为硫酸锌与比阿培南产生共沉淀,或者比阿培南浓度因硫酸锌稀释血样后有所下降[5],比阿培南提取回收率仅33%左右,样品经0.22 μm 微孔滤膜滤过并静置后仍变得浑浊不清,易堵塞色谱柱,色谱图杂质峰较多,干扰比阿培南峰,这结果与多篇文献[6,8,10]报道不同。而超滤离心管处理的血样提取回收率>95%,能较好地保持比阿培南分子在血清中的活性,样品澄清无杂质,经过约10 min 的处理就可快速用于测定,适合实时监测血清浓度,也可减少比阿培南因其不稳定性导致的降解,是目前较好的血样处理方法。比阿培南的蛋白结合率约10%,与蛋白结合的比阿培南分子量超过超滤离心管膜孔的截止尺寸(10 kD),将不能被滤过。超滤离心法具有简便、快捷、结果稳定可靠等优点,可作为测定比阿培南游离浓度的首选方法。
4.3 比阿培南血清游离浓度监测
本研究测定的比阿培南血清游离浓度波动范围为0~24.32 μg/mL,说明比阿培南在体内代谢过程个体化差异较大,这可能是因为与健康人群相比较,比阿培南在ICU 患者体内的药动学参数有很大差异,如Cmax(峰浓度)、AUC 0~8 h(0~8 h 内的药时-曲线下面积)小于健康人群,而T1/2(半衰期)、Cl(清除率)、Vd(表观分布容积)远大于健康人群[4],从而导致血药浓度个体化差异较大。
在影响药效达标率(PTA)的诸多因素中如MIC(最低抑菌浓度)、Vd、T1/2 等,MIC 的权重最大,达 90%以上,且MIC 值与PTA 成反比[13]。比阿培南对敏感菌株、中介需氧菌和非产酶肠杆菌科等病原菌的清除率较高且细菌耐药发生率较低;对ICU常见的耐药菌如多重耐药鲍曼不动杆菌和铜绿假单胞菌的MIC90 分别为32~64、16~64 mg/L,敏感率均<30%[4,14]。
ICU 患者血流动力学状态个体差异大,病理生理状态不同,本研究通过监测比阿培南血清游离浓度,验证其是否在目标范围内,并结合患者临床症状及感染程度,制定比阿培南的个体化给药方案,对大部分患者抗感染治疗有一定的指导作用,能进一步促进临床合理用药,避免不良反应的发生,提高临床用药安全性和有效性。

