猪睾丸支持细胞培养液对精子活力的影响
刘敏,孙鹏,张彦彬,冷露,潘庆杰,董焕声
(1.青岛农业大学动物科技学院,山东青岛 266109;2.山东畜牧兽医职业技术学院,山东潍坊 261061)
近年来,在猪生产中人工授精技术的应用变得愈发普遍。衡量公猪繁殖力的指标有精液品质与精子体外的受精能力[1],最主要的衡量指标当属精液品质。精子活力和精子形态这两项指标决定精液品质的优良程度,在精液常规指标中最能反映出精液质量与受精能力[2]。精子活力作为精子受精能力的中心指标能充分显示出猪的繁殖性能。在现代生产中,新鲜精液的精子活力低、畸形率高成了公猪繁殖力低的主要原因。尽管在生产中可以输入更多数目的精子来提高由于精子活力低或畸形率高形成的母猪受胎率降低等问题,但提升精液品质的首要目标仍是提高公猪精子的活力[3]。
睾丸曲细精管上皮的重要组成部分为支持细胞,支持细胞为发育中的雄性生殖细胞提供了环境与营养的辅助作用,另外还拥有非常重要的分泌功能。支持细胞分泌的一种旁分泌因子——乳酸,其功能是调节生精细胞的发育[4]。睾丸支持细胞可通过糖酵解的方式将葡萄糖转化为乳酸,因为粗线期精母细胞和圆形精子的首选代谢底物为乳酸,所以乳酸对于生殖细胞来说极为重要。Alves等[5]称糖尿病会使得支持细胞的乳酸代谢失衡并使得支持细胞与生精细胞之间的代谢平衡紊乱,最后会使精子活力降低并导致其生殖能力下降。徐蕊等[6]研究发现,大鼠睾丸支持细胞分泌的雄激素结合蛋白缺乏将会导致大鼠进行性不育。由此可见,睾丸支持细胞的分泌物会影响雄性动物的生殖能力。目前利用体外添加猪睾丸支持细胞培养液的技术鲜少有人研究,所以本试验以猪精子为研究对象,在体外条件下向猪精液中添加猪睾丸支持细胞培养液,并通过计算机辅助精子质量分析系统测定其对精子活力的影响,为提高猪体外授精效率提供新的方式。
1 材料与方法
1.1 试验材料
1.1.1 猪睾丸与猪精液的获取
本试验所用精液购自即墨市某种公猪站,试验所用猪睾丸取自即墨某猪场健康去势仔猪。
1.1.2 试验试剂
DMEM/F12培养基、丙酮酸钠、非必需氨基酸、胰蛋白酶均购于Thermo公司;胶原酶IV、透明质酸酶购自Sigma公司;D NaseI购自上海生工公司;胎牛血清购自Gibco公司;培养皿、离心管均购自Corning公司;PBS缓冲液购自Solarbio公司。
1.1.3 试验器材
体视显微镜(Nikon SMZ-1000),高速离心机(Eppendorf),自动高压蒸汽灭菌器(SANYO),精子分析仪(SCA),超净工作台(哈东联),精子采集板(Barcelona)等。
1.2 试验方法
1.2.1 猪睾丸支持细胞的分离与培养
将猪睾丸组织放入培养皿中,在PBS缓冲液中去除白膜及表面血管,并用PBS洗涤3次;加入0.1%胶原酶Ⅳ 1 mL和透明质酸酶1 mL置于37 ℃,5% CO2培养箱中消化5 min后终止消化,1 200 r/min离心5 min,弃上清;加1 mL胰酶和1 mL DNase酶吹打混匀,置于37 ℃,5% CO2培养箱中消化4 min,每隔2 min用手剧烈震荡一次,加入等体积培养液终止消化,依次通过80目、200目及300目细胞筛过筛得到细胞悬液,1 200 r/min离心5 min,弃上清液;加入新的培养液,分皿,置于培养箱,2 h后弃上清液,加入PBS洗涤3次,加入新的培养液培养;10 h后观察细胞状态,换新的培养液继续培养。
1.2.2 猪睾丸支持细胞培养液的获取方法
将分离培养的猪睾丸支持细胞置于37 ℃,5% CO2培养箱中,48 h后观察细胞状态,细胞呈梭形且基本铺满6 cm培养皿时开始收集培养液至离心管中,每隔24 h收集1次,-20 ℃保存。
1.2.3 精子活力分析
利用精子分析仪和精子活力检测板测定对照组和培养液组精子活力。
1.2.4 数据处理
使用统计分析软件SPSS进行数据分析,采用t检验的统计方法,参数设置为:P<0.05为差异显著,P<0.01为差异极显著。
2 结果与分析
2.1 猪睾丸支持细胞的分离与培养
如图1所示,猪睾丸支持细胞分离培养后2 h贴壁生长,形状呈圆形(图1A),10 h后逐渐呈三角形(图1B),60 h后细胞呈长梭形,细胞与细胞之间的间隙缩小(图1C)。
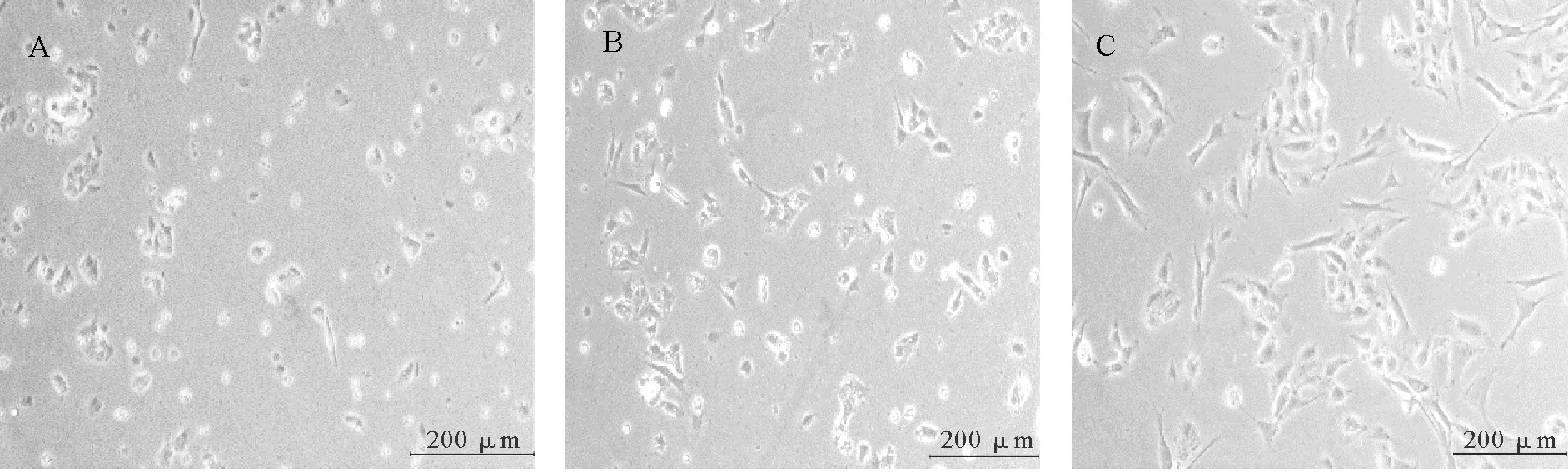
图1 猪睾丸支持细胞培养图(200×) Fig.1 Porcine testis Sertolicular cell culture diagram (200×)
2.2 细胞培养不同时间后培养液对精子活力的影响
由图2所示:将睾丸支持细胞置于37 ℃,5%CO2培养箱中,分别间隔1 h、8 h和24 h获取其细胞培养液,使用精子分析仪测量对照组与培养液组精子活力。结果为间隔1 h获取的细胞培养液使精子活力提高最多,为47.47%±0.53%,显著高于对照组39.63%±0.94%(P<0.01),间隔8 h培养液组的精子活力41.43%±0.93%,与对照组的差异不显著,间隔24 h培养液组的精子活力43.63%±0.80%,与对照组差异不显著。
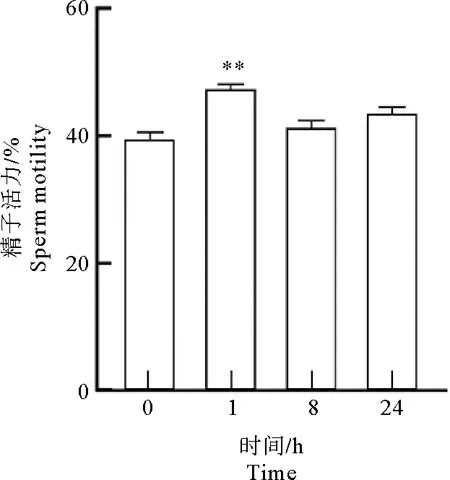
图2 细胞培养不同时间获得的培养液对精子活力的影响Fig.2 The effect of culture medium obtained at different time of cell culture on sperm motility注:与对照组相比,**表示差异极显著(P<0.01)。
2.3 睾丸支持细胞培养液对精子活力的影响
根据WHO标准,精子运动分为4个等级:a级表示精子快速直线前向运动,直线运动(红色);b级表示精子缓慢或呆滞向前移动,缓慢运动(绿色);c级表示精子非向前运动,原地运动(蓝色);d级表示精子不能活动,不运动(黄色)。
试验分为对照组与培养液组,使用精子分析仪测定精子的前进性、速度值以及WHO标准所测得的运动情况,对精子活力进行比较。由图3与表1所示:快速向前运动的精子由8.8%±0.28%增加到11.9%±0.35%,慢速向前运动的精子由35.5%±1.03%增加到39.0%±1.07%,极慢或不动的精子数量由31.6%±2.73%下降到24.8%±1.35%。精子活力由44.3%±1.06%增加到50.9%±2.44%,差异极显著。
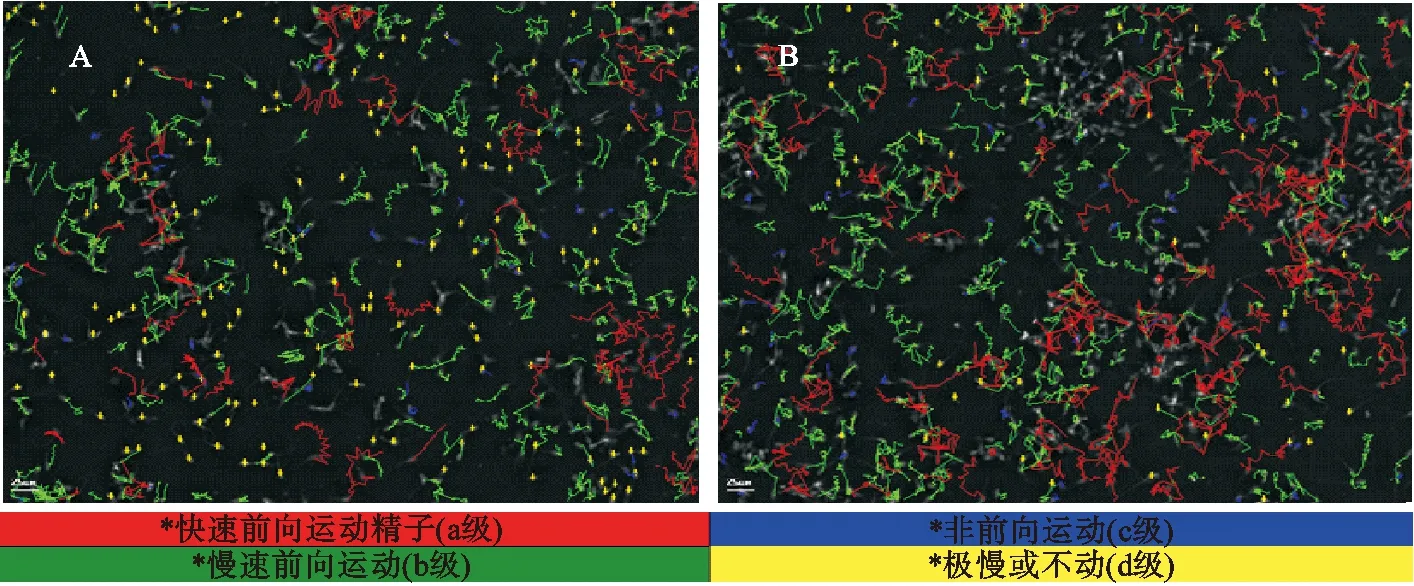
A.对照组检测图像;B.培养液组检测图像。图3 睾丸支持细胞培养液对精子活力的影响 Fig.3 The effect of Sertoli cell culture medium on sperm motility
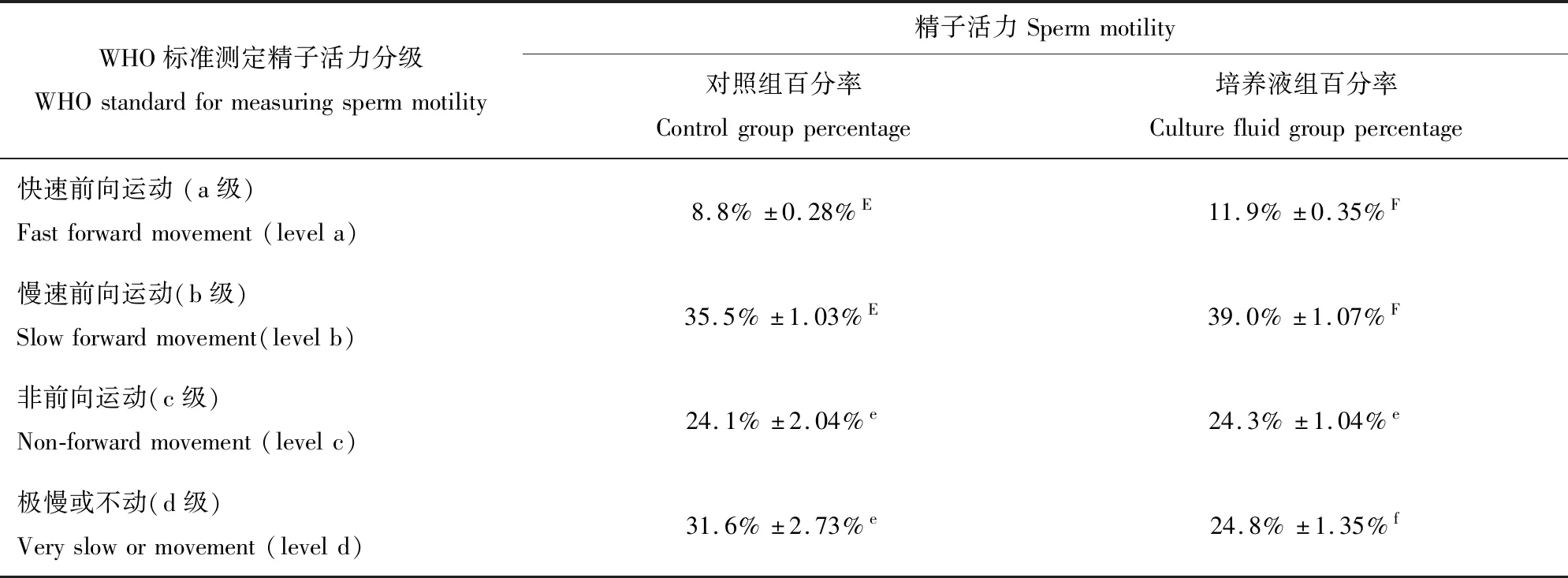
表1 根据WHO标准测定精子活力Table 1 Determination of sperm motility according to WHO standard
2.4 精子活力差异性分析
由图4所示:利用SPSS软件统计分析得出结论:培养液组精子活力为50.9%±2.44%,显著高于对照组44.3%±1.06%(P<0.01)。
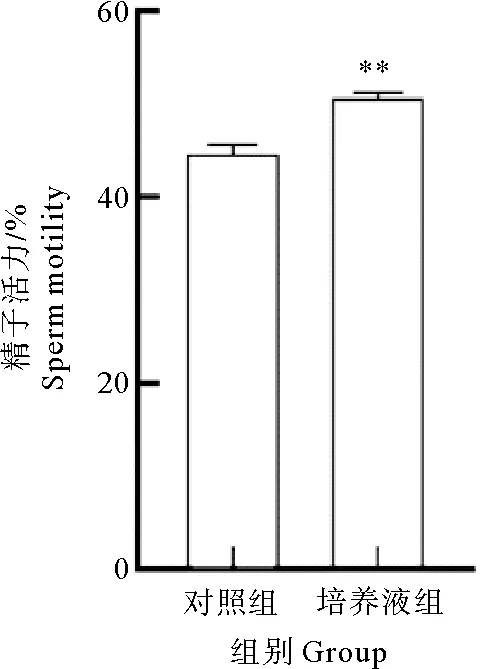
图4 精子活力的差异性分析图Fig.4 Analysis of differences in sperm motility注:与对照组相比,**表示差异极显著(P<0.01)。
3 讨论
由于精子正常的运动能力可以使得受精过程顺利进行,所以正确评估精子活力具有非常重要的意义。据文献报道在大鼠常规运动的精子中发现无活力的精子不具有受精能力,在人和其他物种中,精子活力下降也会导致生殖能力降低[7]。对于死精子症,精子活力低,在导致雄性不育的精液异常中所占比例约15%,内分泌异常、附睾功能受损以及精浆酸碱度异常、精子营养物质缺乏、生殖道感染等原因都会引起精浆质量的下降[8]。正常精子的生存能力和受精能力的指标之一就是具有足够数目的前进运动的精子,另外其精子活力也与雌性受胎率密切相关,所以本试验使用计算机辅助精子质量分析系统对猪精子活力进行了检测并利用睾丸支持细胞培养液对猪精子质量进行提升。
支持细胞可以通过其强大的分泌功能发挥它的调节作用。谭琨等[9]指出成熟支持细胞的数量与精子总数呈正比,而且它们在形态和功能上相辅相成,这说明睾丸支持细胞分泌物浓度对精子的品质有一定影响。这与本试验中猪睾丸支持细胞培养1 h后获取的培养液对精子活力的影响显著高于对照组一致。Marh等[10]将小鼠精母细胞与支持细胞共培养,可以让早期的生殖细胞产生具有受精能力的精子,间接证明支持细胞的分泌物可促进生殖细胞的增值与分化。
在猪的繁育方面我国的繁育人员一直在努力提高猪的生产能力及其所能产生的经济效益。对于猪的稀释液来说,主要分为两种:含缓冲盐的稀释液与不含缓冲盐的稀释液。含缓冲盐的冷冻稀释液主要包括以下类型:甘氨酸-磷酸和葡萄糖-磷酸、卵黄-葡萄糖-柠檬酸。Yesth[11]称,精子在代谢过程中产生的某种物质会使稀释液中的pH值产生变化,这会对精子发生产生不利影响,而含缓冲盐的冷冻稀释液中的柠檬酸、甘氨酸-磷酸等缓冲物质可将精液pH值调整为适宜的偏碱性环境,这种含有缓冲盐的稀释液对于精液有一定的保护作用。猪精液稀释液的另一组成成分是冷冻保护剂。Zeng等[12]研究结果显示,2%和3%的GLY具有最佳的抗细胞凋亡作用,且B细胞淋巴瘤/白血病-2及其同源蛋白的表达对精子凋亡来说影响较大。在本试验中,向猪精子体外添加睾丸支持细胞培养液可使精子活力提高,说明支持细胞的分泌物可促进精子的活力,这可能是支持细胞分泌的酶类或生长因子对精子活力起了关键作用,但具体的机理有待进一步探究。
4 结论
本试验利用在体外添加猪睾丸支持细胞培养液的方式提高了精子活力,探究出一种提升猪人工授精效率的新方法,利用这种新方法可充分发挥优良种公猪的遗传潜力,减少种公猪养殖成本,提高其品质培育改良水平,降低传播疾病的概率。本试验中猪睾丸支持细胞培养液能够提高猪精子活力的机制虽有很多不同观点,但具体机制有待继续探究和探讨。

