大豆肽锌螯合物的制备、结构表征及其体外消化分析
冷雨佳,段晓杰,陈复生
河南工业大学 粮油食品学院,河南 郑州 450001
锌是人体日常必需的微量元素之一,能促进生长和组织再生、保护皮肤健康、增强人体免疫力,缺锌会导致身体抵抗力下降、生长发育迟缓[1]。锌缺乏现象在发展中国家仍普遍存在,一些特殊的人群需要额外的补充剂来维持健康[2]。由于无机锌具有刺激胃肠道、吸收利用率低等缺点,因此寻找安全、吸收利用率高的富锌产品逐渐成为近年来的研究热点[3-4]。天然蛋白源肽锌螯合物作为一种新兴的锌补充剂,因其营养丰富、安全性高、易吸收的特性而具有巨大的开发潜力。肽锌螯合物是蛋白多肽与锌离子配位形成的环状络合物,可从许多食物蛋白质中制备,如芝麻蛋白[5]、乳清蛋白[6]、牡蛎蛋白[7]等。与无机锌盐相比,锌与多肽反应后形成可溶性锌螯合物,更容易被胃肠道吸收[8]。大豆作为世界第二大植物油料,是人类和动物重要的植物性蛋白来源,具有高产量、低成本和良好氨基酸组成的特点[9],经过提炼大豆油后其副产物仍富含蛋白质和纤维。大豆蛋白经酶水解产成的大豆肽作为其衍生物,具有抗氧化、降血压等生理活性[10-11],且具备良好的金属螯合特性[12-14]。
目前,大豆肽锌螯合物由于锌螯合率较低、螯合机制不清等问题限制了其商业化应用。此外,研究者对大豆肽锌螯合物的消化吸收特性研究较少,无法比较螯合态锌与传统无机锌盐的生物利用率差异,肽锌螯合物的消化吸收效果有待深入阐述。作者以酶解法制备大豆肽,通过螯合反应制备大豆肽锌螯合物,并优化制备条件;利用多种光谱学技术对大豆肽螯合锌前后进行结构表征;进一步通过体外模拟消化研究大豆肽锌螯合物的胃肠溶解性和肠道透过率,评价其生物利用度。该研究对提高大豆蛋白的利用价值具有重要意义,并为新型锌营养补充剂的开发利用奠定基础。
1 材料与方法
1.1 材料与设备
大豆分离蛋白:鲲华生物技术有限公司;胃蛋白酶、胰蛋白酶、碱性蛋白酶(Alcalase):丹麦诺维信公司;菠萝蛋白酶、木瓜蛋白酶:索莱宝生物科技有限公司;无水乙醇:天津市天力化学试剂有限公司;溴化钾:上海阿拉丁生化科技股份有限公司;硫酸氢二钠、磷酸二氢钠、六亚甲基四胺(EDTA)、二甲酚橙、七水合硫酸锌:分析纯,天津市科密欧化学试剂有限公司。
DZKW-S-4 电热恒温水浴锅:北京永光明医疗器材有限公司;GL-1000C高速离心机:上海安亭科学仪器厂;TU-1901 双光束紫外可见分光光度计:北京普析通用仪器公司;Alpha 1-2LD plus冷冻干燥机:德国Christa公司;EVO18扫描电镜:德国卡尔蔡司股份公司;Hyperion 2000傅里叶红外光谱仪:德国布鲁克公司。
1.2 方法
1.2.1 筛选制备大豆肽的蛋白酶
将大豆分离蛋白和磷酸盐缓冲溶液以1∶20(g/mL)混合,分别加入胃蛋白酶、胰蛋白酶、菠萝蛋白酶、木瓜蛋白酶、碱性蛋白酶,调节至酶的最适温度和pH值,酶解4 h后加热灭酶(90 ℃,15 min),将酶解液pH值调至7.0,然后离心(5 000 r/min,20 min)取上清液测水解度,冷冻干燥即得大豆肽。以大豆肽锌螯合能力为指标,筛选出最佳蛋白酶。
1.2.2 肽锌螯合物的制备
参考王晴等[12]的方法,取冻干后的大豆肽粉溶于去离子水配制大豆肽溶液,并加入一定比例七水合硫酸锌,调节反应体系pH值为5.0,50 ℃下充分搅拌1 h,离心(5 000 r/min,10 min)除去杂质。上清液中加入3倍体积的无水乙醇,离心(3 500 r/min,15 min)取沉淀冷冻干燥。
1.2.3 优化制备大豆肽的酶解条件
通过酶解制备大豆肽,分别对酶解pH值、温度、底物质量分数、加酶量和时间进行单因素试验。依据单因素试验结果设计正交试验,以锌螯合率为指标,优化制备大豆肽的酶解条件。
1.2.4 水解度(DH)的测定
参照王进[13]的方法,采用茚三酮比色法。
1.2.5 锌螯合率的测定
参照Wang等[14]的方法,采用EDTA络合滴定法。

式中:C为EDTA溶液的浓度,mol/L;V总为测定总锌含量时消耗的EDTA体积,mL;V螯合为测定螯合锌含量时消耗的EDTA体积,mL;V空白为用去离子水代替待测液所需的EDTA体积,mL。
1.2.6 优化螯合条件
取冻干后的大豆肽粉和硫酸锌溶于去离子水,按照1.2.2中方法制备大豆肽锌螯合物,对螯合反应的肽锌质量比、pH值、温度和时间进行单因素试验。依据大豆肽锌螯合单因素试验结果设计正交试验。以锌螯合率为指标,确定制备大豆肽锌螯合物的最佳工艺条件。
1.2.7 大豆肽锌螯合物的结构表征
1.2.7.1 扫描电镜分析
将大豆肽与肽锌螯合物样品置于铝制样品台上,喷金镀膜处理后,在扫描电镜放大倍数为1 000~3 000倍下拍摄样品图像。
1.2.7.2 傅里叶变换红外光谱分析
分别取1 mg大豆肽和肽锌螯合物样品与100 mg干燥的溴化钾混合研磨,采用压片法在500~4 000 cm-1波数范围内进行傅里叶变换红外光谱扫描测定。
1.2.8 肽锌螯合物的体外消化分析
参考Wang等[15]的方法。配制模拟胃液:称取0.2 g NaCl与0.32 g胃蛋白酶,将pH值调至2.0,定容至100 mL。配制模拟肠液:称取0.68 g的KH2PO4溶于70 mL双蒸水,加入1 g胰蛋白酶和6 g胆盐,将pH值调至7.6,定容至100 mL。
按照样品∶模拟胃液体积比为10∶1加入模拟胃液,在pH 2.0、37 ℃下消化120 min。随后调pH值至7.6,按照样品∶模拟胰液体积比为10∶1加入模拟胰液,将此混合物移入透析袋(7 000 Da),37 ℃水浴振荡120 min。取等体积的胃、肠消化液离心(8 000 r/min,15 min),用EDTA络合滴定法测定上清液和混合物溶液中锌含量,计算锌离子溶解率。
锌离子溶解率=V1/V2×100%,
式中:V1和V2分别为滴定上清液和混合物溶液中锌离子所需的EDTA溶液体积,mL。
经肠液消化后,取透析袋外的溶液,用络合滴定法测定锌离子含量时所需EDTA体积计算锌透过率。
锌透过率=V1/V2×100%,
式中:V1和V2分别为滴定透析袋外溶液和混合物溶液中锌离子所需的EDTA溶液体积,mL。
1.3 数据处理
每组试验重复3次,结果以平均值±标准差表示。使用SPSS 20.0、Origin 9.0分析数据和制图。
2 结果与分析
2.1 筛选制备大豆肽的蛋白酶
由图1可知,大豆分离蛋白经胰蛋白酶水解后的酶解物锌螯合率高于其他蛋白酶,酶解4 h的大豆肽锌螯合率达到52.50%。Wang等[16-17]研究发现:不同蛋白酶水解乳清蛋白和鳕鱼皮明胶蛋白后的金属螯合能力不同,经胰蛋白酶水解后的酶解物均具有较高金属螯合活性,与本文结果相似。蛋白质酶解物的生物活性取决于底物、酶的种类、水解程度[18]。不同酶水解后产生的酶解产物和锌结合能力的差异归因于酶在蛋白质链上不同的切割位置。胰蛋白酶作为一种内肽酶,可高效识别并切割赖氨酸和精氨酸残基的羧基端[19]。肽链中的天冬氨酸、谷氨酸、组氨酸、赖氨酸和精氨酸被认为是金属离子的结合位点[5]。因此,选取胰蛋白酶进行下一步的研究。
长江拥有独特的生态系统,是我国重要的生态宝库。长江全长6 300km,蜿蜒贯穿中国大陆地势的三级阶梯,流域辽阔,地貌和地质条件差异大,各地气候多样、独特;从高原到河口有成千上万条支流汇入,中下游地区历史上有众多湖泊与长江相通,水系发达,径流充足,形成了满足不同生物生长、繁衍的条件,生物多样性极其丰富。
2.2 优化制备大豆肽的酶解条件
为得到具有高锌螯合活性的大豆肽,通过单因素试验,分别研究了酶解pH值、温度、底物质量分数、加酶量和时间对酶解产物水解度和锌螯合率的影响。由图2A可知,当酶解pH值从6.5增加到8.0时,水解度和锌螯合能力不断提高,pH 8.0时水解度和锌螯合率最高,分别为10.82%和52.17%。但随着pH值进一步升高,水解度和锌螯合能力下降。由图2B可知,水解度在35~50 ℃范围内逐渐增加,于50 ℃达到最高值10.96%,进一步升温则水解度降低。由于蛋白酶在最适温度下酶活力最高,当温度过高或过低时,都会造成酶的构象改变,使酶活力降低,导致水解度下降[20]。大豆肽的锌螯合率受酶解温度影响较小并不显著,但也呈先增加后减小的趋势,在45 ℃时螯合率最高为54.16%。故选择45 ℃作为最优酶解温度,不再作为正交试验的因素。
由图2C可知,随着底物质量分数增加,水解度和锌螯合率均先增加后降低。当底物质量分数为5%时,水解度达到最高值11.16%,锌螯合率达到最高值56.45%,因此选取质量分数为5%进行下一步优化。由图2D可知,随着加酶量增加,水解度和锌螯合率先增加后趋于稳定。当加酶量为5%时,锌螯合率达到54.16%,此时水解度为10.17%,继续增加酶用量锌螯合率无显著变化,故选取加酶量5%进行下一步优化。由图2E可知,在1~4 h的反应期间,水解度和锌螯合率均呈现增加的趋势,在4 h时锌螯合率最大,为56.52%,因此选取酶解4 h进行下一步研究。随后水解度缓慢增加,在5 h时达到最高值12.29%,而锌螯合能力降低。研究表明锌螯合能力随着水解时间的延长而增加,但过度水解导致锌螯合能力降低[21]。
2.3 酶解制备大豆肽正交试验结果
选取对锌螯合率影响较大的4个因素(酶解pH值、时间、加酶量和底物质量分数)进行正交试验优化。正交试验设计与结果如表1所示,由表1可知,对锌螯合率的影响因素依次为酶解pH值>时间>加酶量>底物质量分数。最佳酶解条件为A2B2C3D2,即pH 8.0,反应时间4 h,加酶量6%,底物质量分数5%。在最佳条件下对其进行验证,得到锌螯合率为59.37%,优于正交试验中的结果,故选用该条件制备大豆肽进行下一步试验。
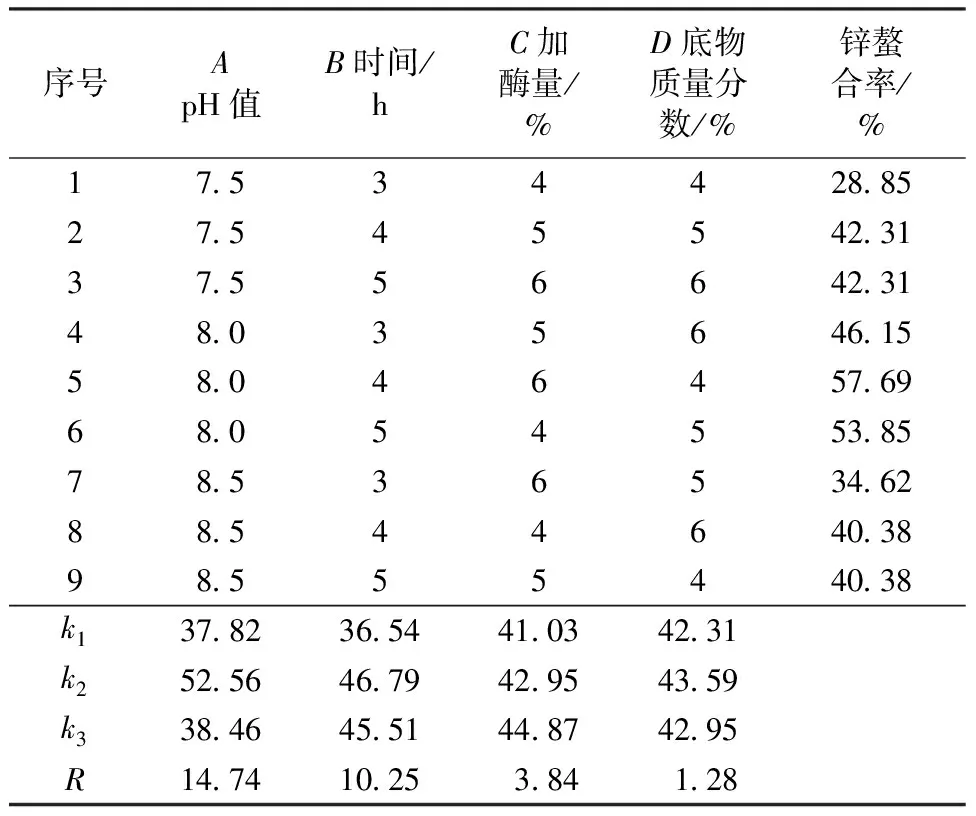
表1 酶解条件的正交试验设计及结果
2.4 优化大豆肽锌螯合物的螯合条件
在肽锌螯合反应的条件优化中,分别研究了肽锌质量比、pH值、温度和时间对锌螯合率的影响。由图3A可知,锌螯合能力随着多肽比例的增大而先提高后降低,当质量比达到4∶1时,大豆肽的锌螯合率为74.90%,继续增加肽锌质量比,螯合能力开始下降。表明反应在肽锌比4∶1时达到平衡,当肽锌比继续增加则溶液中大豆肽会发生聚集,不利于与锌离子结合。由图3B可知,随着pH值从3.0升高到5.0,锌螯合率逐渐增加至76.61%,当pH值超过5.0时迅速降低。这是由于反应体系在酸性条件下,溶液中H+与金属阳离子竞争结合位点,导致锌螯合率较低;适当增加pH值则锌螯合率提高,当pH大于5.0时,Zn2+在反应体系中更容易与OH-结合形成Zn(OH)2沉淀,从而降低螯合率[22]。
由图3C可知,大豆肽的锌螯合能力随着温度升高而增加,60 ℃时锌螯合率达到82.80%,超过60 ℃时螯合率降低。由于温度会影响肽锌螯合物的反应速率,初期温度上升会促进螯合反应,与富天昕等[23]的研究结果相似。由图3D可知,随着螯合反应时间的延长,大豆肽的锌螯合率不断升高,反应60 min时螯合率最高可达80.76%,继续延长时间则其螯合能力略有降低。由于螯合时间对其螯合率的影响并不显著,故选取60 min作为最优反应时间,不再作为正交试验的因素。
2.5 螯合条件正交试验结果
选取对锌螯合率影响较大的3个因素(肽锌质量比、pH值、温度)进行螯合条件正交试验优化。正交试验设计与结果如表2所示,由表2可知,对锌螯合率的影响依次为肽锌质量比>温度>pH值。最佳螯合反应条件为A2B2C2,即肽锌质量比4∶1,pH 5.0,温度60 ℃,反应时间60 min。在最佳条件下对其进行验证,得到锌螯合率为82.22%,优于高素蕴等[11]用碱性蛋白酶水解制备大豆肽的锌螯合率。

表2 螯合条件的正交试验设计及结果
2.6 大豆肽锌螯合物的结构表征
2.6.1 扫描电子显微镜分析
2.6.2 傅里叶变换红外光谱分析


2.7 体外模拟胃肠道消化
为研究锌在人体胃肠道的消化吸收特性,通过模拟体外消化来评估大豆肽锌螯合物和ZnSO4在胃肠道的溶解性。此外,还研究了消化时间对锌在肠道溶解率的影响。由图6可知,在胃消化阶段,ZnSO4和大豆肽锌螯合物的溶解率均处于较高水平,分别大于或等于92.85%、90.19%。进入肠道消化阶段,大豆肽锌螯合物的溶解率下降到54.34%,而ZnSO4的溶解率显著下降到20.21%。在体外模拟胃肠道消化阶段,大豆肽锌螯合物的锌溶解程度均高于ZnSO4。试验结果表明,在胃肠道的酸碱度范围内,较高的螯合态锌含量对于改善人体胃肠道生理环境中的锌离子生物利用度很重要。在pH 2.0的胃环境下,螯合态锌有利于锌向肠环境的转运;在pH 7.6的碱性肠道环境中,螯合态锌可以防止锌产生沉淀,从而使其可以被肠上皮细胞有效吸收[22]。此外,由于肽锌螯合物具有一定缓冲作用,能避免与饮食中植酸形成不溶性复合物,可以显著提高锌的生物利用率[27]。
由图7可知,大豆肽锌螯合物的锌透过率从34.78%上升到51.02%,显著高于ZnSO4的锌透过率。试验表明,由于大豆肽锌螯合物可以部分抵抗肠道碱性条件,减少形成氢氧化锌沉淀,在模拟肠道消化结束后,有超过1/2的锌离子被吸收。此外,大豆肽锌螯合物可在胃/胰蛋白酶作用下进一步分解为小分子,重新进入肠道被吸收[28],并可能增加锌的吸收和生物利用度。综上,大豆肽锌螯合物在模拟肠道中的锌溶解率和锌透过率均高于无机锌盐,是一种优良的新型锌补充剂。
3 结论
本研究将大豆肽与锌离子进行螯合,以锌螯合率为指标,通过正交试验获得酶解制备大豆肽的最优条件为酶解温度45 ℃、pH 8.0、胰蛋白酶加酶量6%、底物质量分数5%、时间4 h;肽锌螯合的最优条件为肽锌质量比4∶1、温度60 ℃、pH 5.0、时间60 min,该条件下的锌螯合率可达82.22%。对大豆肽螯合前后进行结构表征发现,锌的配合导致了大豆肽和螯合物的结构差异,使大豆肽锌螯合物在扫描电镜图谱中呈现均匀疏松的微观结构。肽链中的羧基氧原子和氨基氮原子是锌和大豆肽相互作用的重要位点。此外,大豆肽锌螯合物具有优于无机锌盐的胃肠溶解性和肠道透过率,可能增加锌的生物利用度。大豆肽锌螯合物是一种优良的新型补锌剂,可以替代目前的无机锌盐补充剂,具有潜在的应用价值。

