基于核酸适配体的比色传感策略用于牛奶中沙门氏菌的快速检测
张倩雯,陶 晴,赵婷婷,张 彤,颜 娟,2,*
(1.上海海洋大学食品学院,上海 201306;2.上海水产品加工及贮藏工程技术研究中心,农业农村部水产品贮藏保鲜质量安全风险评估实验室(上海),上海 201306)
食品安全是遍及世界的重大公共卫生问题,其中由微生物导致的细菌感染事件是引发食品安全问题的最主要原因,据世界卫生组织统计,沙门氏菌感染主要来源于动物食品,如肉类、家禽、蛋类和乳制品,常见的传播路径是被人类粪便污染的绿色蔬菜或餐饮服务中受污染的食物。目前发现的近1 000 种沙门氏菌菌株,根据其抗原成分可分为甲、乙、丙、丁、戊等,其中鼠伤寒沙门氏菌()是临床上最常见的食源性致病菌,其引起的沙门氏菌病是世界各地一种主要的食源性细菌胃肠炎感染,伴随的中毒症状主要有恶心、呕吐、腹痛、头痛、畏寒和腹泻等,不仅对人体健康造成了危害,也是食品安全、环境监测、疾病预防的巨大威胁。因此,对沙门氏菌的监测具有重要的公共卫生意义。目前常规检测沙门氏菌的方法有传统培养法、基于大型仪器检测、免疫学分析法等。传统培养法的一般步骤是前增菌、选择性增菌、选择性平板分离、生物化学筛选、血清学技术提供培养物菌种的鉴定,这种细菌培养程序耗时,至少2 d获得最终报告,需要专业的工作人员,成本高,且灵敏度有限。基于大型仪器检测有高效液相色谱(high performance liquid chromatography,HPLC)法、质谱(mass spectrometry,MS)分析法等,由于检测仪器体积庞大、检测成本高,需要复杂的准备程序,存在一定的局限性。虽然免疫学分析方法能够在较短的时间内实时检测致病菌,但与传统方法相比,有一定的缺陷,例如对低浓度靶物质的灵敏度差、抗体与相关抗原发生交叉反应、某些抗体对其靶物质的亲和力低,必须由专业的操作人员进行。因此,迫切需要开发一种灵敏、快速、简便的沙门氏菌检测方法。
适配体传感器的开发与应用促进了微生物检测领域的发展,核酸适配体是指利用指数富集的配体进化技术从寡核苷酸合成文库中筛选出能与靶物质特异性结合的DNA或RNA,长度一般为25~60 个核苷酸,当靶物质存在时,适配体通过互补碱基间的配对、静电作用、氢键作用等自发的适应性折叠成发夹、假节、凸环和G2四分体等稳定的三维空间结构,这些结构以及空间构象的多样性是与靶物质紧密结合的基础。与抗体相比,适配体对目标分子表现出更好的亲和力和特异性;具有可逆变性、稳定性、更好的经济效益、易于修饰等。基于上述优点,适配体常被作为生物传感器的组成部分,例如,Youn等用DNaseI辅助循环酶信号放大方法结合适配体及氧化石墨烯复合物,设计了一种基于荧光共振能量转移的抗生素适配体传感器。Huang Rongrong等提出了一种基于适配体与靶标结合构象变化的荧光适配体传感器定量检测乙型肝炎病毒e抗原的方法,以标记荧光基团的适配体作为分子识别元件,设计与其互补的单链DNA(single-stranded DNA,ssDNA)通过竞争法实现对慢性乙型肝炎的诊断。Zhang Hui等基于适配体的特异性识别功能与纳米粒子的拉曼增强光谱构建了同时检测沙门氏菌和金黄色葡萄球菌的生物传感器。
本研究开发了一种基于核酸适配体和纳米金光学特性的生物传感器用于鼠伤寒沙门氏菌的可视化比色检测。采用适配体(5′-CTGACAGATTAAAAGTGGTTG GGCAACTTCTGCTTGCGAA)对鼠伤寒沙门氏菌进行定量,该适配体对鼠伤寒沙门氏菌亲和力较好,值为4.41×10mol/L。检测原理如图1所示,首先,沙门氏菌适配体和与其序列互补的捕获探针(capture probe,CP)通过碱基互补配对原则杂交制备而成双链DNA(double-stranded DNA,dsDNA)复合物。当待测分析物中含有鼠伤寒沙门氏菌时,适配体与鼠伤寒沙门氏菌发生特异性结合,从而释放出单链CP并吸附在纳米金表面,避免了纳米金粒子在盐诱导作用下的聚集,此时纳米金颗粒溶液保持酒红色;而当待测分析物中不含沙门氏菌时,由于dsDNA的双螺旋结构刚性较好,对纳米金颗粒吸附性能较差,导致其在盐的诱导下发生团聚,此时纳米金溶液颜色由红变紫。该颜色变化过程,无需额外仪器辅助,裸眼即可实现靶物质的快速检测,并通过进一步分析,实现对沙门氏菌的定量检测。

图1 基于纳米金比色法适配体传感器检测原理图Fig. 1 Working principle of Au nanoparticle-based colorimetric aptasensor
1 材料与方法
1.1 材料与试剂
鼠伤寒沙门氏菌(,ATCC 19585)、非目标菌为大肠杆菌(,ATCC 43889)、副溶血性弧菌(,ATCC17802)、金黄色葡萄球菌(,ATCC 25923)、李斯特菌(,ATCC 19115)均购于美国菌种保藏中心(American Type Culture Collection,ATCC);四氯金酸水合物(HAuCl·HO) 百灵威科技公司;8600-10醛基磁珠 美国Polysciences公司;胰蛋白胨大豆肉汤培养基;LB肉汤培养基;营养琼脂;亚硫酸铋琼脂培养基;Tris-HCl缓冲盐溶液(pH 7.4);乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA);乙二胺四乙酸二钠盐二水(EDTA-2Na 2HO);磷酸盐缓冲液(20×PBS,pH 7.4~7.6)、杂交缓冲液1(25 mmol/L Tris-HCl、10 mmol/L EDTA-2Na,pH 8.8)、氯化钠(NaCl)、杂交缓冲液2(10 mmol/L Tris-HCl、1 mmol/L EDTA,pH 8)、吐温20、琼脂糖III、4S Red Plus核酸染色剂、电泳缓冲液(50×TAE、pH 8.4)和其他常规试剂以及DNA序列均购自生工生物工程(上海)股份有限公司,纯化方法为HPLC,DNA具体序列见表1。实验用水通过Milli-Q系统(美国密理博公司)净化。
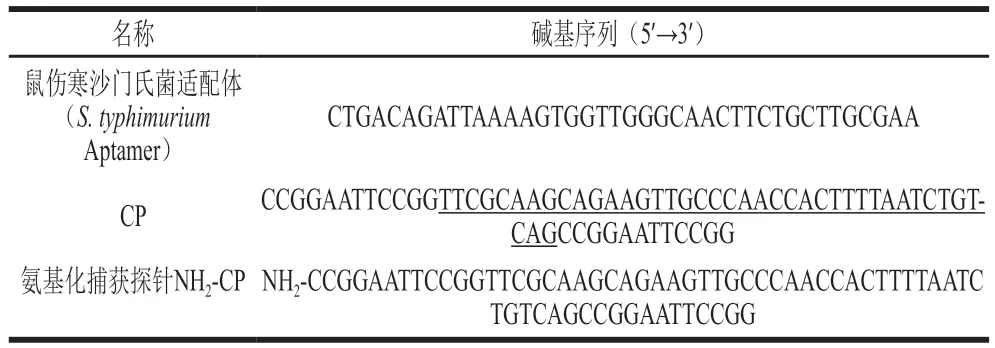
表1 实验中所用的DNA序列Table 1 DNA sequences used in this study
1.2 仪器与设备
HCM100-Pro恒温振荡金属浴 大龙兴创实验仪器(北京)有限公司;5417R小型台式冷冻型离心机德国Eppendorf公司;TALOS F200X场发射透射电子显微镜 赛默飞世尔科技公司;Hema9600型聚合酶链式反应(polymerase chain reaction,PCR)仪珠海黑马医疗仪器有限公司;LQ-5103A型电子天平上海瑶新电子科技有限公司;Lab dancer振荡器 大龙兴创实验仪器(北京)股份公司;Synergy2 SLFPTAD多功能酶标仪 美国伯腾仪器有限公司;BSC-1100IIA2-X生物安全柜 山东博科生物产业有限公司;FS5一体化稳态瞬态荧光光谱仪 英国爱丁堡仪器公司;琼脂糖凝胶成像分析系统 美国伯乐Bio-Rad公司;EOS 50D数字照相机 日本佳能公司。
1.3 方法
1.3.1 鼠伤寒沙门氏菌菌液的准备
取冻存的鼠伤寒沙门氏菌种子液在亚硫酸铋琼脂培养基上划线培养48 h,挑取单个菌落接种至胰蛋白胨大豆肉汤培养基中,摇床振荡培养过夜(200 r/min、37 ℃、16 h)。将过夜培养的菌液用无菌Tris缓冲盐溶液(Tris buffered saline,TBS)离心洗涤3 次(8 000 r/min、5 min),弃上清液重悬在缓冲液中,经稀释至合适的倍数后涂布于亚硫酸铋琼脂培养基中计数(37 ℃、48 h)。最终用TBS稀释至合适浓度进行实验。
1.3.2 纳米金的制备
1)跟踪微课程学习情况。通过将微课程上传至教学平台,不定时监测学生的点击学习情况。将点播次数较多的微课程通常是学生普遍认为的难点,教师在课堂中统一讲解解惑。
参考经典的Frens方法,取1 mL 1%氯金酸溶液和49 mL去离子水同时加入圆底烧瓶中混匀,同时组装好冷凝管,油浴加热直到沸腾,再配制1%柠檬酸三钠溶液,取3.5 mL加入至圆底烧瓶中搅拌混匀,反应20 min后停止加热,用磁力搅拌器搅拌圆底烧瓶内的物体至制备完成,用50 mL离心管分装置于4 ℃冰箱储存备用。
1.3.3 Mbs@CP的组装
取20 μL醛基化磁珠,磁响应后移除上清液,加入36 μL 1×PBS(10 mmol/L NaHPO、1.75 mmol/L KHPO、0.14 mol/L NaCl、2.65 mmol/L KCl,pH 7.2~7.6)和4 μL 100 μmol/L的氨基修饰的CP,37 ℃孵育12 h磁分离后,用100 μL 1×PBS洗涤3 次,用100 μL 0.5%酪蛋白溶液室温封闭1 h,磁分离后将沉淀重悬在100 μL 1×PBS中并放置4 ℃备用。
1.3.4 荧光法验证适配体与靶标的亲和力
首先用磁珠连接的捕获探针Mbs@CP(10 μL)与适配体(Apt)(10 μL)在杂交缓冲液中混合,90 ℃孵育5 min,冷却至室温完成杂交,洗涤弃掉上清液(未杂交上的Apt),再重悬在20 μL 1×PBS中制备Mbs@dsDNA,分别加入30 μL浓度梯度的鼠伤寒沙门氏菌溶液(10~1×10CFU/mL),30 μL 2×TBS(50 mmol/L Tris-HCl、0.28 mol/L NaCl、6 mmol/L KCl,pH 7.2~7.6)作为空白对照,37 ℃孵育完成识别与适配体的释放。反应结束后取上清液分别加入20 μL 2×TBS和20 μL 10×SYBR Green I混匀避光孵育30 min,完成孵育后用20 μL比色皿收集液体进行荧光信号强度测定,设置激发光波长为497 nm,缝隙宽度为3 nm,发射光波长为525 nm,缝隙宽度为2 nm。
1.3.5 可行性验证
用该比色传感体系同时检测含鼠伤寒沙门氏菌的样品和空白样品,以验证该适配体传感器的可行性。首先取2 个PCR离心管标记为空白组(管1)、实验组(管2),同时加入5 μL CP(2 μmol/L)和5 μL Apt(2 μmol/L)振荡混匀,在PCR仪中设置90 ℃杂交5 min,再取出离心管放置室温冷却完成杂交过程。空白组中加入10 μL TBS,实验组中加入10 μL鼠伤寒沙门氏菌溶液(1×10CFU/mL),于37 ℃孵育完成识别与适配体的释放,取出后分别加入50 μL AuNPs(23 nmol/L)溶液混匀,最后加入7 μL NaCl溶液(0.2 mol/L)混匀静置10 min。
1.3.6 体系灵敏度检测
每管取10 μL 4 ℃备用的dsDNA,分别加入10 μL浓度梯度的鼠伤寒沙门氏菌溶液,10 μL 2×TBS作为空白对照,37 ℃振荡孵育20 min完成识别与适配体的释放,再各加入50 μL AuNPs(9.2 nmol/L)溶液混匀于37 ℃孵育20 min。反应结束后分别加入7 μL NaCl溶液(0.2 mol/L)混匀静置2 min,收集显色溶液于96 孔板中用酶标仪测定吸收光谱。
1.3.7 特异性分析
取5 个PCR离心管,分别加入10 μL 4 ℃备用的dsDNA,以及准备好的其他4 种常见的非目标致病菌菌液(大肠杆菌、金黄色葡萄球菌、李斯特菌、副溶血性弧菌,1×10CFU/mL,10 μL)和鼠伤寒沙门氏菌菌液(1×10CFU/mL,10 μL),混匀后于37 ℃水浴中孵育完成适配体的识别与释放,再各加入50 μL AuNPs(9.2 nmol/L)溶液振荡混匀后于37 ℃水浴中孵育20 min,取出后分别加入10 μL NaCl溶液(0.2 mol/L)混匀静置2 min,收集显色溶液于96 孔板中用酶标仪测定吸收光谱。
1.3.8 实际样品分析
通过高速离心分离牛奶样品(10 000 r/min,20 min),去除上层脂肪和下层沉淀,吸取中间液体用超滤膜进行过滤处理,最后将过滤所得的溶液稀释1 倍备用。通过添加鼠伤寒沙门氏菌菌液制备不同浓度梯度的样品溶液(1×10~1×10CFU/mL)并放置4 ℃备用,用该适配体传感器检测标准溶液的方法对牛奶样品溶液进行检测。
2 结果与分析
2.1 适配体与靶标的亲和力验证
适配体与靶标之间的高效识别是构建适配体生物传感器的基础,因此首先通过荧光法验证该Apt与鼠伤寒沙门氏菌的亲和力。如图2A所示,利用碱基互补配对原则,制备Apt与氨基化捕获探针NH-CP的dsDNA复合物。该dsDNA复合物在室温下通过其标记的氨基与磁珠表面的醛基即可形成较为稳定的席夫碱结构。当检测体系中存在鼠伤寒沙门氏菌时,Apt与鼠伤寒沙门氏菌发生特异性识别并被释放至溶液的上清液中,收集上清液并加入荧光染料SYBR Green I。Apt与沙门氏菌结合后,自身序列含有配对碱基从而形成部分DNA双螺旋结构,SYBR Green I嵌入其中后荧光大大增强。通过测定上清液中SYBR Green I的荧光强度变化,考察该适配体与鼠伤寒沙门氏菌的结合性能。如图2B所示,随着鼠伤寒沙门氏菌浓度(1×10~1×10CFU/mL)增加,荧光信号逐渐增强,且相对荧光强度(-)/逐渐升高(图2C)。其中,代表空白组荧光信号值,代表实验组荧光信号值。结果表明,该适配体与不同浓度鼠伤寒沙门氏菌的响应关系良好,表明两者具有良好的亲和性能,可应用于构建适配体生物传感器。

图2 荧光法验证靶标与适配体亲和力原理(A)、不同浓度鼠伤寒沙门氏菌荧光光谱(0~1×107 CFU/mL)(B)和相对荧光强度与鼠伤寒沙门氏菌浓度关系(C)图Fig. 2 Schematic diagram of affinity between target and aptamer by fluorescence method (A), fluorescence spectra of S. typhimurium at different concentrations ( 0–1 × 107 CFU/mL) (B), and relationship between relative fluorescence intensity and S. typhimurium concentration(C)
2.2 比色传感策略的可行性验证
基于适配体的纳米金比色法用于鼠伤寒沙门氏菌快速检测的可行性验证,结果如图3A所示,管1为空白对照组,检测体系中不含沙门氏菌;管2为实验组,检测体系中含有沙门氏菌。裸眼观察到管1相比管2,纳米金颜色明显偏紫,说明管1中纳米金聚集,管2中纳米金分散良好。分别对两管中胶体金状态进一步通过透射电子显微镜进行表征。空白组的纳米金颗粒大部分聚集成团(图3B),而实验组中纳米金与其相比,在视野里则较为分散(图3C)。该结果证实表明该比色传感策略可应用于鼠伤寒沙门氏菌的快速检测。
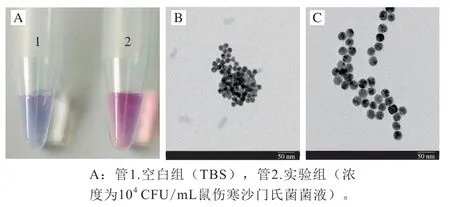
图3 比色法验证适配体传感器可行性(A)及空白组(B)、实验组(C)纳米金透射电子显微镜表征Fig. 3 Colorimetric validation of the aptasensor’s feasibility (A), and transmission electron micrographs of Au nanoparticles in blank (B) and experimental groups (C)
2.3 dsDNA复合物的制备优化
ssDNA与dsDNA与纳米金之间的不同吸附力是纳米金比色策略的基础,因此确保检测体系中含有更多dsDNA复合物是提升该传感方法性能的关键因素之一。因此,以杂交缓冲液、杂交温度及时间作为影响因素,优化dsDNA复合物的制备。
选择并对比两种杂交缓冲液:缓冲液1(25 mmol/L Tris-HCl、10 mmol/L EDTA-2Na,pH 8.8)和缓冲液2(10 mmol/L Tris-HCl、1 mmol/L EDTA,pH 8)用于dsDNA的制备。通过琼脂糖凝胶电泳图对产物进行表征。如图4A所示,泳道1和泳道2分别是CP与Apt的条带,泳道3和泳道4分别是缓冲液1和缓冲液2所得产物。与泳道4相比,泳道3中条带更亮。因此,选定缓冲液1用于后续实验。
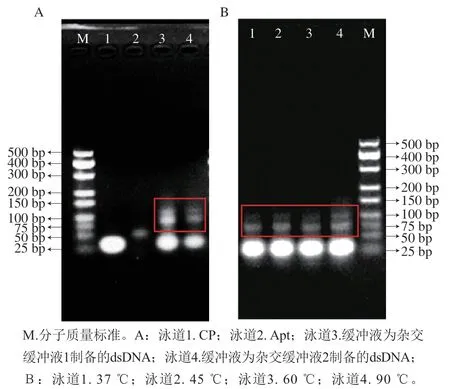
图4 2 种不同杂交缓冲液(A)和不同温度(B)条件下制备dsDNA琼脂糖凝胶电泳表征Fig. 4 Agarose gel electropherograms of dsDNA prepared in two different hybridization buffers (A) and at different temperatures (B)
在4 种不同的杂交温度及时间下,分别为37 ℃孵育1 h、45 ℃孵育1 h、60 ℃孵育1 h、90 ℃孵育5 min,再冷却至室温放置1 h,制备dsDNA复合物。结果如图4B所示,4 个泳道都出现dsDNA条带,并且泳道4与泳道1~3的条带相比,其dsDNA的条带更加明显。这可能是因为高温下,DNA序列本身的二级结构均被打开,利于两者的充分杂交。因此,选择90 ℃、5 min再室温、1 h作为杂交温度和时间用于后续实验。
2.4 适配体比色传感策略对鼠伤寒沙门氏菌的响应性能分析结果
在优化的条件下,设置一组具有浓度梯度的鼠伤寒沙门氏菌菌液(10~10CFU/mL)验证该比色适配体传感器的检测性能。直径为(13±2)nm的纳米金粒子在520 nm左右波长处吸收可见光,颜色呈现红色胶体溶液状;而当纳米金聚集后,干扰其局域表面等离子体共振,使得紫外-可见吸收光谱发生红移至620 nm附近,并且胶体金溶液因聚集程度不同而呈现紫色、蓝色或灰色悬液。观察纳米金颜色和测定溶液紫外-可见吸收光谱的变化可用于分析该传感器对沙门氏菌的检测响应性能。实验中,分别测定波长520 nm和620 nm处的吸光度,用/表征纳米金颗粒的团聚程度。如图5A所示,在一定浓度范围内,随着鼠伤寒沙门氏菌浓度增大,纳米金颗粒的团聚程度逐渐减弱即分散性越来越好,与此相对应的是,裸眼观察到体系颜色逐渐由蓝紫变为酒红(插图)。当鼠伤寒沙门氏菌在一定浓度范围(10~10CFU/mL)内,纳米金的团聚程度与其浓度的对数值呈现良好的线性响应(图5B),线性方程为=-0.129 98+1.244 11(=0.992 62)。基于LOD=3/,计算可得检出限为124 CFU/mL。另外,通过将该方法与与其他检测方法相比(表2)发现,该适配体传感器检测灵敏度高、样品消耗量小、操作简便、成本低廉、易于观察检测结果,更具现场检测优势。

图5 适配体传感器检测不同浓度鼠伤寒沙门氏菌表征图(A)和纳米金团聚程度与鼠伤寒沙门氏菌浓度的线性响应图(B)Fig. 5 Results of aptasensor detection of S. typhimurium at different concentrations (A) and linear relationship between aggregation degree of Au nanoparticles and S. typhimurium concentration (B)
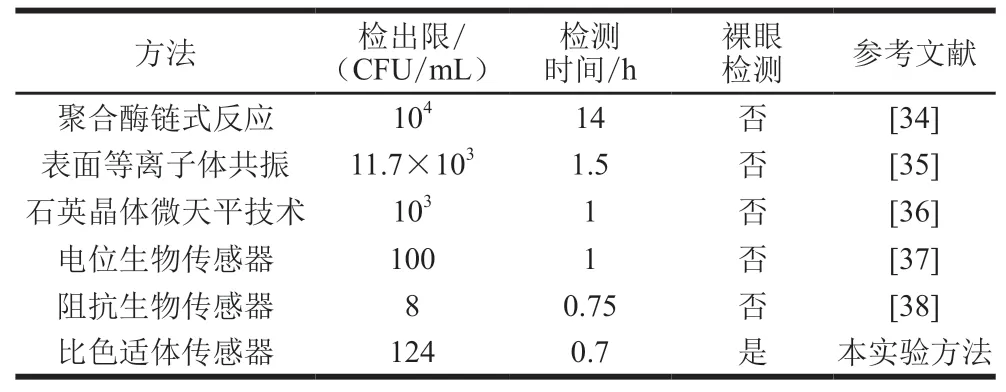
表2 检测鼠伤寒沙门氏菌不同方法的性能比较Table 2 Performance comparison of different methods for the detection of S. typhimurium
2.5 特异性分析结果
特异性的识别对于评估分析实际样品至关重要。用该核酸适配体传感器检测鼠伤寒沙门氏菌(1×10CFU/mL)与其他4 种常见的致病菌(大肠杆菌、金黄色葡萄球菌、李斯特菌、副溶血性弧菌,1×10CFU/mL),验证本方法对鼠伤寒沙门氏菌的检测特异性。如图6所示,管1~4都为对照菌,管5为鼠伤寒沙门氏菌。管5与其他4 管相比呈现明显酒红色,表明纳米金颗粒分散性较好,且颜色对比明显,表明该适配体传感器对鼠伤寒沙门氏菌具有良好的检测特异性。

图6 适配体传感器的特异性分析Fig. 6 Specificity analysis of the aptasensor
2.6 牛奶中沙门氏菌检测性能分析结果
为测试该适配体传感器的实际应用性能,采用本方法检测牛奶样品中的鼠伤寒沙门氏菌。通过在牛奶中添加不同量的鼠伤寒沙门氏菌菌液制备不同浓度的鼠伤寒沙门氏菌牛奶加标样品。根据优化的实验条件,对牛奶样品进行预处理和检测,重复3 次。如表3所示,测得鼠伤寒沙门氏菌的回收率为92.0%~116.4%,相对标准偏差低于5%,表明本方法具有很好的准确性和特异性,可用于牛奶等相关实际样品中鼠伤寒沙门氏菌的检测。
表3 牛奶样品中鼠伤寒沙门氏菌的检测Table 3 Recoveries of S. typhimurium in spiked milk samples

1×102 1.163×102 116.4 1.1 1×104 1.003×104 100.3 1.8 1×106 1.059×106 105.9 3.1 1×108 9.196×108 92.0 4.7
3 结 论
发展了一种基于核酸适配体的纳米金比色传感策略用于鼠伤寒沙门氏菌的可视化快速检测,通过对该方法的可行性、检测性能(检出限为124 CFU/mL)、特异性以及实际样品的检测性能等方面的验证,该适配体传感器具有以下优势:1)利用纳米金颜色特征作为检测信号,不需要连接复杂的信号转换器,实验流程简单,操作简便,可应用于现场检测;2)该适配体传感器的特异性好,对非目标菌不产生比色信号,可应用于实际样品检测,并且能较大程度地避免二次污染产生的干扰信号;3)良好的通用性,只需改变适配体序列,即可实现不同食品安全污染物的检测。总之,该适配体传感器检测结果直观,通过颜色对比即可实现对鼠伤寒沙门氏菌的定性、定量检测,检测成本低、快速便捷,在食品安全快速检测方面具有潜在的应用前景。

