微高压CO2对Pseudomonas deceptionensis CM2的杀菌效应研究
张艺林,刘静飞,任梦梦,牛力源,2,3,张志坚,2,3
1.郑州轻工业大学 食品与生物工程学院,河南 郑州 450001;2.河南省冷链食品质量安全控制重点实验室,河南 郑州 450001;3.食品生产与安全河南省协同创新中心,河南 郑州 450001
0 引言
食品加工环节中的杀菌技术分为热杀菌和非热杀菌。热杀菌是一种常用的杀菌方式,但高温会破坏维生素等热敏性营养成分及风味物质,易对食品营养和感官品质造成不良影响[1-3]。超高压、紫外线、加压CO2等非热杀菌技术具有处理温度低、节能、杀菌效果好等优点,近年来在食品保鲜领域受到广泛关注[4-5]。
CO2具有化学惰性及无腐蚀性、高挥发性、价格低廉等优点,单独作用即可抑制微生物生长[6],但不足以杀死微生物,若将其与压力结合,则能达到更好的杀菌效果,加压CO2杀菌技术在果蔬、肉制品、谷物、液体食品的加工、贮藏与保鲜中的应用已有广泛研究[7-9]。根据压力的不同,加压CO2杀菌技术分为高压CO2(High Pressure Carbon Dioxide,HPCD)杀菌技术和微高压CO2(petit-High Pressure Carbon Dioxide,p-HPCD)杀菌技术。其中,HPCD杀菌技术中的CO2压力通常处于亚临界状态(2.00~7.38 MPa)[10]甚至超临界状态(>7.38 MPa)[11-12],而p-HPCD杀菌技术中的CO2压力通常为0.15~1.30 MPa[13]。由于p-HPCD杀菌技术对CO2压力需求较小,因此具有诸多优势:1)比冷藏技术的抑菌效果好;2)可有效减少加工设备的资金投入;3)可在p-HPCD状态下运输食品,减少运输安全隐患[13]。
目前,关于p-HPCD杀菌技术的相关研究主要集中在日本清酒、传统腌渍食品等生产加工领域[14-15],其对肉制品中常见腐败菌的杀灭效果及作用机制尚不清楚。PseudomonasdeceptionensisCM2是谢美娟等[16]从鸡胸肉中分离出的一株具有较强致腐力的细菌,本文以其为目标菌株,研究p-HPCD杀菌技术在不同压力、保压时间下对P.deceptionensisCM2的杀菌效果及作用机制,以期为p-HPCD杀菌技术在肉制品安全控制领域的应用提供理论参考。
1 材料与方法
1.1 材料与试剂
P.deceptionensisCM2菌株,分离自腐败鸡胸肉,由郑州轻工业大学实验室分离鉴定并保存,已经分子生物学鉴定为P.deceptionensis;高纯CO2(纯度为99.9%),购自河南迎众化工产品有限公司;胰蛋白胨大豆肉汤(TSB)培养基、琼脂粉,购自青岛海博生物技术公司;体积分数为2.5%的戊二醛(AR)、碘化丙啶(PI)、双(1,3-二丁基巴比妥酸)三次甲基氧杂菁(DiBAC4(3))、乙酸异戊酯(AR),购自上海阿拉丁生物科技股份有限公司。
1.2 主要仪器与设备
OST-200 ML型微高压CO2杀菌实验装置,西安欧士特仪器科技有限公司产;20049C型紫外可见分光光度计,北京普析通用仪器责任有限公司产;3K15型台式高速冷冻离心机,德国SIGMA实验室离心机公司产;SW-CJ-1FD型超净工作台,苏州净化设备有限公司产;MQD-S2R型恒温振荡培养箱,上海旻泉仪器有限公司产;MERLIN Compact型场发射扫描电镜(FE-SEM),德国Zeiss公司产;HUS-5GB型真空蒸镀仪,日本日立公司产;NanoReady型超微量紫外可见分光光度计,杭州遂真生物技术有限公司产;LDZM-60KCS型立式压力灭菌锅,上海申安医疗器械厂产;Tecan Spark 20 M型多功能酶标仪,瑞士Tecan公司产;Eclipse 80i型荧光显微镜,日本尼康(Nikon)产。
1.3 实验方法
1.3.1 菌悬液制备将冻存的P.deceptionensisCM2菌株接种至TSB培养液中,于25 ℃条件下振荡培养2~3 d,然后接种至TSA(在TSB中加入琼脂粉制得)固体培养基,于25 ℃恒温培养箱中培养3 d。取单个菌落接种至新鲜TSB培养液中,于25 ℃条件下振荡培养,并测定菌液在600 nm处的吸光度(OD600),培养至OD600为0.9~1.0,备用。
1.3.2p-HPCD处理加压CO2装置示意图如图1所示,其中,1为CO2气瓶,2为减压阀,3为压力显示器,4为温度显示器,5为CO2反应釜,6为恒温水浴锅。将加压CO2反应釜预热至25 ℃,将P.deceptionensisCM2菌悬液加入无菌离心管中,打开离心管口并置于反应釜中;通入高纯CO2,加压至实验所需压力(0.5 MPa、0.9 MPa和1.3 MPa),保压一定时间(2 h、4 h和6 h)后,打开减压阀,从反应釜中取出样品进行后续实验分析。每个处理均重复3次。
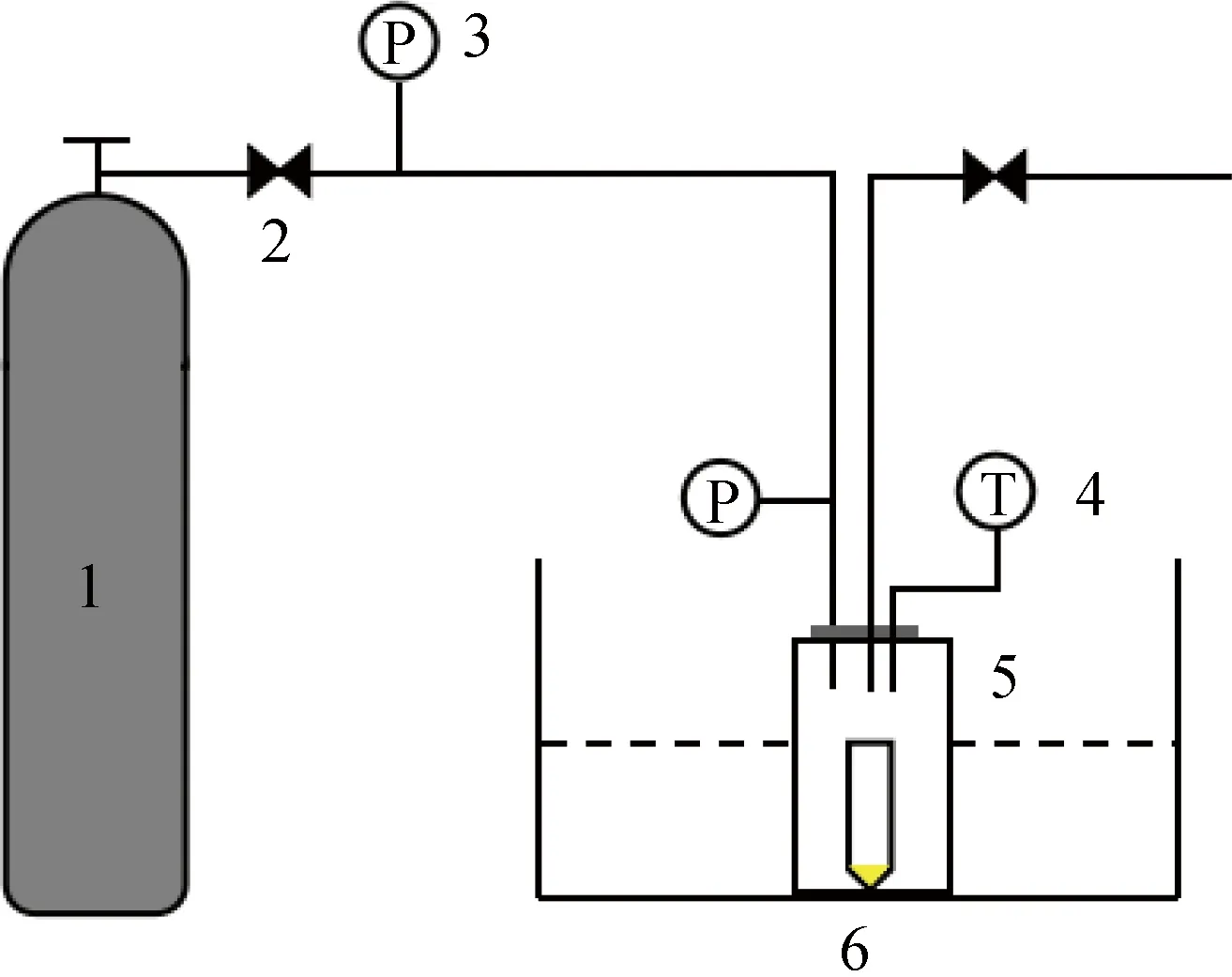
图1 加压CO2装置示意图Fig.1 Schematic of pressurized CO2 setup
1.3.3 微生物菌落计数将p-HPCD处理后的菌液用磷酸缓冲盐溶液(PBS缓冲液,0.01 mol/L)进行10倍稀释,选择合适的稀释度并吸取0.1 mL稀释样品滴于TSA平板上,使用涂布玻璃棒涂布均匀。于25 ℃条件下培养2~3 d后,进行菌落计数,结果以log10CFU/mL表示。
1.3.4 菌体细胞形态观察取1 mL菌悬液,于4 ℃、3500 r/min条件下离心15 min,弃上清液,加入PBS缓冲液漂洗细胞2次,然后重悬浮于PBS缓冲液中。参考Q.S.Xiang等[17]的方法,采用FE-SEM观察p-HPCD处理对P.deceptionensisCM2细胞形态的影响。在25 ℃、1.3 MPa条件下,将P.deceptionensisCM2菌液经p-HPCD分别处理0 h、2 h、4 h和6 h后,于4 ℃、8000 r/min条件下离心5 min,收集菌体;用PBS缓冲液(pH值为7.2~7.4)清洗菌体3次,于4 ℃,8000 r/min条件下离心5 min,收集菌体;在菌体中加入1 mL预冷的2.5%戊二醛,于4 ℃冰箱中避光放置4 h后,用PBS缓冲液清洗菌体3次;分别用体积分数为30%、50%、70%、80%、90%和95%的乙醇溶液对菌体进行梯度洗脱15 min,再用乙醇洗脱2次,乙酸异戊酯置换2次,每次20 min,于4 ℃,8000 r/min条件下离心5 min,收集菌体;将菌体滴加在干净的硅片上,于50 ℃烘箱中烘干,采用真空蒸镀仪喷金150 s,采用FE-SEM进行观察,加速电压为20 kV。
1.3.5 胞外核酸和蛋白渗漏量的测定在25 ℃、1.3 MPa条件下,将悬浮于PBS缓冲液中的P.deceptionensisCM2经p-HPCD分别处理0 h、2 h、4 h和6 h后,取出样品,于3500 r/min条件下离心15 min,收集上清液,使用超微量紫外可见分光光度计测定其在260 nm和280 nm处的吸光度,计算胞外核酸和蛋白渗漏量/(μg·mL-1)。
1.3.6 细胞膜完整性的测定参考相启森等[18]的方法,将悬浮于PBS缓冲液中的P.deceptionensisCM2经p-HPCD于25 ℃、1.3 MPa条件下分别处理0 h、2 h、4 h和6 h后,加入终浓度为3 μmol/L的PI染液,在37 ℃黑暗处孵育15 min的菌悬液于4 ℃,10 000 r/min条件下离心10 min,用PBS缓冲液清洗菌体2次后重悬浮于PBS缓冲液中,立即用多功能酶标仪在535 nm激发波长和605 nm发射波长处检测菌悬液的荧光强度,以63 ℃处理30 min的细菌细胞作为阳性对照。PI的相对荧光强度(FPI)计算公式如下。
FPI=F1/F0×100%
式中:F1为p-HPCD处理组细胞荧光强度,F0为阳性对照组细胞荧光强度。
参考相启森等[18]的方法,利用荧光显微镜对PI染色的细菌进行观察。将悬浮于PBS缓冲液中的P.deceptionensisCM2经p-HPCD于25 ℃、1.3 MPa条件下处理6 h后,加入终浓度为3 μmol/L的PI染液,在37 ℃黑暗处孵育15 min。将染色后的细菌彻底清洗以除去游离探针,使用适当激发/发射过滤器的荧光显微镜观察并拍照。
1.3.7 细胞膜电位的测定参考L.Y.Niu等[19]的方法,将悬浮于PBS缓冲液中的P.deceptionensisCM2经p-HPCD于25 ℃、1.3 MPa条件下分别处理0 h、2 h、4 h和6 h。用PBS缓冲液制备EDTA溶液(4 mmol/L),以其为稀释液将DiBAC4(3)染液稀释至质量浓度为50 μg/mL,取50 μL稀释后的DiBAC4(3)染液加入菌悬液中并使DiBAC4(3)染液终质量浓度为2.5 μg/mL,将该菌悬液在37 ℃黑暗处孵育15 min,然后于4 ℃、10 000 r/min离心10 min,收集菌体,用PBS缓冲液清洗菌体2次后重悬浮于PBS缓冲液中,立即用多功能酶标仪在490 nm激发波长和516 nm发射波长处检测细菌悬浮液的荧光强度,DiBAC4(3)的相对荧光强度(FDiBAC4(3))计算公式如下。
FDiBAC4(3)=F1/F0×100%
参考相启森等[18]的方法,利用荧光显微镜对DiBAC4(3)染色的细菌进行观察。将悬浮于PBS缓冲液中的P.deceptionensisCM2经p-HPCD于25 ℃、1.3 MPa条件下处理6 h后,加入终质量浓度为2.5 μg/mL的DiBAC4(3)染液,在37 ℃黑暗处孵育15 min。将染色后的细菌彻底清洗以除去游离探针,使用适当激发/发射过滤器的荧光显微镜观察并拍照。
1.4 统计分析
每个实验均重复3次,数据结果以(平均值±标准差)表示。使用IBM SPSS 20.0软件,通过单因素方差分析(ANOVA)、Duncan’s多重比较法对实验数据进行差异显著性分析。以5%的比较错误率作为差异显著的标准(P<0.05)。
2 结果与讨论
2.1 不同压力和保压时间对p-HPCD杀菌效果的影响分析
不同压力和保压时间下,p-HPCD处理对P.deceptionensisCM2的杀菌效果如图2所示。由图2可以看出,p-HPCD能够有效杀灭P.deceptionensisCM2,且杀菌效果与压力和保压时间有关。在25 ℃条件下,经0.5 MPa、0.9 MPa和1.3 MPa处理2 h后,P.deceptionensisCM2活菌数分别降低了0.66 log10CFU/mL、1.04 log10CFU/mL和1.48 log10CFU/mL。在相同的保压时间下,p-HPCD的杀菌效果与压力呈正相关,这与沈培奇[20]观察到的结果一致,即在25 ℃条件下使用加压CO2(1~7 MPa)处理生理盐水中的大肠杆菌60 min,大肠杆菌的失活率随CO2压力的升高而增加。这是因为压力会影响CO2在液态介质中的溶解速率及溶解度:CO2压力的升高会导致反应体系中CO2密度增大,溶解速率及溶解度也随之增加,而较高密度的CO2会破坏细胞膜的结构和功能,使CO2更易渗透进入微生物细胞,引起胞内pH值下降、代谢紊乱等,进而导致微生物失活[21]。
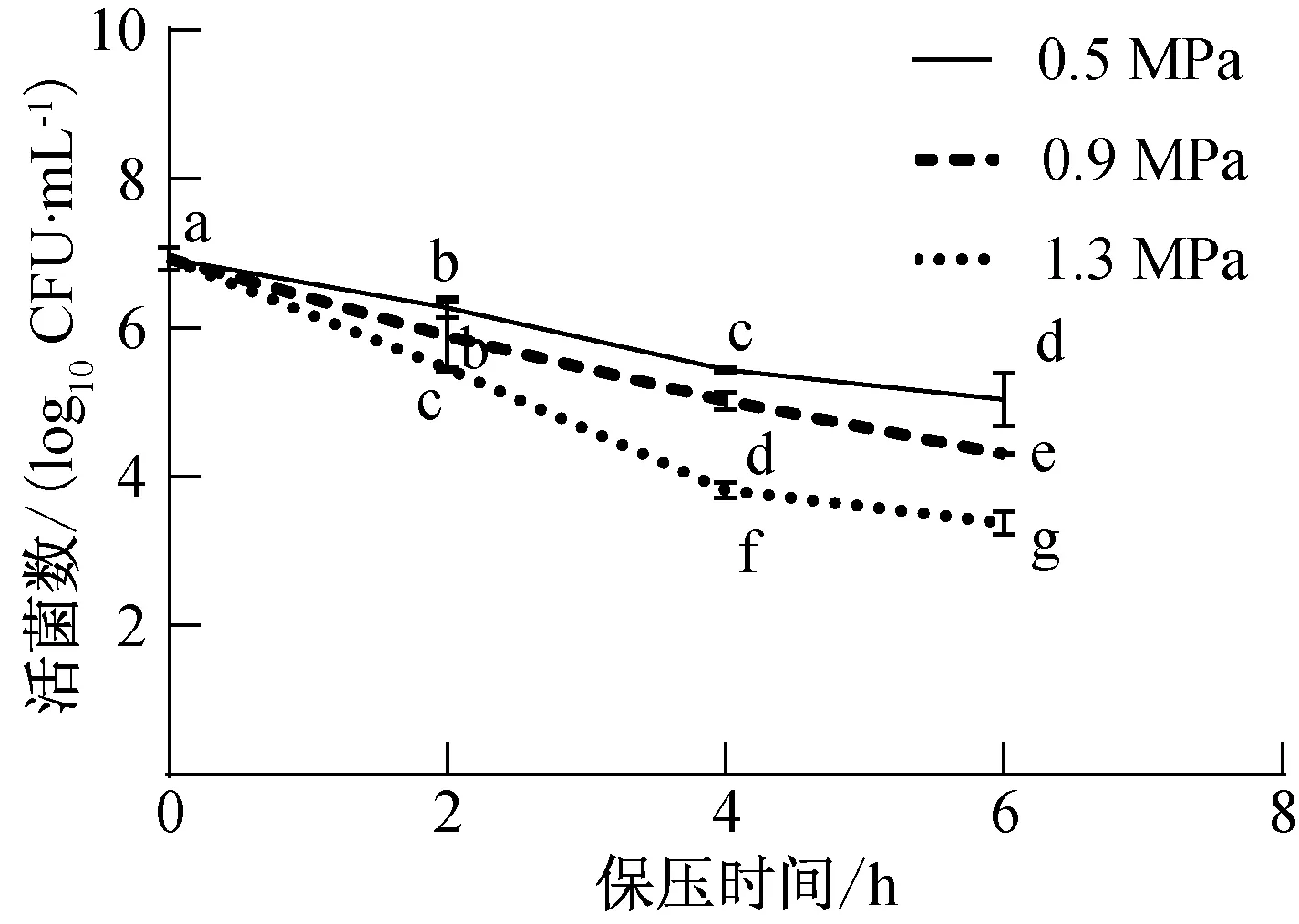
图2 p-HPCD处理对P.deceptionensis CM2的杀菌效果Fig.2 Bactericidal effect of P.deceptionensis CM2 after p-HPCD treatment
保压时间是影响p-HPCD杀菌效果的另一个重要因素。在1.3 MPa条件下,经p-HPCD分别处理2 h、4 h和6 h后,P.deceptionensisCM2数量与处理前相比分别减少了2.49 log10CFU/mL、2.52 log10CFU/mL和3.65 log10CFU/mL。同样地,在0.5 MPa和0.9 MPa条件下,经p-HPCD处理后的细菌失活率也随保压时间的延长呈现相同趋势。F.Y.Xu等[22]也报道了相似的结果,HPCD在25 MPa、40 ℃条件下对Vibrioparahaemolyticus分别处理10 min和40 min后,其活菌数分别降低5.69 log10CFU/mL和7.02 log10CFU/mL。
由此可见,CO2压力和保压时间是影响p-HPCD对P.deceptionensisCM2杀菌效果的重要因素。此外,处理温度、处理基质、细菌初始浓度等也可能对p-HPCD杀灭P.deceptionensisCM2的效果产生影响,需要后续进一步深入研究。
2.2 p-HPCD处理对P.deceptionensis CM2细胞形态的影响分析
在25 ℃、1.3 MPa条件下,经p-HPCD处理后P.deceptionensisCM2的FE-SEM图像如图3所示。由图3a)可以看出,未经p-HPCD处理的P.deceptionensisCM2细胞具有完整的细胞结构,呈表面光滑的棒状;由图3b)可以看出,p-HPCD于1.3 MPa处理2 h后,P.deceptionensisCM2细胞表面出现轻微皱缩;由图3 c)和d)可以看出,随着保压时间的延长,细胞表面皱缩加重,细胞膜出现裂痕,甚至出现细胞外膜与质膜分离,而这可能会导致细胞内物质流出,影响P.deceptionensisCM2细胞的正常代谢。由FE-SEM观察到的p-HPCD对P.deceptionensisCM2细胞的损伤进程与上述杀菌效果结论一致。周先汉等[23]也发现,与HPCD处理前相比,经HPCD处理的大肠杆菌细胞表面出现了许多细密的小坑,表面也变得更加粗糙。

图3 p-HPCD处理后P.deceptionensis CM2的FE-SEM图像Fig.3 FE-SEM images of P.deceptionensis CM2 after p-HPCD treatment
2.3 p-HPCD处理对细胞膜通透性的影响分析
通过测定胞外核酸和蛋白渗漏量可评价p-HPCD处理对细胞膜通透性的影响[24]。p-HPCD处理对P.deceptionensisCM2细胞膜通透性的影响如图4所示。由图4可以看出,未处理组细胞的胞外核酸和蛋白的渗漏量分别为1.71 μg/mL和46.67 μg/mL。然而,在1.3 MPa条件下经p-HPCD处理会导致胞外核酸和蛋白渗漏量随保压时间的延长而增加。经p-HPCD处理6 h后,胞外核酸和蛋白的渗漏量分别增加了10.95 μg/mL和83.83 μg/mL,这与P.deceptionensisCM2失活率增加的结论一致。如前所述,通过FE-SEM观察到了随着保压时间的延长,细胞膜损伤加重(图2),损伤程度与胞外核酸和蛋白渗漏量的增加相符合。结合FE-SEM结果可以推断,细胞膜是p-HPCD杀灭P.deceptionensisCM2的主要靶点之一。S.R.Kim等[25]也发现,随着HPCD保压时间的延长,菌悬液在260 nm和280 nm波长处的吸光度均显著增加。这可能是因为CO2分子具有亲脂性、低黏度和高扩散率,因此在压力的作用下可能会扩散到细胞膜的脂质双分子层中,从而改变P.deceptionensisCM2细胞膜的结构和功能,并对其通透性产生影响[26]。
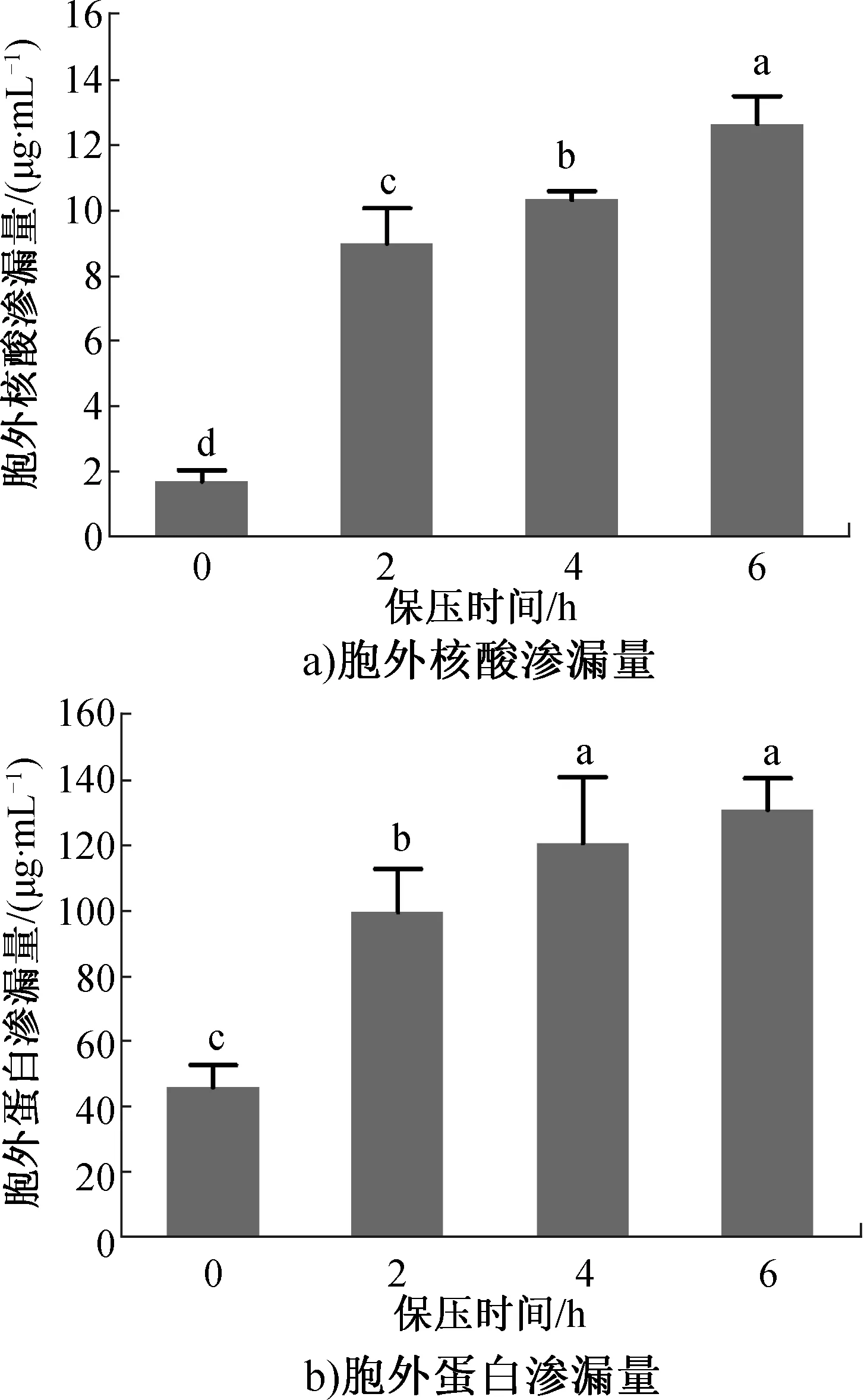
图4 p-HPCD 处理对P.deceptionensis CM2细胞膜通透性的影响Fig.4 The effects of p-HPCD treatment on cell membrance permeability of P.deceptionensis CM2
2.4 p-HPCD处理对细胞膜完整性的影响分析
PI是一种疏水性的荧光染料,当细胞膜通透性增强时,它能够进入细胞,与细胞内的遗传物质结合并发射出红色荧光[27]。p-HPCD处理对P.deceptionensisCM2细胞膜完整性的影响如图5所示。由图5a)可以看出,P.deceptionensisCM2中的FPI随着保压时间的延长而增强。与未处理细胞相比,p-HPCD(1.3 MPa)保压2 h、4 h和6 h后,P.deceptionensisCM2细胞中的FPI分别显著增加了90.58%、114.98%和122.23%(P<0.05)。这表明p-HPCD处理可诱导P.deceptionensisCM2细胞膜通透性增加,证实了FE-SEM观察到的细胞形态改变。由图5b)可以看出,在具有完整细胞膜的细胞中,PI阳性细胞数量很少。而p-HPCD处理6 h后,红色荧光细胞的比例增加,这表明细胞膜的完整性受到破坏。H.Li等[28]也发现,在HPCD处理后,细菌失活率与FPI呈正相关。P.deceptionensisCM2细胞膜完整性的破坏会导致胞内核酸和蛋白渗漏,进而影响细胞的正常生长和代谢,最终导致微生物死亡。

图5 p-HPCD处理对P.deceptionensis CM2细胞膜完整性的影响Fig.5 The effects of p-HPCD treatment on cell membrance integrity of P.deceptionensis CM2
2.5 p-HPCD处理对细胞膜电位的影响分析
细胞膜电位是存在于活细胞细胞膜两侧的电位差,是细胞膜通透性变化的先兆。细胞膜电位在细菌的能量转化、pH稳态、主动转运、环境感知等生理行为的调节中起着重要作用[29]。DiBAC4(3)是一种膜电位敏感的染料,能够进入去极化细胞并通过与胞内蛋白结合表现出增强的荧光[30]。p-HPCD处理对P.deceptionensisCM2细胞膜电位的影响如图6所示。由图6a)可以看出,P.deceptionensisCM2细胞经p-HPCD(1.3 MPa)处理不同保压时间后,细胞中的FDiBAC4(3)随着保压时间的延长而增强。经p-HPCD处理2 h、4 h和6 h后,胞内FDiBAC4(3)分别增加至106.09%、110.66%和111.94%,与P.deceptionensisCM2胞内的FPI逐渐增强的趋势相似。L.Y.Niu等[31]研究发现,p-HPCD(1.3 MPa,30 ℃)处理S.typhimurium3 h后,细胞中的FDiBAC4(3)显著强于未处理组。荧光显微镜观察证实了上述结果(见图6b)),p-HPCD处理后绿色荧光细胞比例明显多于未处理细胞,胞内DiBAC4(3)累积量的增加表明p-HPCD处理导致细胞膜电位发生了去极化,膜内外离子梯度发生的变化影响了细胞的正常代谢活动,从而导致细胞活性降低。

图6 p-HPCD处理对P.deceptionensis CM2细胞膜电位的影响Fig.6 The effects of p-HPCD treatment on cell membrance potential of P.deceptionensis CM2
3 结论
本文以P.deceptionensisCM2为目标菌株,通过FE-SEM、荧光显微镜等,研究了p-HPCD杀菌技术在不同压力、保压时间下对P.deceptionensisCM2的杀菌效果,并对其杀菌机制进行了初步探索。结果表明,经p-HPCD在1.3 MPa、25 ℃条件下分别保压2 h、4 h和6 h后,P.deceptionensisCM2活菌数分别降低了1.48 log10CFU/mL、3.11 log10CFU/mL和3.55 log10CFU/mL。p-HPCD在1.3 MPa、25 ℃条件下保压4 h后,P.deceptionensisCM2细胞表面发生明显的皱缩,出现了裂痕,胞外核酸和蛋白渗漏量升高,细胞膜通透性及细胞膜电位发生了改变,而这些都可能是p-HPCD杀灭P.deceptionensisCM2的重要机制。该结果为p-HPCD杀菌技术在食品加工、贮藏和保鲜中的应用提供了理论依据。在今后的研究中,可将p-HPCD与其他技术相结合,在最大限度保持食品品质的同时,缩短杀菌时间,提高杀菌效率,从而推动p-HPCD杀菌技术在食品工业中的广泛应用。

