糖化血红蛋白联合吸烟史预测老年OSAHS 合并房性心律失常患者的临床价值研究
郭 娜,闫新欣,李向楠,易 忠
(航天中心医院老年医学一科,北京 100049)
睡眠呼吸暂停低通气综合征(obstructive sleep apnea hypopnea syndrome,OSAHS)是指睡眠过程上出现气道反复塌陷、阻塞,引起呼吸暂停、低通气,导致间歇性低氧血症、高碳酸血症、睡眠结构紊乱的临床综合征,成年人群的患病率为2%~4%,随着年龄的增长患病率呈升高趋势,近年来随着医学的发展OSAHS 逐渐被认识并研究[1]。OSAHS 是心血管系统疾病独立危险因素,与心肌梗死、心力衰竭、心律失常等疾病密切相关,可增加心血管疾病的发生率,尤其在老年人群中。研究发现老年OSAHS 患者心律失常发生率显著升高[2],发生心律失常的类型以房性心率失常多见,OSAHS患者比普通人群更容易发生心房颤动[3-5]。研究表明房颤患者的致残率和致死率高,导致社会及经济负担明显增大[6]。但目前由于我国不同地域医疗条件的差异、患者及部分医护人员对疾病认识不足,尤其在老年科普通门诊接诊患者时,由于问诊时间有限、老年患者依从性差及随诊困难,很难通过筛查的方式广泛开展24小时动态心电图检查以明确老年OSAHS 患者是否合并心律失常,往往导致漏诊现象。本研究试图分析糖化血红蛋白、吸烟史与OSAHS 合并房性心律失常的关系,评估两者对OSAHS 合并房性心律失常的预测价值,使条件受限地区能尽早筛查出OSAHS 合并房性心律失常的人群,并尽早干预,从而降低房性心律失常所造成的严重并发症的发生风险。
1 资料与方法
1.1 一般资料回顾性分析2018 年11 月至2020 年1 月于航天中心医院老年科就诊的阻塞性睡眠呼吸暂停低通气综合征的老年患者102 例,年龄大于60 岁并进行多导睡眠监测(PSG)最终确诊为阻塞性呼吸暂停低通气综合征的患者78 例,其中房性心律失常组30 例,对照组48 例。OSAHS 诊断标准:根据2011 年OSAHS 诊断指南[7],根据病史、体征及多导睡眠监测仪(德国SOMNO,国械注进20182212039,型号:SOMNO medics)监测结果,临床有典型夜间睡眠打鼾伴呼吸暂停、日间嗜睡,Epworth嗜睡量表评分≥9 分等症状,查体可见上气道任何部位的狭窄及阻塞,呼吸暂停通气指数(Apnea hypopnea indes,AHI)≥5 次/h;或对于日间嗜睡不明显(Epworth Sleepiness Scale,ESS 评分<9 分)者,AHI ≥10 次/h,或≥5 次/h,存在认知功能障碍、高血压、冠心病、脑血管疾病、糖尿病和失眠等1 项或1 项以上OSAHS 合并症。排除标准:①中枢性或混合性睡眠呼吸暂停低通气综合征;②合并严重感染、肿瘤、肝肾等器官功能障碍疾病;③长期服用激素、免疫抑制剂;④原发性鼾症、肥胖低通气综合征、上气道阻力综合征。房性心律失常诊断标准:由心房引起的心动频率和节律的异常,房性心律失常包括房性期前收缩、房性心动过速、心房扑动、心房颤动[8]。进行24 h 动态心电图检查,筛选出心房颤动、心房扑动、房性早搏大于500 次/24 h、房性心动过速患者作为房性心律失常组。通过电子病历HIS 系统,收集所有患者一般资料,包括年龄、性别、BMI(体质量/身高2)、高血压史、冠心病史、糖尿病史、吸烟史、饮酒史等。患者完善睡眠监测前后2 d 内抽取静脉血送检,包括血脂、空腹血糖、糖化血红蛋白(HbA1c)。本研究经航天中心医院医学伦理委员会审批通过。
1.2 方法
1.2.1 多导睡眠监测所有患者均使用多导睡眠监测仪(德国SOMNO,国械注进20182212039,型号:SOMNO medics)进行整夜睡眠监测,检查当天禁饮酒、服用安眠药、镇静药。监测时间为22:00 至次日06:00,监测时间≥7 h,监测每小时AHI、睡眠效率、平均呼吸暂停时间、最低血氧饱和度、平均血氧饱和度、血氧低于90%时间百分比、夜间平均心率等参数,结果由有经验的呼吸内科医师进行分析并出具报告,按AHI 程度分为轻度(AHI 5~15 次/h)、中度(AHI 15~30 次/h)、重度(AHI>30 次/h)。
1.2.2 24 h 动态心电图监测所有患者采用24 h 动态心电图监测,由心电图专科医师安装动态心电图电极片:充分向患者解释具体操作过程,选择卧位,暴露心前区,正确连接仪器和患者,记录患者12 导联动态心电图24 h,记录期间患者可自由活动、不受限制,维持患者一般日常活动,即时记录患者的心律失常情况。将患者书面描述的速度设为25 mm/s,心电图基线稳定,图像清晰,人工对干扰伪差审核并排除干扰,全面分析获得的心电图像[9]。
1.2.3 分组将78 例阻塞性睡眠呼吸暂停低通气综合征的老年患者按是否有房性心律失常,分为OSAHS 合并房性心律失常组和单纯OSAHS 组,比较两组间患者一般资料、生化指标、糖化血红蛋白及合并症情况。
1.3 统计学方法所有患者资料准确录入Excel 表中进行管理。采用SPSS 22.0 统计软件进行数据分析,符合正态分布的连续性计量资料以表示,组间比较采用成组t检验;计数资料以相对数表示,组间比较采用χ2检验;采用Pearson 相关分析,绘制空腹血糖与糖化血红蛋白线性曲线,并分析吸烟史与高血压史、冠心病史的关系,最终选定糖化血红蛋白及吸烟史作为预测OSAHS 合并房性心律失常的指标,绘制受试者操作特征(ROC)曲线,计算ROC 曲线下面积(AUC)及最佳截断值;利用Logistic回归模型建模,用保存的概率作为单独变量绘制ROC 曲线,分析两者联合预测OSAHS 合并房性心律失常的价值。P<0.05 表示差异有统计学意义。
2 结果
2.1 OSAHS 合并房性心律失常的类型OSAHS 合并房性心律失常的发生率为38%(30/78),其中以房性早搏最为常见,其次为心房颤动,见图1。
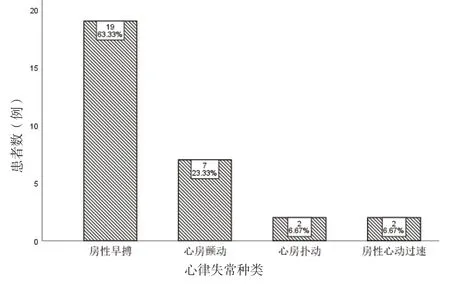
图1 OSAHS 合并房性心律失常的类型
2.2 研究人群的一般资料比较OSAHS 合并房性心律失常组中年龄、空腹血糖、糖化血红蛋白、左房前后径显著高于对照组,OSAHS 合并房性心律失常的发生与吸烟史、高血压史、冠心病史有关,差异均有统计学意义(P<0.05)。两组患者间性别、BMI、AHI、最低血氧饱和度、嗜睡量表评分(Epworth Sleepiness Scale,ESS)、低密度脂蛋白、糖尿病史、OSAHS 的严重程度比较,差异无统计学意义(P>0.05),见表1、表2。空腹血糖与糖化血红蛋白呈线性关系,见图2,Spearman 相关性分析提示(r值=0.583,P<0.01)两者呈正相关。吸烟史与房性心律失常、冠心病史、高血压史均呈正相关(P<0.05),见表3。
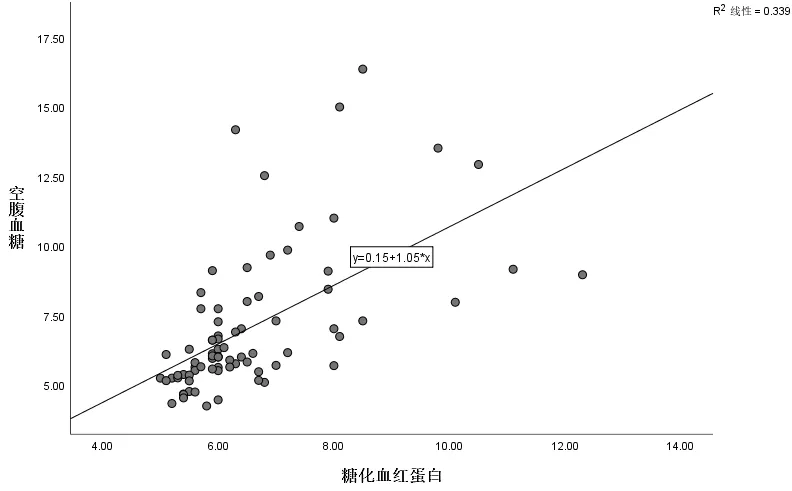
图2 空腹血糖与糖化血红蛋白的呈线性关系
表1 两组患者数值变量一般资料比较( ±s)
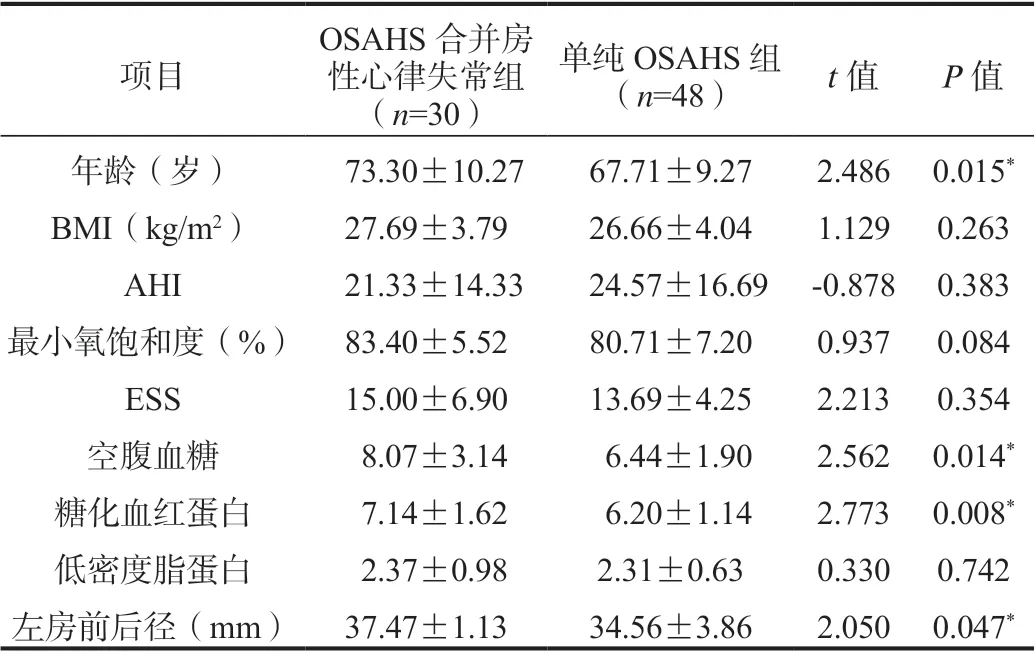
表1 两组患者数值变量一般资料比较( ±s)
注:OSAHS:阻塞性睡眠呼吸暂停低通气综合征;BMI:体质量指数;AHI:呼吸暂停低通气指数;ESS:Epworth 嗜睡量表评分。*P<0.05。
项目OSAHS 合并房性心律失常组(n=30)单纯OSAHS 组(n=48) t 值 P 值年龄(岁) 73.30±10.27 67.71±9.27 2.486 0.015*BMI(kg/m2) 27.69±3.79 26.66±4.04 1.129 0.263 AHI 21.33±14.33 24.57±16.69 -0.878 0.383最小氧饱和度(%) 83.40±5.52 80.71±7.20 0.937 0.084 ESS 15.00±6.90 13.69±4.25 2.213 0.354空腹血糖 8.07±3.14 6.44±1.90 2.562 0.014*糖化血红蛋白 7.14±1.62 6.20±1.14 2.773 0.008*低密度脂蛋白 2.37±0.98 2.31±0.63 0.330 0.742左房前后径(mm) 37.47±1.13 34.56±3.86 2.050 0.047*
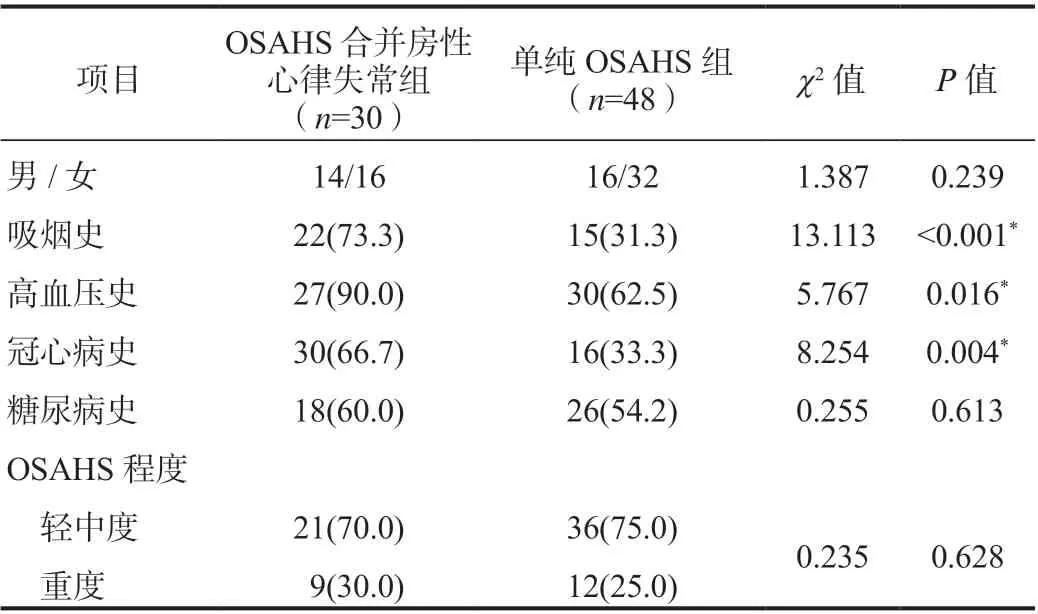
表2 两组患者分类变量资料比较[ 例(%) ]
2.3 糖化血红蛋白和吸烟史预测OSAHS 合并房性心律失常的ROC 曲线糖化血红蛋白预测OSAHS 合并房性心律失常的AUC 为0.704(95%置信区间:0.577~0.831,P=0.003),敏感度、特异度分别为73.7%、70.8%,糖化血红蛋白对于诊断OSAHS 合并房性心律失常是有诊断效率的。吸烟史预测OSAHS 合并房性心律失常的AUC为0.710(95%置信区间:0.591~0.830,P=0.002),敏感度、特异度分别为73.3%、68.7%,吸烟史对于诊断老年OSAHS 合并房性心律失常也是有诊断效率的。计算糖化血红蛋白和吸烟史对房性心律失常的联合诊断因子,联合诊断因子=吸烟史+糖化血红蛋白×0.535/1.919,联合诊断因子预测OSAHS 合并房性心律失常AUC 为0.806(95%置信区间:0.707~0.904,P=0.000),敏感度、特异度分别为 86.7%、66.8%,联合诊断的诊断效率最高,见表4、图3。
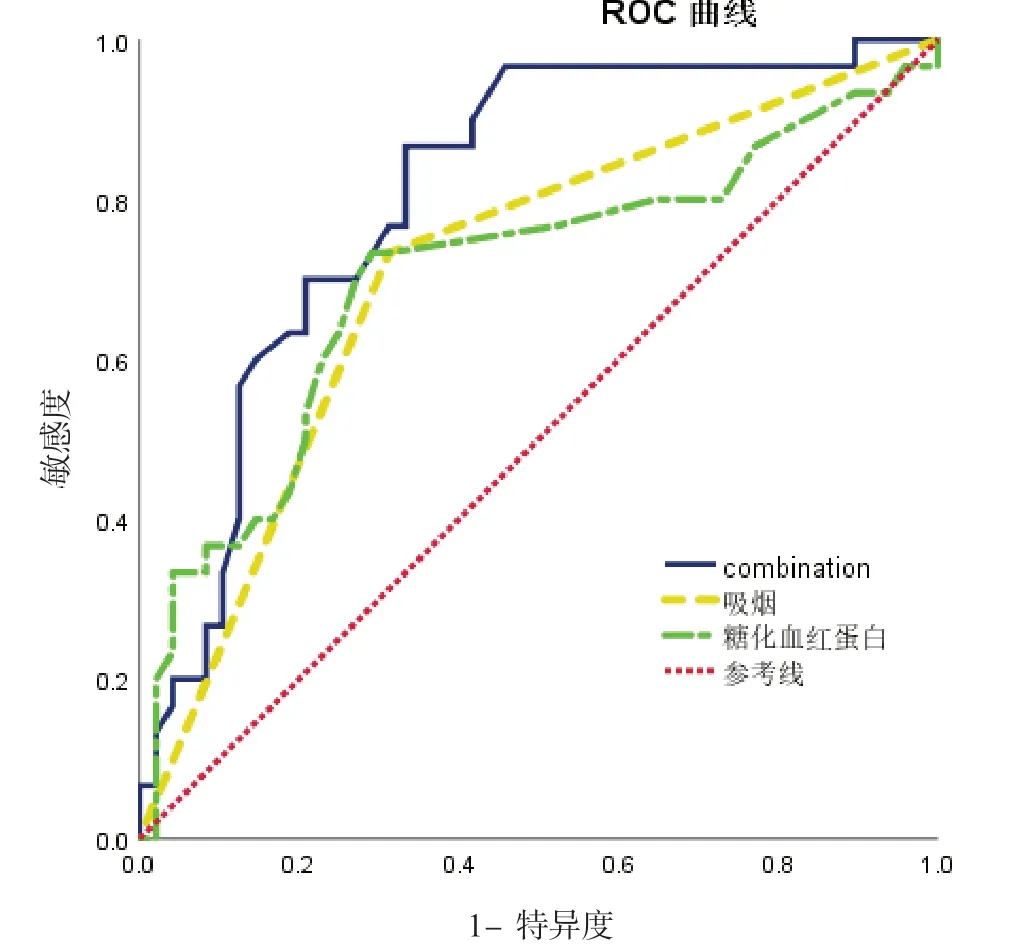
图3 糖化血红蛋白、吸烟史及二者联合诊断因子预测老年OSAHS 合并房性心律失常的ROC 曲线
3 讨论
随着年龄的增长,房颤发病率及致残率明显升高,90%以上的房颤患者为65 岁以上的老年患者[10],我国学者周星佑等人的研究发现:社区老年人对房颤的知晓率低、认识不足[11]。国内多地流行病学调查结果表明OSAHS 在老年群体中发病率较高[12-16],且OSAHS 是心房颤动的独立危险因素[17],可导致夜间间歇性缺氧及睡眠结构破坏,加重或引起多种心血管疾病[18]。国外多项研究也证实:通过持续正压通气(continuous positive airway pressure,CPAP)治疗可降低永久性房颤的发生率[19],并能降低房颤射频消融后的复发[20]。国内学者赵兴胜等人[21]的研究表明,老年OSAHS 组心律失常发生率显著高于非OSAHS 组(71.8%对53.3%,P<0.01),其中以房性心律失常多见。房性心律失常包括房性心动过速、房性早搏、房颤、房扑,过去人们认为房性早搏是良性的,临床意义不大,但人们逐渐认识到频繁的房性早搏可能是房性心动过速和心房颤动发生的独立预测因子。因此,本研究关注于房性心律失常,希望更早发现房颤或房颤前期。
OSAHS与房性心律失常之间有一些共同的危险因素,如性别、年龄、吸烟史、高血压、糖尿病、冠心病等[6,22-25]。本研究发现年龄、吸烟史、高血压史、冠心病史与OSAHS合并房性心律失常有关,但并未发现性别、BMI、ESS、低密度脂蛋白有相关性,考虑可能与本研究人群年龄均大于60 岁,且部分研究对象合并营养不良、认知功能障碍有关,因此在涉及营养状态及主观评估指标时与既往研究不一致。
2 型糖尿病(T2DM)合并睡眠呼吸障碍综合征(SAS)发生心律失常的概率高于单纯SAS 组,血糖控制水平尤其是糖化血红蛋白水平与多种心律失常症状相关,其机制可能为高血糖导致氧化应激状态,从而导致内皮细胞及自主神经功能损伤,引起心率变异[26]。这与本研究结果一致,本研究还发现,患者是否曾经有糖尿病史与OSAHS 患者合并房性心律失常无关,但空腹血糖水平及糖化血红蛋白水平与房性心律失常发生有关,且空腹血糖与糖化血红蛋白之间呈线性相关。考虑糖化血红蛋白可以反映近三个月的血糖控制水平,因此本研究中选择糖化血红蛋白预测OSAHS 合并房性心律失常的ROC 曲线,其敏感度和特异度分别为73.7%、70.8%,具有一定的预测价值。
吸烟是中国老年男性的主要死因之一,一项前瞻性研究发现:吸烟可增加老年人群总死亡率及与烟草相关疾病的死亡率[27]。吸烟对心血管疾病及肺部疾病影响较大,但有Meta 分析也发现吸烟与房颤的发生相关,具有吸烟史的人群与未吸烟人群相比,房颤的发生风险增加了9%[28]。烟草中的有害成分尼古丁可增加血中儿茶酚胺的浓度、促进心房纤维化、直接阻断内在的K+通道等,这可能是烟草诱发心律失常的机制。本研究同样发现吸烟史与老年OSAHS合并房性心律失常、冠心病史、高血压史均呈正相关。以吸烟史预测老年OSAHS 合并房性心律失常的ROC 曲线下面积为0.710,敏感度73.3%,特异度68.7%,具有一定的预测价值。
4结论
本研究Logistic回归分析发现,糖化血红蛋白和吸烟史均是老年OSAHS 患者合并房性心律失常的影响因素,通过回归建模,测定两者的联合诊断因子,绘制联合诊断因子预测的ROC 曲线,联合诊断因子最佳截断值为0.533,敏感度和特异度分别为86.7%、66.8%,优于单指标预测价值。因此,我们建议在老年科门诊,对血糖控制不理想且合并吸烟史的老年OSAHS 患者常规进行24 h 动态心电图筛查,以尽早发现房性心律失常的风险,尤其心房颤动,并尽早给予干预治疗,可能是一种更安全和无创伤的预防和治疗房颤的方式。本研究的不足之处在于样本量少,需大样本资料进一步研究证实。

