血清类风湿性关节炎相关瓜氨酸化蛋白检测在类风湿关节炎诊断中的应用价值研究
赵宏帅,罗 清,付 鹏,高玉洁,叶玉涛,饶佳月,李俊明*
(1.南昌大学第一附属医院检验科;2.南昌大学公共卫生学院,江西 南昌 330006)
类风湿关节炎(rheumatoid arthritis,RA)是以关节损伤为主要临床表现的一种慢性自身免疫性疾病,其主要病理特点为滑膜组织的炎症增生和骨侵蚀,RA 的发病机制与多种细胞、蛋白质有关[1]。RA 早期可致关节肿胀、疼痛,若未得到及时治疗可进一步导致关节畸形和功能的丧失,最终导致患者残疾、丧失劳动力,因此RA 的早期准确诊断对提高患者的生活质量和生存率非常重要[2]。
目前RA 的诊断主要依据临床表现、影像学检查和实验室指标的检测,RA 的临床个体差异大、轻重程度不一,而在RA 早期影像学改变不明显,所以实验室指标对RA 的早期诊断尤为重要。根据2010 年美国风湿病学院(ACR)和欧洲风湿病联盟(EULAR)合作修订的RA 的分类标准[3],RA 诊断的实验室指标主要是类风湿因子(RF)和抗循环瓜氨酸化蛋白抗体(Anti-CCP)。然而,RF 诊断RA 的特异度并不是很理想,在其他的自身免疫性疾病和部分感染性疾病中也可能增高。Anti-CCP 是目前诊断RA特异度最好的实验室指标,但敏感度并不理想。因此,寻找新的RA 诊断标志物对于进一步促进RA 的诊断具有重要价值。蛋白质的瓜氨酸化是蛋白质肽链中的精氨酸残基转化为瓜氨酸残基进而导致蛋白质三维结构发生变化的过程。由于发生了肽链基团和蛋白质的结构改变,蛋白质的瓜氨酸化可导致免疫细胞对蛋白质免疫识别和应答的紊乱,进而导致疾病的发生。蛋白质的瓜氨酸化在介导RA 患者的免疫异常中发挥了重要作用,由此产生的瓜氨酸化蛋白也被发现是多种自身抗体,尤其是Anti-CCP 产生的重要靶抗原。RACP 是一类与RA 特异度相关的翻译后修饰蛋白,较早前就有研究发现,瓜氨酸化蛋白在RA 患者疾病发生早期的血清中就会出现,但其在RA 临床诊断中的研究却鲜见报道。本研究采用商品化的试剂盒对RA 患者其他疾病患者和健康对照者外周血中类风湿性关节炎瓜氨酸化蛋白(RACP)的水平进行了检测,并系统分析了其在RA 诊断中的应用价值[4]。
1 材料与方法
1.1 研究对象的选择选取2020 年7 月至11 月在南昌大学第一附属医院风湿科就诊的RA 患者作为RA组,其诊断符合2010 年ACR/EULAR 修订的RA 分类标准[3]。选取同期在南昌大学第一附属医院就诊的骨关节炎(osteoarthritis,OA)、未分化关节炎(undifferentiated arthritis,UA)和系统性红斑狼疮(systemic lupus erythematosus,SLE)患者作为疾病对照组。OA 的诊断符合《骨关节炎诊断及治疗指南》中骨关节炎诊断标准[5];SLE诊断符合2019 年EULAR/ACR SLE 分类标准[6];UA 患者的纳入标准:①至少有一个关节表现为红肿症状,且不能用其他疾病解释,②未出现骨侵袭表现[7]。健康对照组选自南昌大学第一附属医院体检中心无疾病记录的健康体检者。
所有研究对象在纳入时均排除妊娠或哺乳期妇女,肿瘤患者,有活动性感染或近期有感染的患者,患有严重心、肺、肝、肾、血液系统疾病的患者,以及同时伴有其他自身免疫性疾病的患者。本研究获得南昌大学第一附属医院医学研究伦理委员会批准,入组研究对象及其家属知情同意并签署知情同意书。
1.2 临床资料收集及指标检测
1.2.1 收集所有研究对象的临床资料及相关实验室检查数据计算RA 患者28 关节疾病活动指数(disease activity score 28,DAS28)[8]。同时,采集研究对象的清晨空腹静脉血5 mL,低速水平离心机(德国Eppendorf 公司)离心(3 500 r/min,5 min)分离血清后置于-80 ℃冰箱冻存备用。
1.2.2 RACP 的检测RACP 的检测采用酶联免疫吸附法,试剂盒由广州市雷德生物科技有限公司提供,严格依据说明书进行检测。结果判断:以血清样品检测结果的OD 值与临界对照品OD 值比值(S/CO)作为RACP 的半定量水平,以S/CO=1 作为RACP 定性判断的临界值,S/CO ≥1 判断为阳性。
1.3 统计学方法用SPSS 25.0 统计软件进行数据处理分析,首先进行正态分布分析,正态分布定量资料以(±s)表示,非正态分布资料用M(P25~P75)表示,符合正态分布者采用t检验或单因素方差分析,否则采用非参数检验;定性资料以例数或百分率表示采用χ2检验。采用Spearman 相关分析研究各指标之间的相关性。用Medcale软件绘制受试者操作特征(ROC)曲线评价各检测指标对RA 的诊断价值,应用Z 检验比较各指标间ROC 曲线下的AUC 值,以P<0.05 为差异有统计学意义。
2 结果
2.1 研究对象的一般情况及临床资料本研究共纳入RA 患者133 例,包括初诊患者62 例、经治病例71 例,其中女性108 例(81.2%),年龄15~81 岁[ 平均年龄(51.81±12.88)岁]。疾病对照组共纳入非RA 患者151例,包括OA95 例,SLE40 例,UA16 例,其中女性128 例(84.7%),年龄14~86 岁[平均年龄(50.32±15.59)岁]。健康对照组共纳入40 例健康体检者,其中女32 例(80.0%),年龄29~71 岁[平均年龄(48.28±10.74)岁],年龄、性别与RA 组相匹配。研究对象的一般情况及临床资料见表1。
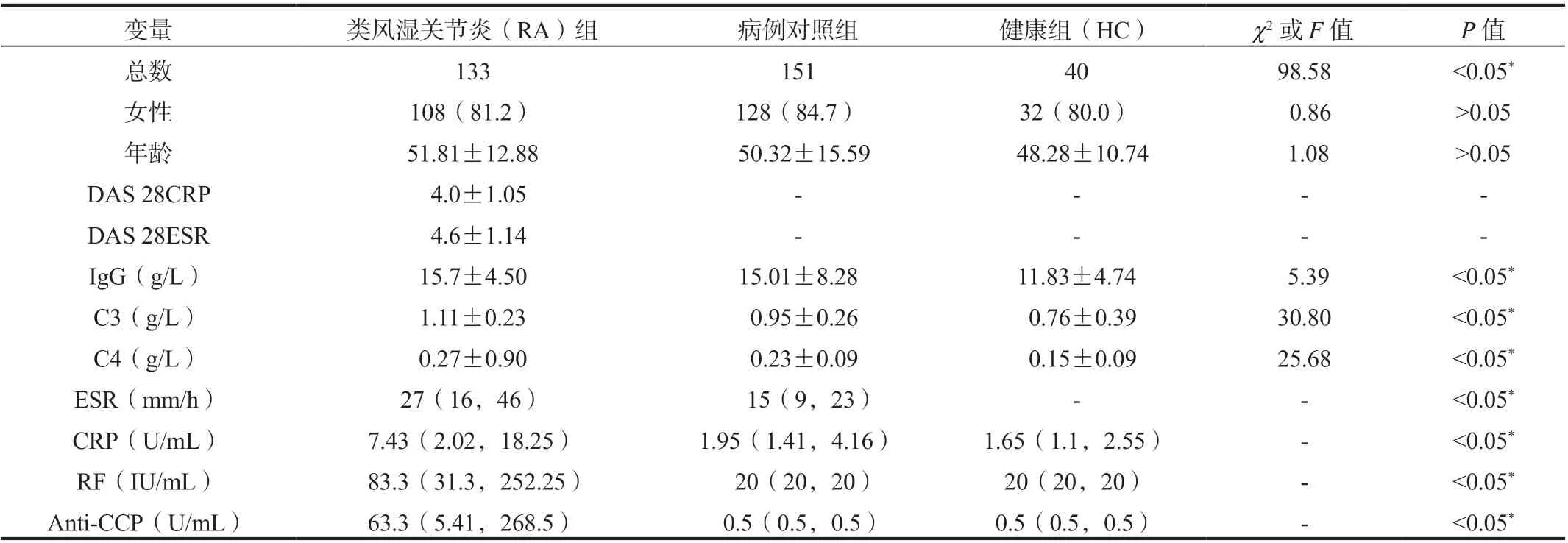
表1 研究对象的一般情况及临床资料
2.2 RACP 的阳性率分析各组研究对象的RA 相关血清学标志物的阳性率见表2。RACP 在RA 患者中的阳性率88.0%高于非RA 的疾病对照组(19.9%)和健康对照组(12.5%)。在RA 患者中,初诊和经治患者RACP 的阳性率分别为87.1%和88.7%。
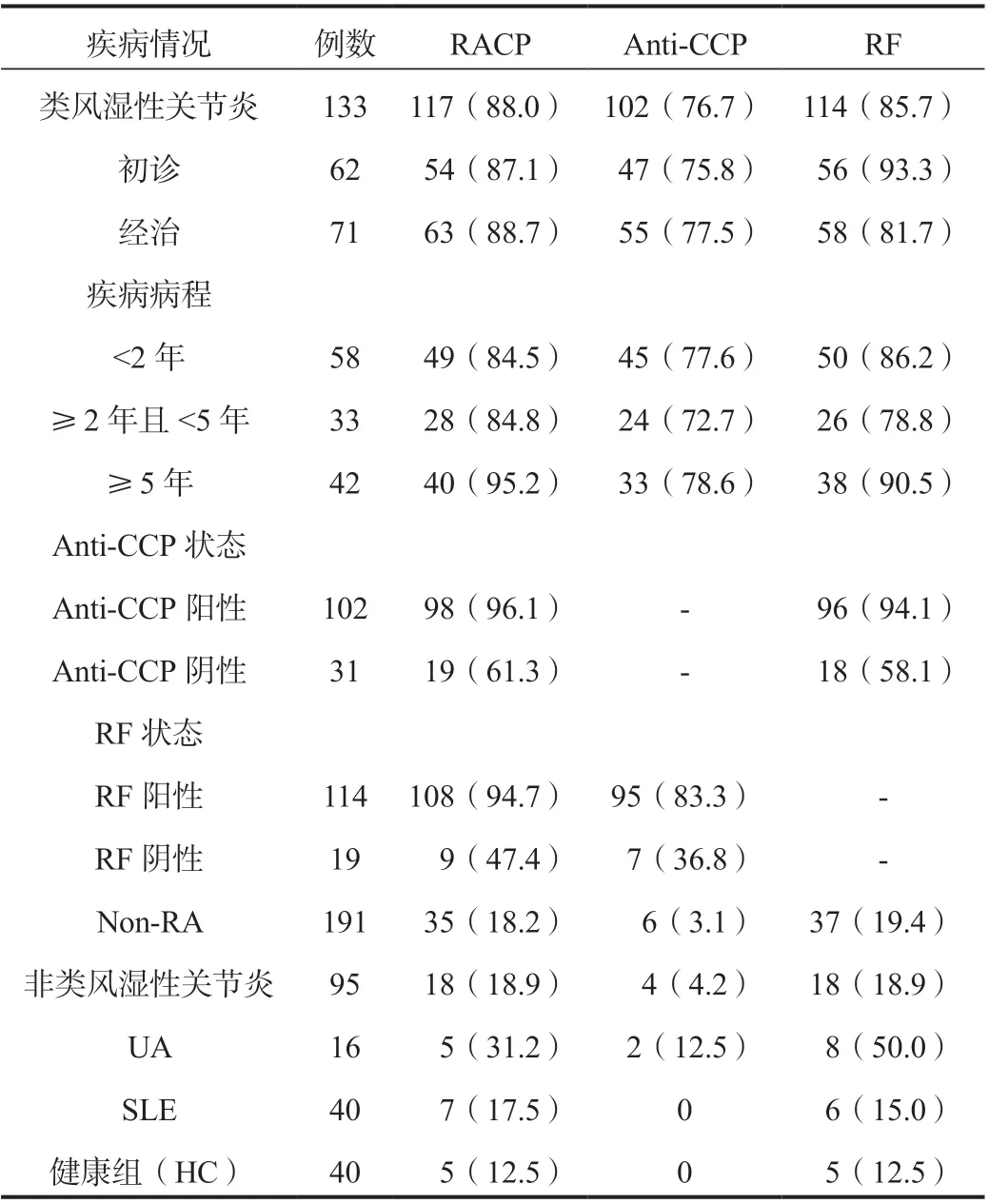
表2 各组别研究对象血清RACP、Anti-CCP和RF 的阳性率[ 例(%)]
与经典的RA 血清学标志物比较:RACP 在RA 患者中的阳性率与RF 比较差异无统计学意义(88.0% vs 85.7%,χ2=0.06,P>0.05),但高于Anti-CCP(88.0% vs 76.7%,χ2=7.04,P<0.05)。在疾病对照组中,RACP 的阳性率高于Anti-CCP(19.9% vs 4.0%,χ2=18.17,P<0.05),与RF 比较差异无统计学意义(19.9% vs 21.2%,χ2=0.08,P>0.05)。在健康对照组中,RACP 的阳性率高于Anti-CCP(12.5%vs 0.0%,χ2=3.20,P>0.05),与RF 一致。
在Anti-CCP 阳性和RF 阳性的RA 患者中,RACP 的检出率分别为96.1%和94.7%。在Anti-CCP 阴性和RF 阴性的RA 患者中,RACP 的检出率分别为61.3%和47.4%。
在病程<2 年的RA 患者中,RACP 阳性率为84.5%;在病程2~5 年RA 患者中,RACP 阳性率为84.8%;在病程≥5 年的RA 患者中,RACP 阳性率为95.2%高于前两组,差异无统计学意义(χ2=3.07,P>0.05)。
2.3 RACP 水平与RA 经典的血清学标志物及RA 疾病活动度的相关性分析RA 组血清RACP 的水平高于疾病对照组和健康对照组(图1A)。疾病对照组血清RACP的水平也高于健康对照组,其中UA 组RACP 水平高于OA 组(图1B)。
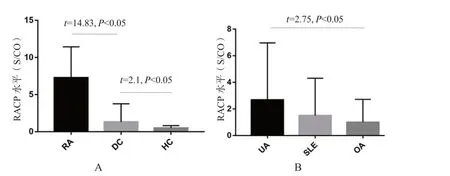
图1 各组研究对象的血清RACP 水平
RACP 水平与RA 其他血清学标志物的相关性分析:Spearman 相关性分析结果显示,RA 患者血清RACP 的水平与患者的年龄和性别无相关,与血清RF 水平也无相关(结果未显示),Anti-CCP 阳性患者RACP 水平与Anti-CCP 水平正相关(r=0.367,P<0.05)。
RACP 与RA 疾病进程和活动性的相关性分析:血清RACP 的水平在初诊和经治RA 患者中差异无统计学意义(图2A),不同病程的RA 患者间差异无统计学意义(图2B)。Spearman 相关性分析结果显示,RA 患者血清RACP的水平与DAS28CRP、DAS28ESR 均无相关性(结果未显示)。但初诊RA 患者血清RACP 水平与变形关节数呈正相关(r=0.65,P<0.05)。
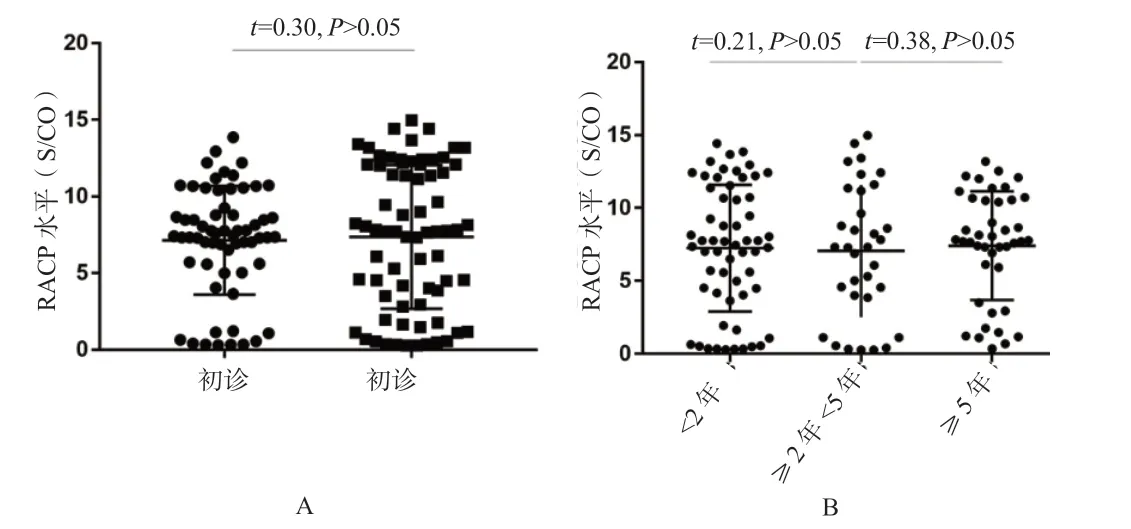
图2 不同组别RA 患者血清RACP 的水平
2.4 ROC 分析以所有非RA 研究对象为对照组的ROC分析结果显示(图3),RACP 诊断RA 的最佳截断值为S/CO=3.44,敏感度和特异度分别为79.0%和92.1%,其ROC 下面积(AUC)为0.90(95%CI:0.86~0.93),略高于RF 的0.89(95%CI:0.85~0.92),低于Anti-CCP的0.920(95%CI:0.89~0.95),但三者比较差异无统计学意义(P>0.05)。RACP 分别与Anti-CCP,RF 联合后AUC 分别为0.94(95%CI:0.91~0.96)和0.93(95%CI:0.89~0.95),与RACP、RF 单一指标比较差异均有统计学意义(P<0.05)。RACP、Anti-CCP 和RF 三者联合后AUC可达0.95(95%CI:0.92~0.97),高于RACP 和RF 两者联合的效果(Z=3.28,P<0.05)。
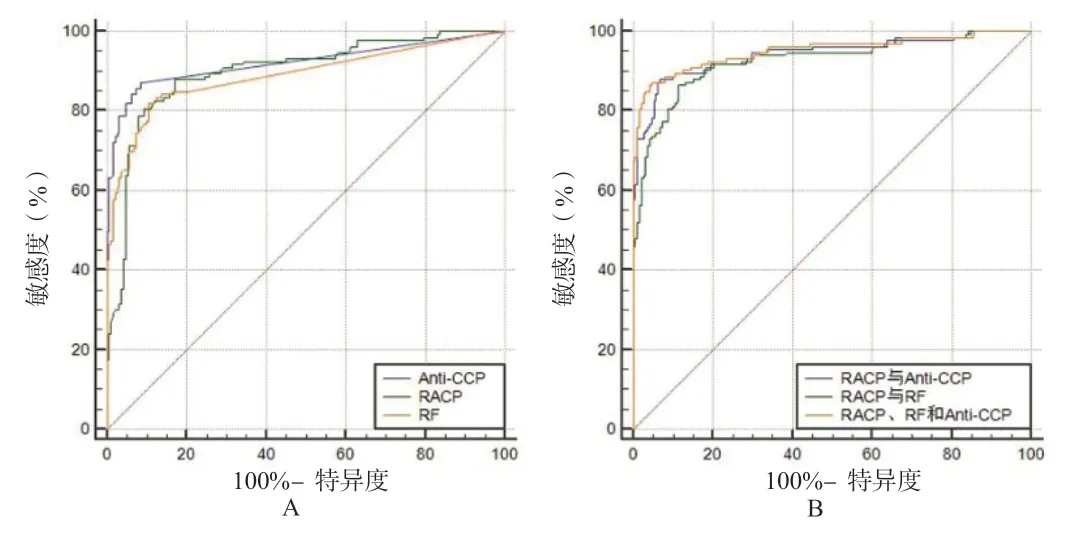
图3 RACP、Anti-CCP 和RF 单独或联合诊断RA 的ROC 分析
2.5 RACP 在RA 诊断中的性能分析各RA 血清学标志物诊断RA 的性能参数见表3。RACP 诊断RA 的敏感度高于Anti-CCP(88.0% vs 76.6%,χ2=7.04,P<0.05),但特异度低于Anti-CCP(81.7% vs 96.9%,χ2=21.19,P<0.05)。RACP 的敏感度和特异度都略高于RF,但差异均没有统计学意义。Anti-CCP 在RA 的诊断方面具有最好的特异度和阳性预测值,RACP 诊断RA 的敏感度和阴性预测值最佳。三个指标或两个指标联合后的结果表明,RACP 与Anti-CCP 联合后比较合适,敏感度提高到91.0%,特异度为79.6%。
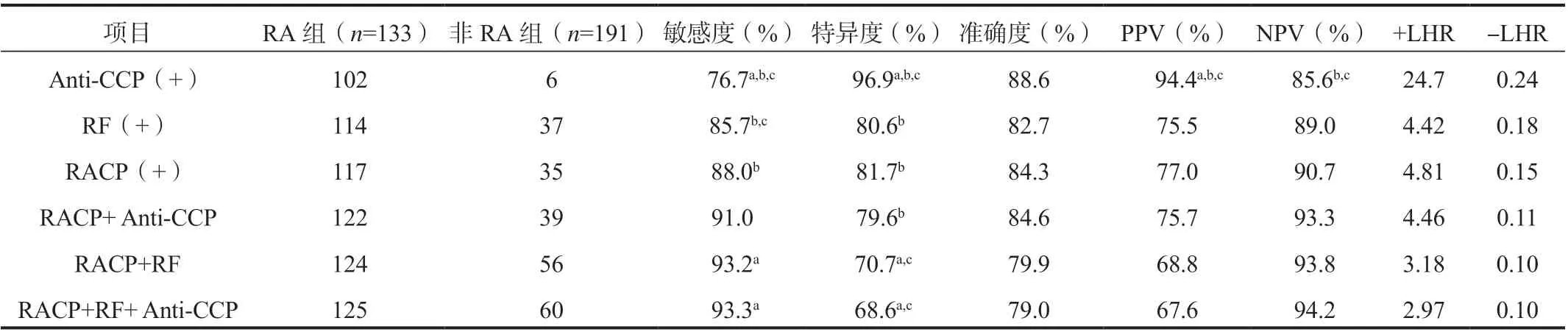
表3 Anti-CCP、RF 和RACP 水平单独及联合后诊断RA 敏感度、特异度和准确度、阳性预测值、阴性预测值、阳性似然比、阴性似然比
3 讨论
RA是一种以关节滑膜炎为特征,并以多发性关节炎为主要临床表现,进而导致关节畸形甚至致残的自身免疫性疾病[9]。研究证明RA 患者对瓜氨酸化的蛋白质可产生较强的免疫应答,提示瓜氨酸化蛋白可能是RA 致病的重要自身反应性抗原[10]。RA 患者瓜氨酸代谢失调是驱动和维持抗瓜氨酸蛋白抗体的关键因素[11]。瓜氨酸化蛋白是类风湿性关节炎特异度自身抗体识别的重要抗原,产生的抗瓜氨酸化蛋白抗体能直接或间接介导软骨侵蚀、骨质破坏,在RA 发病过程中发挥关键作用[10]。目前发现的结合瓜氨酸化蛋白的特异度抗体包括抗核周因子(antiperinuclear factor)、抗角蛋白抗体(antikeratin antibodies)、抗聚角蛋白微丝蛋白抗体(antifilaggrin antibodies)和抗环瓜氨酸抗体(Anti-CCP),且这几种抗体的出现对诊断RA 具有高度的特异度,其中Anti-CCP 已成为诊断RA 的重要血清学标志物[12]。然而由于检测技术的限制,目前对RA 患者RACP 应用价值的研究却很少有报道。最近,有学者利用高效液相色谱质谱联用技术建立了瓜氨酸化蛋白的鉴定方法,并发现在血清Anti-CCP 阴性的RA 患者滑膜组织同样有瓜氨酸化蛋白的高表达[13],提示瓜氨酸化蛋白在RA 患者中的检出率可能高于Anti-CCP。本次研究选取了与早期RA 鉴别困难的关节炎患者作为对照组,更符合临床要求,而且对一些RA 或者Anti-CCP 阴性的患者进行检测,与传统的实验室检测方法有很好的互补性。
研究发现,RA 患者血清RACP 的检测阳性率高于Anti-CCP,该结果证实了管晓龙等[13]的推测。然而,研究显示RACP 诊断RA 的特异度不如Anti-CCP,提示在其他疾病特别是未分化关节炎患者同样存在一定水平的瓜氨酸化蛋白。本研究发现RA 新发病例组瓜氨酸化蛋白的阳性率与RA 复发疾病组比较差异无统计学意义,尽管随着病程延长RACP 的阳性率有上升趋势,提示RACP 可能主要在RA 的发生过程中发挥作用。进一步的研究也发现,RACP的水平与RA 患者的疾病活动性没有相关性,但Anti-CCP阳性患者RACP 水平与Anti-CCP 水平正相关(r=0.367,P<0.05),而且初诊RA 患者血清RACP 水平与变形关节数呈正相关(r=0.65,P<0.05)。
在RA 的诊断效能方面,ROC 分析结果显示,RACP诊断RA 的AUC 达到0.90,提示RACP 可作为RA 的诊断标志物。进一步的研究显示,在Anti-CCP 阳性的RA 患者中,RACP 的阳性率可达96.1%,在Anti-CCP 阴性的RA患者中RACP 的阳性率也能达到和61.3%,即有一半以上的Anti-CCP 阴性的RA 患者血清中可检出RACP,提示在RA 诊断方面两者具有较好的互补性,具有较好的联合诊断价值。研究结果也显示,RACP 与Anti-CCP 联合应用于RA 的诊断时,虽然特异度有所降低,但是敏感度可显著提高到91.0%。
本次研究RACP 特异度略低于应用相同试剂盒陈建芸等[14]的研究,敏感度高于该研究,可能是因为本次实验纳入的样本多半是有关节痛等相关症状的患者,导致对照组RACP 阳性率略高。在部分非RA 的疾病对照组患者和部分健康人血清中也检出了较高比例的RACP,尤其是在未分化关节炎患者中的检出率达到了31.2%,提示RACP 诊断RA 的特异度并不是很理想。然而,考虑到RACP 主要是作为启动RA 自身免疫应答的靶抗原在RA 的发生过程中发挥作用,可能也存在部分已经发生较高水平的蛋白质瓜氨酸化,但尚未发生RA 或尚未满足RA 诊断标准的个体。此前的文献报道显示,有约29.4%的UA 患者最终会发展为RA[15],这也从一个侧面为我们的推测提供了支撑。后期计划对这部分RACP 阳性的非RA 组研究对象进行随访,了解这部分人群未来疾病的进展和发生RA 的可能,以评估RACP 在预测RA 发生中的可能作用。
综上所述,RACP可作为RA诊断的新型血清学标志物,并与Anti-CCP 和RF 具有较好的互补性,尤其是RACP 与Anti-CCP 联合应用可提高RA 诊断的敏感度,但其诊断RA的特异度和预测RA 发生的作用尚需进一步的深入研究。

