西藏野生垂穗披碱草EnCBL10基因的克隆与功能研究
张慎彤, 高 浩, 张金鹏, 任智慧, 姜惠娜, 其美拉姆, 普布卓玛, 付娟娟*
(1. 西北农林科技大学草业与草原学院, 陕西 杨凌 712100; 2.西藏自治区拉萨市曲水县自然资源局, 西藏 拉萨 850000; 3. 西藏自治区农科院草业科学研究所, 西藏 拉萨 85000)
垂穗披碱草(ElymusnutansGriseb.)是青藏高原高寒草原和草甸的重要禾本科牧草,是维持高寒地区生态平衡的重要植物之一,是青藏高原地区人工草地的重要饲草,在草地畜牧业中优势突出,同时也是麦类作物的野生近缘种,具有麦类作物和牧草遗传多样性的宝贵基因[1]。广布于高寒缺氧极端生境条件下的西藏野生垂穗披碱草是研究植物抗逆机理较理想的优质牧草,具有重要的应用价值。
钙调磷酸酶B类蛋白(Calcineurin B-Like Proteins,CBLs)是钙信号通路中的重要成员,在植物非生物胁迫应答中具有重要作用。在响应环境胁迫时,CBLs蛋白可以感知细胞中的Ca2+波动,与蛋白激酶CIPKs相互作用,构成植物CBL-CIPK信号通路,调控植物体内Ca2+信号的传递并诱导下游的防御响应[2-3]。Kim等[4]研究发现CBL10能够与CIPK24蛋白在液泡膜互作,将Na+隔离在液泡中,从而解毒盐胁迫对植物细胞的损伤。最近的研究也表明CBL10缺失会引起植物地上部分对盐敏感,与cbl4和cbl10单突变体相比,cbl4cbl10双突变体对盐更敏感,表明CBL4和CBL10各自调控不同的耐盐途径[5]。与之相似,番茄(Solanumlycopersicum)中SlCBL10基因通过调节液泡中的Na+和Ca2+平衡,维持过表达SlCBL10植株中较低的Na+/Ca2+比例,从而提高其耐盐性[6]。Kang和Nam[7]研究发现CBL10基因能够正向调控植物的耐盐性,然而以ABA独立的方式负向调控植物的水分胁迫抗性。在番茄中的研究也表明SlCBL10基因通过ABA不依赖的方式负向调控植物的耐旱性[5]。我们前期研究发现,钙信号在西藏当雄野生垂穗披碱草低温应答中发挥重要作用[8],其中CBL10是钙信号通路中的重要基因,但其调控植物低温等胁迫应答的作用机制尚不明晰。因此,开展西藏野生垂穗披碱草中EnCBL10基因的克隆与功能分析,对深入研究EnCBL10基因调控植物的低温等非生物胁迫胁迫应答机制具有重要意义。
本研究从西藏野生垂穗披碱草中筛选和克隆了EnCBL10基因,并将其异源表达于烟草中,开展转基因植株EnCBL10在不同胁迫条件下(干旱、低温)的生长以及生理响应的研究,揭示EnCBL10基因调控植物低温和干旱胁迫应答的作用机制,为垂穗披碱草的育种和栽培管理奠定理论基础。
1 材料与方法
试验于2020年9月至2021年6月在西北农林科技大学草地工程实验室进行。
1.1 材料来源
西藏垂穗披碱草种子采集于西藏拉萨市当雄镇(30°28.535′N,91°06′246″ E,海拔4 618 m)。亚细胞定位所用本氏烟草(Nicotianabenthamiana)及转基因所用野生型烟草‘SR1’(N.tabacum‘SR1’)均来自西北农林科技大学草业科学技术实验室。
1.2 试验方法
1.2.1提取总RNA及反转 利用RNA试剂盒提取西藏野生垂穗披碱草叶片中的总RNA,通过1%琼脂糖凝胶电泳检测其完整性,利用微量分光光度计测定其浓度,采用反转试剂盒反转成cDNA。
1.2.2基因的克隆 在NCBI中将西藏野生垂穗披碱草的转录组测序获得的序列(https://www.ncbi.nlm.nih.gov/Traces/study/?acc=SRP0744 69&go=go)进行同源比对,利用snapgene软件设计出EnCBL10全长引物EnCBL10-F和EnCBL10-R(表1),使用诺维赞高保真扩增酶试剂盒(No. P511)进行扩增,PCR程序为95℃ 10 min;95℃ 30 s,60℃ 30 s,72℃ 1 min,30个循环;72℃ 5 min,12℃保温。用1.0%琼脂糖凝胶电泳检测PCR产物并进行纯化,取适量的纯化产物连接载体转化大肠杆菌感受态,挑取单一菌落,PCR检测为阳性的菌液送生物公司进行测序。
1.2.3生物信息学分析 通过NCBI网站和DNAMAN等软件分析EnCBL10对应的氨基酸序列的同源性、蛋白的理化性质和蛋白结构域等,使用MEGA 6软件分析EnCBL10蛋白与其他植物的EnCBL10蛋白的进化关系,构建分子进化树。通过SignalP4.1 Server网站(http://www.cbs.dtu.dk/services/SignalP/)对信号肽进行预测。通过CellPLoc 2.0网站(http://www.csbio.sjtu.edu.cn/bioinf/Cell-PLoc-2/)预测亚细胞定位。利用ProtParam和ProtScale网站对EnCBL10进行蛋白性质分析,用SOPMA(http://npsa-pbil.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)进行蛋白二级结构预测。
1.2.4EnCBL10基因表达模式分析 将培养21 d的垂穗披碱草幼苗,分别进行4℃低温处理0,1.5,3,12,24,120 h,和干旱(保持相对含水量40%)处理0,2,4,6 h,采用LightCycler 480 real-time PCR system分析垂穗披碱草各组织中EnCBL10基因的相对表达水平。利用primer 5软件设计EnCBL10特异性引物,以EnTublin为内参基因[9-10](表1),实时荧光定量试剂盒为诺唯赞(Q311),反应程序为:95℃ 30 s;95℃ 10 s,60℃ 30 s,40个循环;95℃ 15 s,60℃ 60 s,95℃ 15 s。上述试验共设有4个生物学重复和3个技术重复,以上反应完全结束之后,通过检测融解曲线来确定PCR产物特异性,采用2-ΔΔCT计算表达量[11]。

表1 各试验所采用的引物序列表及功能Table 1 List of primers used in different expression and functional analysis of EnCBL10
1.2.5亚细胞定位分析 将已构建好的pCAMBIA1300-EnCBL10-GFP转化入冰上融化农杆菌感受态EHA105,挑取菌检阳性的菌液。采用注射法侵染4周龄的本氏烟草叶片,暗培养24~48 h。在激光共聚焦显微镜下观察亚细胞定位。初步确定亚细胞定位后,提取烟草叶片的原生质体,进一步确定EnCBL10的亚细胞定位。
1.2.6转基因烟草的获取 构建pARTCAM1300-EnCBL10-GFP过表达载体(用Xho I和Xba I双酶切质粒pARTCAM1300-GFP)。转化大肠杆菌,利用基因特异引物进行菌落PCR验证阳性克隆,送生物公司测序。将测序正确的pARTCAM1300-EnCBL10-GFP重组质粒利用化学转化法转化农杆菌感受态EHA105。侵染切下的野生型SR1烟草叶片,侵染5 min,接种于共培养基,暗培养4 d。用灭菌水冲洗3~5遍后,接种于含50 mg·L-1卡那霉素的的筛选培养基中,培养至长出抗性芽。采用EnCBL10特异性引物EnCBL10-F和EnCBL10-R(表1)通过RT-PCR鉴定阳性苗。
1.2.7转基因烟草的胁迫应答分析 选用已鉴定出的EnCBL10-OX-12和EnCBL10-OX-20两株系的阳性苗烟草种子消毒后,置于铺有湿润滤纸的培养皿中在人工气候箱萌发,培养条件为光期16 h,光强12 000 lx,温度为23℃,湿度为80%;暗期8 h,光强0 lx,温度为20℃,湿度为60%。将培养7 d幼苗,选择形态均匀健康的幼苗转移至装有蛭石的花盆中进行培养。将生长至30 d的幼苗进行低温和干旱的处理。低温处理为在低温培养箱里(4℃)适应处理3 d后,将温度降至-10℃处理0.5 h,再缓慢恢复到4℃处理直至出现表型;干旱处理采用不浇水处理14 d,恢复处理采用与对照相同的培养方式进行复水。每个处理设置3个生物学重复。分析低温、干旱胁迫下野生型和EnCBL10转基因种子的表型差异。采用电导法测定相对电导率[12]。采用李合生的方法[13]分析低温和干旱胁迫下野生型和过表达植株的抗氧化物酶活性、可溶性糖含量和脯氨酸含量。
1.2.8数据分析 采用SPSS 25.0软件进行双因素方差分析、Duncan’s法对平均值进行比较和Excel软件进行分析和作图。
2 结果与分析
2.1 基因序列克隆与生信分析
提取西藏当雄野生垂穗披碱草总RNA,以cDNA为模板,CBL10-F和CBL10-R为引物(表1),通过PCR扩增得到目的片段,将PCR产物用1.0%的琼脂糖凝胶电泳检测,测序获得792 bp的序列(图1A)。
生物信息学分析表明,EnCBL10编码263个氨基酸,相对分子质量为29 783.96,理论等电点为5.17,属于疏水性蛋白,无信号肽,含有FRQ1保守结构域。同源比对发现EnCBL10所编码蛋白质与短芒大麦草(Hordeumbrevisubulatum)、小麦(Triticumaestivum)、水稻(Oryzasativa)、黍(ChenopodiumalbumL.)、高粱(Sorghumbicolor)和大麦(Hordeumvulgare)的一致性达70%~80%(图1B)。进化树结果显示,EnCBL10蛋白与多个单子叶植物蛋白相似度较高,包括短芒大麦草、大麦的同源性在90%以上(图1C)。

图1 EnCBL10基因的序列(A)、同源性比对(B)和进化树分析(C)Fig.1 Sequence (A),Homology alignment (B) and evolutionary tree analysis (C) of EnCBL10 gene
2.2 EnCBL10基因的表达模式分析
组织表达特异性结果显示,EnCBL10在垂穗披碱草叶中表达量最高,为根中表达量的56.27倍,为茎中表达量的5.56倍(图2A)。低温胁迫处理3 h后EnCBL10基因的表达量达到最高水平,为0 h的1.82倍(P<0.05);干旱胁迫下,该基因的表达水平在4 h最高,为处理前的4.12倍(P<0.05)(图2B,2C)。以上结果表明EnCBL10基因参与调控垂穗披碱草的低温和干旱胁迫应答。
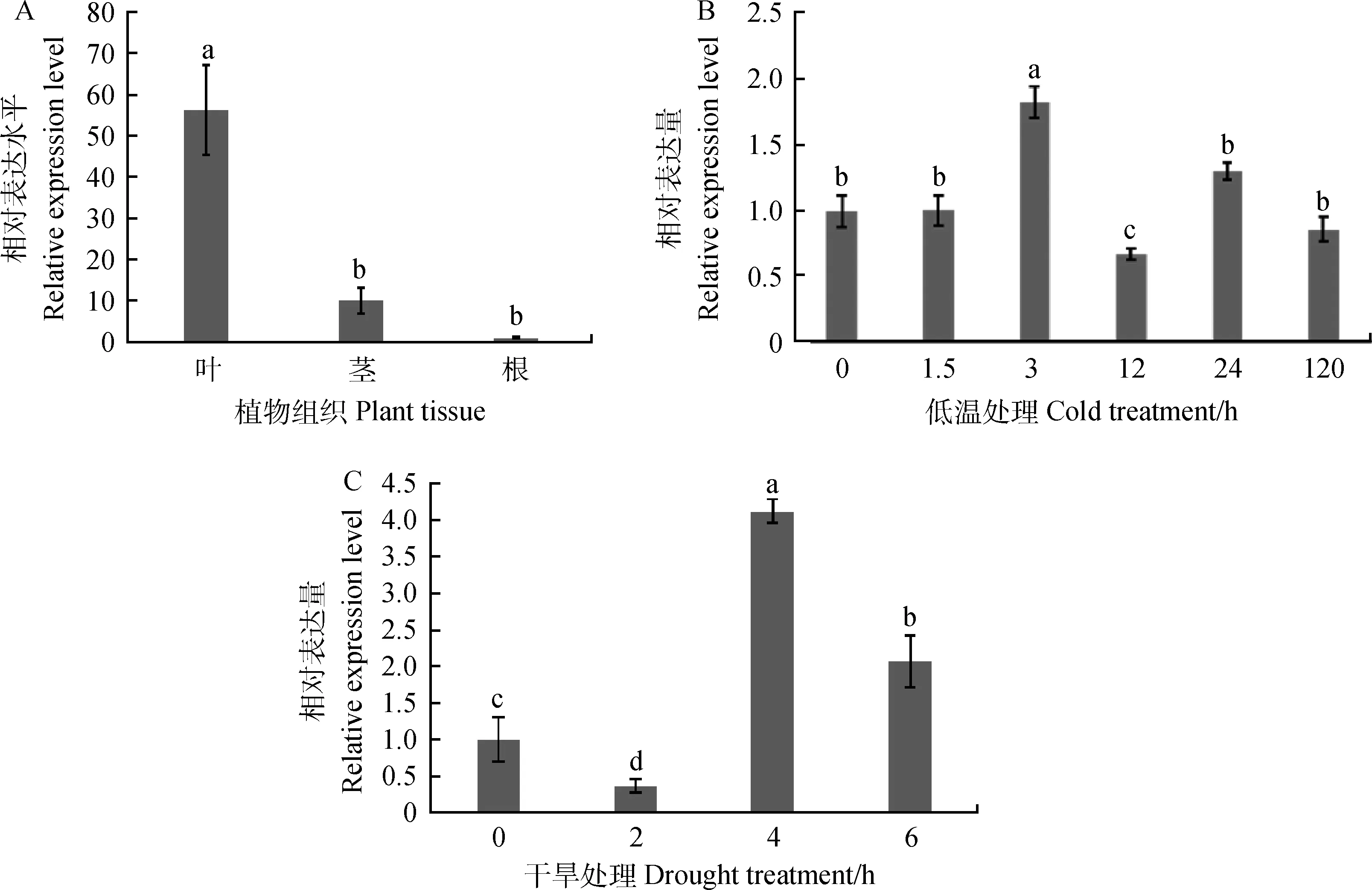
图2 EnCBL10在西藏野生垂穗披碱草不同组织(A)及在低温(B)和干旱(C)胁迫下的表达分析Fig.2 Expression of EnCBL10 gene in different tissues (A),and cold(B) and drought(C) stress注:不同小写字母表示差异显著(P < 0.05),下同Note:Different small letters are significantly different at the 0.05 level,the same as below
2.3 亚细胞定位
利用CellPLoc 2.0网站分析亚细胞定位,结果显示西藏野生垂穗披碱草EnCBL10定位于细胞膜和液泡膜。进一步利用构建pCAMBIA1300-EnCBL10-GFP表达载体探究EnCBL10基因编码的蛋白在细胞中的定位情况。由图3可知,pCAMBIA1300-EnCBL10-GFP绿色荧光蛋白信号分布在细胞膜中,而pCAMBIA1300-GFP绿色荧光蛋白信号分布在整个细胞,说明EnCBL10编码蛋白定位于细胞膜上中,这与实验预测结果大致一致。

图3 EnCBL10的亚细胞定位Fig.3 Subcellular localization of EnCBL10 protein注:标尺为10 μmNote:Scale bar,10 μm
2.4 转基因阳性苗的鉴定和组织表达特异性分析
经过30 d的筛选培养,共获得25个烟草抗性苗培养。提取25个抗性苗的总RNA,以反转录成的cDNA为模板,以构建过表达载体的引物EnCBL10-F,EnCBL10-R为特异性引物,进行半定量RT-PCR反应,以野生型SR1的cDNA为阴性对照,以烟草的NtUbiquitin基因作为内参基因。RT-PCR检测结果显示,野生型SR1中没有检测到扩增条带,有6个株系扩增出与阳性对照大小一致的特异条带,胶回收、克隆测序表明,所扩增条带为EnCBL10目的基因序列(图4A)。初步证明EnCBL10基因已成功在烟草转录水平上表达。
EnCBL10在过表达烟草的根、花、老叶和新叶等器官中有不同的表达特征,其中新叶中表达量最高,为根的16.3倍(P<0.05)(图4B)。
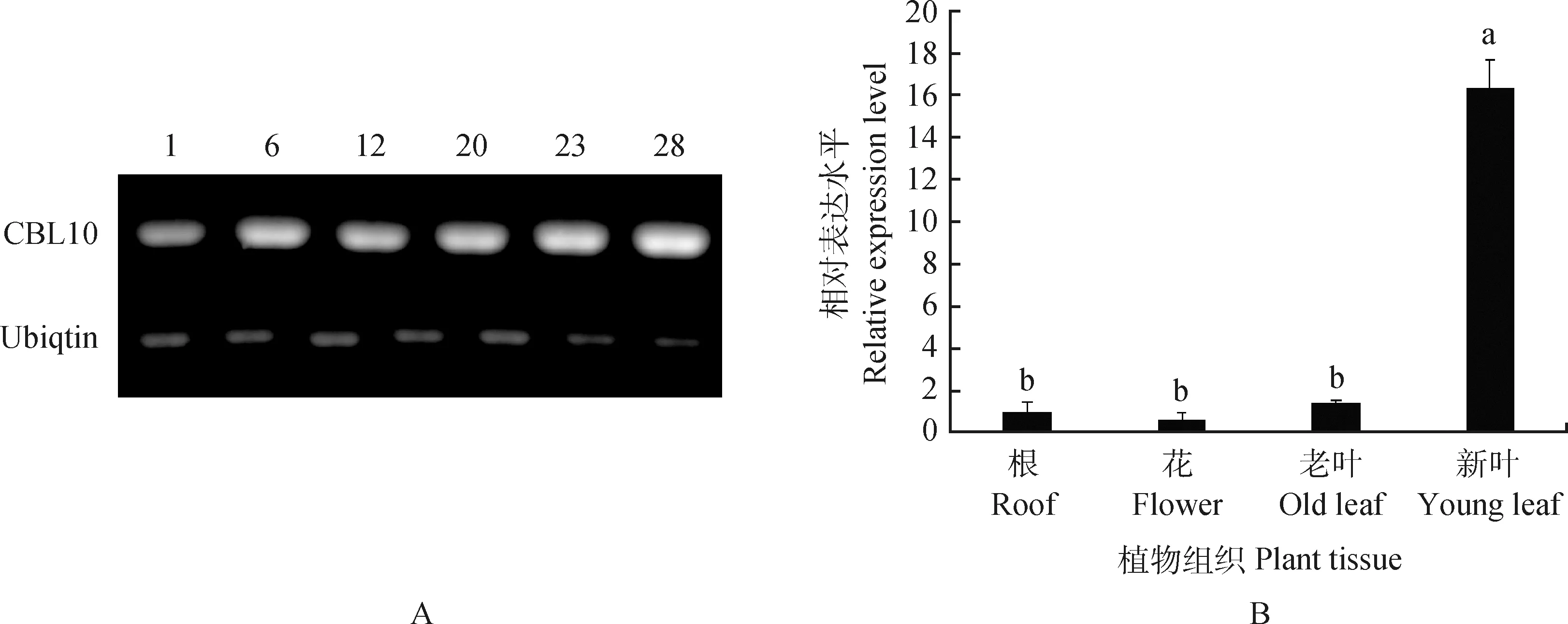
图4 转基因阳性苗鉴定(A)和EnCBL10过表达植株(EnCBL10-OX-12)的组织表达分析(B)Fig.4 PCR identification of transgenic positive seedlings (A) and expression of EnCBL10 (EnCBL10-OX-12) in different tissues in transgenic tobacco (B)
2.5 低温和干旱胁迫对过表烟草和野生型烟草幼苗表型的影响
由图5A可知,与野生型相比,低温对异源过表达EnCBL10植株的伤害较小;恢复处理后过表达株系较野生型生长的更好,表明EnCBL10积极地调节植物的抗寒性。干旱胁迫下,野生植株叶片出现明显的萎蔫,而转基因株系的叶片脱水较轻,长势更好(图5B),这一结果表明EnCBL10基因能够提高植物的抗旱性。

图5 低温(A)和干旱(B)胁迫对过表达烟草表型的影响Fig.5 Effects in phenotype of overexpressed tobacco under cold (A) and drought (B) stresses注:标尺为5 cmNote:Scale bar,5 cm
2.6 低温、干旱对过表达转基因烟草与野生型烟草细胞膜稳定性的影响
低温和干旱胁迫均能不同程度地增加野生型和过表达EnCBL10植株叶片中的相对电导率,说明低温和干旱胁迫对这两个不同基因型的细胞膜均造成了不同程度的损伤(图6)。低温胁迫下,野生型植株的相对电导率与对照相比增加259.1%(P<0.05),而过表达株系EnCBL10-OX-12和EnCBL10-OX-20分别较对照中的过表达株系EnCBL10-OX-12和EnCBL10-OX-20增加了38.5%和69.2%。与对照相比,干旱胁迫导致EnCBL10-OX-12植株中相对电导率增加了123.1%(P<0.05),EnCBL10-OX-20增加了100.2%(P<0.05),而野生型中相对电导率较对照增加了181.8%(P<0.05)。
2.7 低温和干旱胁迫对转基因烟草叶片中抗氧化酶活性的影响
低温胁迫下,过表达EnCBL10-OX-12和EnCBL10-OX-20株系叶片中抗氧化酶POD,APX和GR活性与对照下的过表达EnCBL10-OX-12和EnCBL10-OX-20株系相比均呈现增强趋势,分别较对照增加97.88%,79.5%,265.6%(P<0.05),和492.5%,81.4%,138.1%(P<0.05);干旱胁迫下,转基因株系的POD,APX和GR活性与野生型相比表现出显著的增强趋势,过表达EnCBL10-OX-12和EnCBL10-OX-20株系的POD,APX和GR活性分别较对照增加166.9%,400%,146%(P<0.05)和97.8%,351.9%,80.3%(P<0.05)(图7)。

图6 低温和干旱胁迫下过表达烟草叶片相对电导率的变化Fig.6 Changes in relative electrical conductivity in the leaves of transgenic plant under cold and drought stress

图7 低温胁迫和干旱胁迫下过表达植株叶片POD(A),APX(B)和GR(C)活性的变化Fig.7 Changes in the activities of POD (A),APX (B),and GR (C) in the leaves of overexpressed plant under cold and drought stress
2.8 低温和干旱胁迫对转基因烟草叶片中可溶性糖、游离脯氨酸含量的影响
低温胁迫下,野生型烟草叶片中脯氨酸含量与对照相比下降45.4%(P<0.05),但两个转基因株系叶片中的脯氨酸含量与各自对照相比分别提高了79.7%和70.8%(P<0.05);在干旱胁迫下,野生型和过表达植株中脯氨酸含量均有所降低,但转基因植株比野生型脯氨酸含量下降幅度小(图8A)。
过表达和野生型植株中可溶性糖的含量在低温胁迫下均显著增加,与对照相比过表达EnCBL10-OX-12和EnCBL10-OX-20株系的可溶性糖含量分别增加281%和956.6%(P<0.05),且增加幅度超过野生型;干旱胁迫下,EnCBL10-OX-12的可溶性糖含量略有降低,野生型和EnCBL10-OX-20株系的可溶性糖含量均有所增加,但与对照相比差异不显著(图8B)。

图8 低温干旱胁迫下过表达植株中游离脯氨酸含量(A)和可溶性糖(B)的变化Fig.8 Changes in free proline content (A) and soluble sugar (B) in the leaves of transgenic plant under cold and drought stress
3 讨论
植物中主要有三类钙信使系统,分别为钙离子-钙调蛋白(Ca2+-CaM)、钙离子-钙调磷酸酶B类似蛋白(Ca2+-CBL)和钙离子-钙依赖性蛋白激酶(Ca2+-CDPK),这些钙信号参与植物对逆境信号的感知和传递[14]。近年来,CBL-CIPK信号在调控植物胁迫应答方面受到国内外学者的普遍关注[15-19]。前期研究发现拟南芥、水稻、玉米和杨树基因组中含有10个CBL基因家族成员,其中大多数参与胁迫信号传导途径[20],CBLs在接收植物细胞产生的Ca2+信号后,通过激活下游CIPKs的激酶活性实现Ca2+信号的传递[16]。许多研究表明植物CBL10基因受多种逆境胁迫诱导表达[15,19],说明CBL10依赖的钙信号网络在植物逆境应答过程中起关键作用。然而关于西藏野生垂穗披碱草CBL基因功能的研究未见报道。
本研究从西藏当雄野生垂穗披碱草中克隆了EnCBL10基因,发现该基因能够被低温和干旱胁迫诱导表达,表明EnCBL10基因可能参与了上述非生物胁迫应答。为了更深入研究其调控机制,我们进行了组织表达分析、亚细胞定位并构建过表达载体,利用农杆菌侵染法将EnCBL10基因转入烟草,并对转基因烟草做了基因的表达量、表型及生理指标等一系列研究。本研究发现EnCBL10基因在西藏野生披碱草根、茎、叶中都有表达,其中叶中表达量最高。这与Egea等[5]在番茄(Solanumlycopersicum)中SlCBL10研究结果类似,该研究指出SlCBL10基因在成熟叶片中表达最高,在根中表达最低,且Slcbl10突变体在盐胁迫下表现出地上部生长受到抑制,茎顶端坏死。而且在拟南芥Atcbl10突变体中回补SlCBL10能够提高其胁迫抗性。这表明CBL10主要在植物的地上部组织表达,且在不同物种中其功能可能是保守的[19]。垂穗披碱草EnCBL10蛋白主要定位在液泡膜中,推测在液泡中EnCBL10与特定CIPKs蛋白结合形成复合体激活多种信号通路。相似的研究也指出拟南芥中CBL10定位在液泡中与CIPK24互作,调控其耐盐性[4]。
在正常生长条件下,植物体内的活性氧代谢处于动态平衡的状态。但当植物处于低温、干旱等胁迫环境时,这种代谢平衡被打破,在植物组织中积累了大量活性氧,导致细胞膜结构和功能受到一定损伤,电解质外渗,增加了细胞膜透性[20-23]。电导率是反映植物细胞膜受逆境损伤的重要指标。植物能够通过激活抗氧化酶活性来抵制活性氧大量积累带来的氧化伤害[24]。细胞中多种抗氧化酶,如POD,CAT和APX等,在活性氧的清除过程中发挥重要作用[25-28]。本研究发现,过表达EnCBL10植株在低温和干旱胁迫下相对电导率降低,POD,APX,GR活性均出现不同程度的提高,这说明过表达EnCBL10提高了植物体内抗氧化酶活性,维持了其细胞膜的稳定性,赋予转基因植株更强的抗逆能力。脯氨酸和可溶性糖作为渗透调节物质,具有较强的水溶性和水合能力,可以促使蛋白质结合更多水分子提升溶解性,有助于维持细胞的渗透平衡,提高植物的抗逆性[29]。低温胁迫下,过表达EnCBL10导致植物叶片中脯氨酸含量显著升高,但干旱胁迫下脯氨酸变化较小,这可能是由于干旱时间过长,导致脯氨酸含量下降[30]。已有许多研究表明,钙信号通过调控抗氧化酶的活性和渗透调节物质来提高植物的低温等胁迫抗性[31-33]。Zou等[33]研究发现拟南芥CPK8通过磷酸化CAT3增强其蛋白活性,从而调控干旱胁迫下植物体内的H2O2平衡。与之相似,过表达OsCPK24提高了水稻中脯氨酸和谷胱甘肽的含量,可维持更高的GSH/GSSG水平,从而提高水稻的抗寒性[32]。与以上研究结果类似,本试验发现过表达EnCBL10提高了抗氧化酶活性和脯氨酸的含量,这表明EnCBL10可能与上述钙信号类似,可能通过调控抗氧化酶活性及渗透调节物质提高植物的抗性,更深层的机制需要进一步挖掘。
4 结论
本研究成功克隆了西藏野生垂穗披碱草EnCBL10基因的CDS序列。EnCBL10基因含有FRQ1保守结构域,与短芒黑麦草、小麦、水稻等相似性较高,该基因在西藏野生披碱草叶中表达量最高。EnCBL10蛋白定位于细胞膜。EnCBL10基因能够被低温和干旱等非生物胁迫诱导表达,激活抗氧化防御系统和调节植物体内的渗透平衡来抵御胁迫造成的危害。本研究为进一步挖掘EnCBL10基因调控植物的抗寒、抗旱机制奠定理论基础。

