血清PCT、IL-13与AECOPD伴气道黏液高分泌患者临床预后的相关性
覃英娇,周向东,李琪,钟有清,王杰,刘峰
气道黏液高分泌是慢性阻塞性肺疾病急性加重期(acute exacerbation of chronic obstructive pulmonary disease,AECOPD)的病理学特征之一,主要由杯状细胞增加、黏液清除减少所致[1]。当气道黏液分泌增多后,会加重AECOPD患者气道阻塞,进一步影响患者肺功能,增加患者病死风险[2]。因此,分析与AECOPD伴气道黏液高分泌患者预后有关的指标,可为患者预后的评估、治疗方案的制定提供参考。降钙素原(procalcitonin,PCT)是炎性反应的一种敏感指标,在多种细胞因子的调控中发挥重要作用,对呼吸系统感染诊断、预后评估具有一定价值[3]。白介素-13(interleukin-13,IL-13)是Th2型细胞因子之一,由树突细胞、T细胞亚群产生,可诱导气道杯状细胞增生,引起气道黏液高分泌[4]。结合PCT、IL-13的作用,推测可能与AECOPD伴气道黏液高分泌患者预后有关。基于此,本研究分析血清PCT、IL-13与AECOPD伴气道黏液高分泌患者临床预后的关系,报道如下。
1 资料与方法
1.1 临床资料 选取2018年4月—2021年3月海南医学院附属第一医院收治的AECOPD伴气道黏液高分泌患者153例作为研究对象,其中男99例,女54例,年龄48~70(60.51±4.81)岁;病程4~13(6.17±1.44)年;有吸烟史86例;合并症:高血压40例,糖尿病17例;咳嗽和咯痰评估问卷(CASA-Q)评分32~59(46.01±5.47)分。本研究经医院伦理委员会审核通过(2018LL0129),全部患者及家属均知情同意并签署知情同意书。
1.2 病例选择标准 纳入标准:(1)AECOPD符合《内科学》[5]中诊断标准;(2)根据CASA-Q[6]判定为气道黏液高分泌(CASA-Q评分<60分)。排除标准:(1)合并肺结核、肺癌、支气管哮喘等其他呼吸系统疾病;(2)合并自身免疫系统疾病;(3)合并肺部真菌感染;(4)合并类风湿性关节炎、白塞病等结缔组织疾病;(5)合并严重心脑血管疾病或肝肾功能不全;(6)近期内发生过消化道大出血或心肌梗死等严重疾病;(7)近期使用过糖皮质激素、抗生素或白三烯受体拮抗剂等药物。
1.3 观察指标与方法
1.3.1 基线资料收集:入院时收集患者基线资料,包括性别、年龄、COPD病程、吸烟史、合并症(高血压、糖尿病)、本次治疗期间机械通气情况;依据CASA-Q评分评估患者气道黏液分泌情况,该问卷包括咳嗽症状与影响、咯痰症状与影响,共4个维度,总分0~100分,评分越低症状越重;该问卷克朗巴哈系数为0.872;使用肺功能仪测定患者用力肺活量(forced vital capa-city,FVC)、第1s用力呼气容积(forced expiratory volume in 1 s,FEV1),计算FEV1/FVC。
1.3.2 实验室相关指标检测:(1)入院当日采集患者动脉血2 ml,抗凝处理后,使用血气分析仪(美国麦迪卡medica公司,型号EasyStat)测定动脉血pH、氧分压(PaO2)、二氧化碳分压(PaCO2)。(2)入院当日或次日清晨,采集患者空腹静脉血10 ml,其中3 ml使用血细胞分析仪(优利特公司,型号URIT-3081)测定白细胞计数(WBC)、中性粒细胞百分比(NEU);另取2 ml血液,使用生化分析仪(DOTOP公司,型号DP-280)测定白蛋白(Alb)水平;另取5 ml血液,离心分离15 min,转速3 000 r/min,半径8 cm,使用酶联免疫吸附法测定C反应蛋白(CRP)、肿瘤坏死因子-α(TNF-α),试剂盒购自上海酶联生物科技有限公司;采用化学发光免疫法测定血清PCT、IL-13水平,试剂盒购自贝克曼库尔特公司。
1.4 治疗方法及预后评估 全部患者参照“慢性阻塞性肺疾病诊治指南(2013年修订版) ”[7]进行治疗,包括氧疗、机械通气(依据患者病情使用),予以抗菌药物(根据患者药敏试验结果选择)、激素(如泼尼松、甲泼尼龙等)、支气管舒张剂(如β2受体激动剂、茶碱类药物)等药物治疗。全部患者均通过门诊、电话进行随访,每月1次,以病死作为研究终点事件,统计患者随访1年期间生存、病死情况。根据患者临床预后分为病死组与存活组。
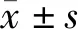
2 结 果
2.1 2组患者基线资料比较 全部患者接受1年随访,153例AECOPD伴气道黏液高分泌患者1年内病死31例(20.26%),存活122例(79.74%)。病死组患者COPD病程长于存活组,CASA-Q评分低于存活组,差异有统计学意义(P<0.01);2组间性别、年龄、吸烟史、高血压、糖尿病、FVC、FEV1/FVC、机械通气等资料比较差异无统计学意义(P>0.05)。见表1。
2.2 2组实验室相关指标比较 病死组患者初始PaCO2、TNF-α、PCT、IL-13水平高于存活组,Alb水平低于存活组,差异有统计学意义(P<0.01),2组pH、PaO2、WBC、NEU、CRP比较,差异无统计学意义(P>0.05)。见表2。
2.3 影响AECOPD伴气道黏液高分泌患者临床预后的COX回归分析 将AECOPD伴气道黏液高分泌患者临床预后作为因变量(1=病死,0=存活),将CASA-Q评分、PaCO2、Alb、TNF-α、PCT、IL-13作为自变量(均为连续变量),经COX回归分析显示,初始CASA-Q评分、Alb水平高是AECOPD伴气道黏液高分泌患者预后的保护因素,血清PCT、IL-13水平高为其危险因素(P<0.05),见表3。
2.4 血清PCT、IL-13对AECOPD伴气道黏液高分泌患者临床预后的预测价值 将初始血清PCT、IL-13作为检验变量,将AECOPD伴气道黏液高分泌患者临床预后作为状态变量(1=病死,0=存活),绘制ROC曲线,结果显示,血清PCT、IL-13单独及联合预测AECOPD伴气道黏液高分泌患者病死风险的AUC分别为0.856、0.815和0.938均>0.80,具有一定的预测价值,见表4、图1。
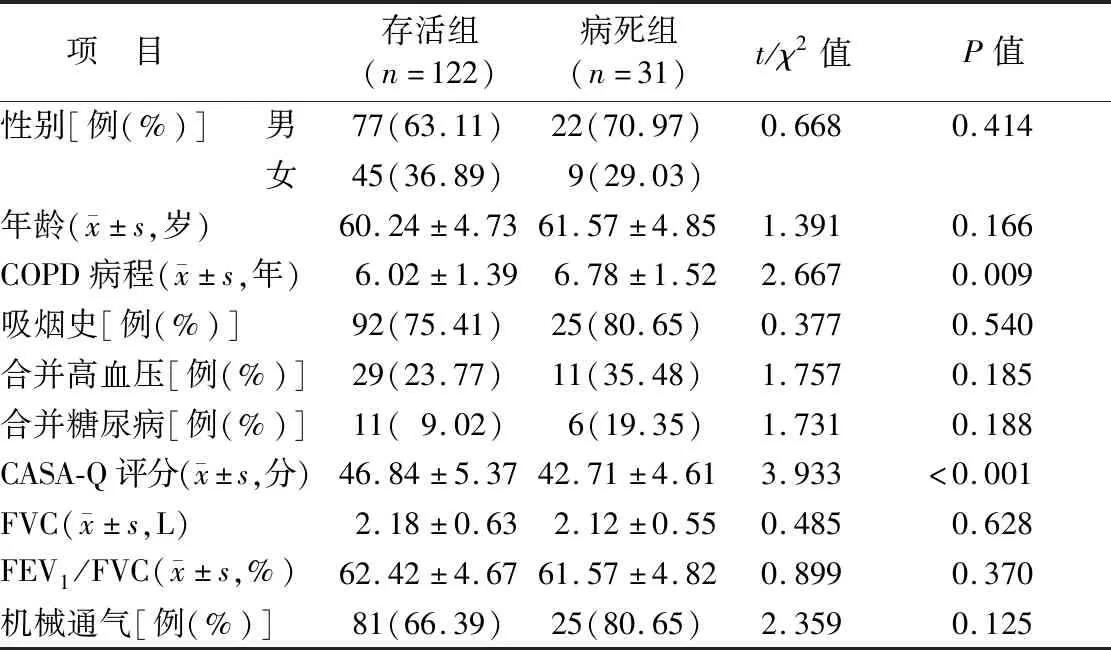
表1 存活组与病死组AECOPD患者基线资料比较Tab.1 Comparison of baseline data between survival group and death group
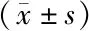
表2 存活组与病死组AECOPD患者实验室指标比较Tab.2 Comparison of laboratory parameters between the survival group and the death group
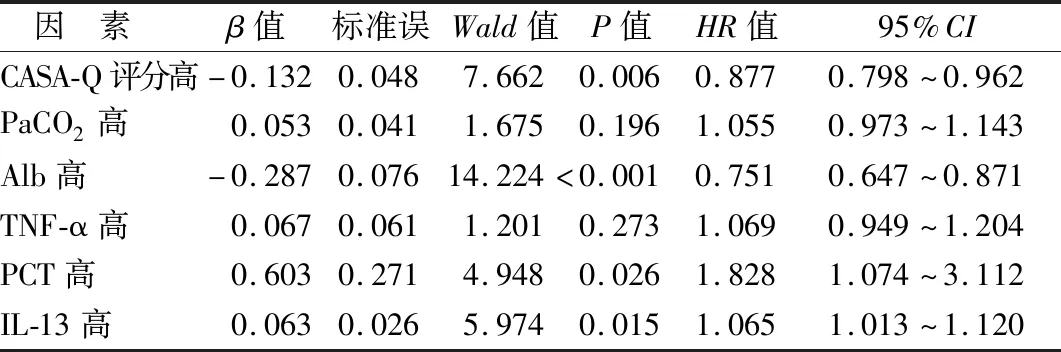
表3 AECOPD伴气道黏液高分泌患者临床预后影响因素的COX回归分析Tab.3 COX regression analysis of clinical prognostic factors in patients with AECOPD and airway mucus hypersecretion

表4 血清PCT、IL-13对AECOPD伴气道黏液高分泌患者临床预后的预测价值Tab.4 The predictive value of serum PCT and IL-13 on clinical prognosis in patients with AECOPD and airway mucus hypersecretion
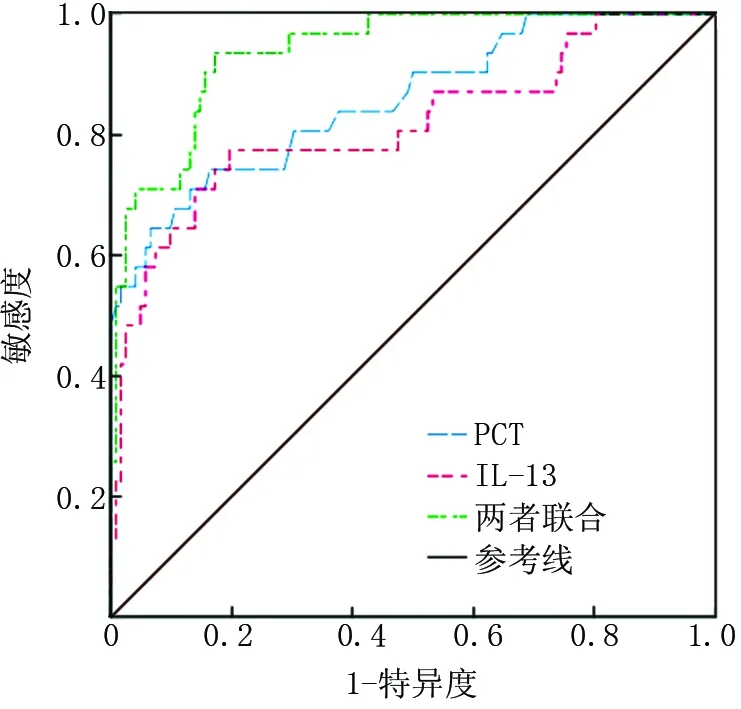
图1 血清PCT、IL-13预测AECOPD伴气道黏液高分泌患者临床预后的ROC曲线Fig.1 The ROC curve of serum PCT and IL-13 predicting the clinical prognosis of AECOPD patients with airway mucus hypersecretion
3 讨 论
气道黏液是由水分、蛋白质及黏蛋白等组成,对呼吸道具有清洁、防御作用,但受慢性炎性反应、蛋白酶失衡及氧化应激反应等影响,可引起气道黏液高分泌,进一步加重AECOPD患者气道阻塞,影响患者预后[8]。张明强等[9]研究发现,AECOPD患者1年内病死率高达18.63%。本研究中AECOPD 1年病死率为20.26%,高于上述研究,主要是由于伴有气道黏液高分泌会加重AECOPD患者肺功能损伤,加重其病情程度,增加患者病死风险。因此,分析AECOPD伴气道黏液高分泌患者临床预后有关的指标,可对患者预后的评估、早期的治疗干预提供参考。
CASA-Q评分越低患者呼吸道黏液分泌越多,气道阻塞程度越严重,且纤毛运动受影响越大,预后越差。PaCO2升高尤其是超过45 mmHg,提示患者存在CO2潴留,会增加患者脑脊液中氢离子浓度,减弱脑细胞的兴奋性,进而影响脑皮质活动,导致患者出现嗜睡、昏迷,影响患者预后[10]。白蛋白是为机体运输能量的载体,且对呼吸道黏膜上皮细胞具有防御、修复及再生能力;白蛋白水平降低不仅会影响AECOPD患者营养状态,也会减弱呼吸道抵抗致病菌的能力,加重患者病情,影响患者预后[11]。TNF-α水平升高会促进多种炎性因子释放,参与炎性反应引起的肺组织损伤,加重患者肺功能损害,增加AECOPD患者病死风险[12]。本研究经COX回归分析显示,2组PaCO2、TNF-α对AECOPD伴气道黏液高分泌患者临床预后无影响,但两者易受多种因素影响,如严重支气管扩张、胸廓塌陷可引起PaCO2升高,营养摄入不足、慢性消耗可降低白蛋白水平,各种损伤、炎性感染可影响TNF-α表达。因此,仍需要寻找更为准确、敏感的指标评估AECOPD伴气道黏液高分泌患者的临床预后。
PCT是由116个氨基酸组成的蛋白质,主要由甲状腺C细胞中降钙素裂解产生,在机体发生感染后2~4 h内会大量释放至血液,是感染的重要指标[13]。IL-13是由132个氨基酸组成的非糖基化蛋白,会破坏呼吸道表面液体层内钠离子、氯离子平衡,加重气道炎性反应,并引起气道黏液高分泌[14]。结合PCT、IL-13的作用,推测二者可能与AECOPD伴气道黏液高分泌患者预后有关。本研究发现,血清PCT、IL-13水平与AECOPD伴气道黏液高分泌患者临床预后有关,且可作为患者预后的预测指标。分析原因在于,PCT水平升高提示机体感染程度更重,尤其是气道黏液高分泌患者呼吸道内可能存在大量细菌繁殖,并释放细胞内毒素,加重患者病情程度[15]。此外,PCT水平不受激素、免疫制剂的影响,且与TNF-α相比,其对AECOPD患者感染程度的评估敏感度、准确度更高。Liu等[16]研究发现,PCT水平与新冠肺炎住院患者病情程度呈正相关,且PCT升高的患者预后较差。本研究与上述研究结果一致。IL-13水平升高会通过信号传导子和转录激活子(signal transducer and activator of transcription,STAT)信号通路加速STAT6的磷酸化,促进二聚体形成并进入细胞核内,进而放大AECOPD患者免疫应答反应,影响气道内水代谢,增加黏液的黏稠度,加重患者病情,甚至导致病死[17]。IL-13还能通过上调细胞外调节蛋白激酶(extracellular regulated protein kinase,ERK),促进多种生长因子下游蛋白,增加气道内黏蛋白合成,加重气道的慢性炎性反应,进而影响患者的预后[18]。
绘制ROC曲线显示,血清PCT、IL-13单独及联合预测AECOPD伴气道黏液高分泌患者病死风险的AUC>0.80,具有一定的预测价值。因此,临床应早期检测AECOPD伴气道黏液高分泌患者血清PCT、IL-13水平,针对二者水平异常升高的患者,采取相应的治疗措施,如使用强效的抗生素、联合2种及以上抗生素,降低PCT水平,积极控制患者感染程度;同时使用抗氧化剂醛糖还原酶抑制剂,降低IL-13水平,抑制IL-13引起的黏液分泌,有利于提高AECOPD伴气道黏液高分泌患者的治疗效果,降低患者病死风险。
综上所述,血清PCT、IL-13水平与AECOPD伴气道黏液高分泌患者临床预后有关,临床可早期检测患者血清PCT、IL-13水平,以预测疾病预后,并针对二者的异常表达,采取相应的治疗措施,有利于改善患者预后,降低病死风险。但本研究仅观察了患者入院时血清PCT、IL-13水平,并未做动态分析;且本研究仅统计了患者1年内的短期预后,也未观察1年内患者COPD急性发作次数、程度等指标,为本研究的不足之处,未来应在患者治疗及随访期间动态监测血清PCT、IL-13,并延长患者随访时间,更深入分析二者与AECOPD伴气道黏液高分泌患者预后的关系。
利益冲突:所有作者声明无利益冲突
作者贡献声明
覃英娇:课题设计,论文撰写;周向东、李琪:设计研究方案,试验指导,论文修改;钟有清:实施研究过程,资料搜集整理,试验指导,论文修改;王杰:实施研究过程,资料整理;刘峰:进行统计学分析

