AMPK/ACC通路参与高强度间歇、持续性运动 改善肥胖大鼠肝脏线粒体脂肪氧化功能的研究*
张 媛,李佳欣,刘小玮,韦 娟,张念云,盛 蕾
(1.南京体育学院 运动健康学院,江苏 南京 210014;2.上海交通大学 系统生物医学研究院 运动转化医学中心,上海 200240;3.杭州师范大学 体育学院,浙江 杭州 311121)
肥胖(obesity)是指体重增加、遗传因素、环境因素等多种因素相互作用下造成体内脂肪堆积过多和/或分布异常而引起的慢性代谢性疾病,已成为全球公共健康危机。据统计我国有46%成年人及15%儿童出现肥胖或超重,面临严峻挑战[1]。肥胖可诱发多种代谢综合征,包括:2型糖尿病(T2DM)、非酒精性脂肪性肝病(NAFLD)、心血管疾病等,相反,通过膳食与运动干预控制体重可显著降低肥胖人群的全因死亡率[2,3]。NAFLD的患病率及严重程度与肥胖上升趋势高度相关[4],在我国约70%-80%肥胖人群中伴随有NAFLD[5],由于NAFLD在早期阶段不易被诊断,因此由肥胖诱发的NAFLD发病率是未来十年的主要健康威胁之一[6,7]。营养过剩与缺乏运动是导致肥胖及NAFLD的常见诱因。若机体因肥胖或脂质代谢异常使脂肪细胞存储脂肪能力下降时,肝细胞则发挥类似脂肪细胞的脂质存储作用,将多余脂质以甘油三酯的形式储存在肝细胞中,从而逐渐造成肝脏脂肪变性[8,9]。脂肪酸氧化是肝脏脂代谢的主要通路之一,肝脏是进行脂肪酸氧化最活跃的组织,其主要氧化形式为β-氧化,需在线粒体中完成,因此提高肝脏线粒体功能以及对脂肪酸的氧化能力是改善肝脏脂质沉积有效机制。诸多研究证实,运动可从多方面缓解肥胖趋势、改善NAFLD进程,如:运动可调节正常肝脏与脂肪肝中的脂滴动力学[10],运动干预可通过改变肝脏氧化应激水平与炎症反应改善脂肪肝[11],运动通过调节特定细胞器线粒体的功能和结构来防治NAFLD[12]等。本研究通过建立营养性肥胖大鼠模型,并对其分别进行高强度间歇游泳训练(HIIT)、持续性游泳训练(CT)不同运动方式干预,拟探究不同运动方式干预对营养性肥胖大鼠肝脏脂质沉积、线粒体功能及脂肪氧化能力的影响,以期揭示其作用机制,为肥胖相关慢性疾病的防治提供理论依据和实验支撑。
1 材料与方法
1.1 营养性肥胖大鼠模型构建
4周龄健康雄性SPF级Sprague-Dawley大鼠80只,体重为68.4±2.4g,购自上海斯莱克实验动物有限公司,许可证号为SCXK(沪)2017-0005。大鼠每笼5只分笼饲养,适应性饲养1周后随机分为普通饲料(normal diet,N)组(国家标准啮齿类动物饲料饲养)和45%高脂饲料(high-fat diet,H)组,购自美国Research Diets公司,货号D12451,其中蛋白质占 20 kcal%,糖类35kcal%和脂肪45kcal%。所有大鼠自然光照,室内温度 20℃±5℃,相对湿度50%~70%且通风良好的条件下自由饮食饲养。本研究经过本校动物伦理委员会批准通过,符合中国实验动物制度伦理审查委员会关于动物实验的指导方针。饲养约8-9周后,称量大鼠体重并筛选出肥胖大鼠,筛选标准为:高脂饲料饲养的大鼠体重高于普通饲料饲养大鼠平均体重的20%即为单纯性肥胖大鼠[13]。
1.2 实验动物分组与训练方案
营养性肥胖大鼠建模成果后,从普通大鼠中选取36只普通大鼠随机分为普通安静(normal control, NC)组,普通高强度间歇训练(normal high intensity interval training, NHI)组,普通持续性训练(normal continuous training, NCT)组。从肥胖大鼠中选取36只肥胖大鼠随机分为肥胖安静(obese control, OC)组,肥胖高强度间歇训练(obese high intensity interval training, OHI)组,肥胖持续性训练(obese continuous training, OCT)组6组,每组12只。肥胖组大鼠各组均维持高脂膳食喂养。运动训练组(HIIT 和CT)大鼠在室温20℃~26℃环境中,于长1 m、宽0.5 m、 高0.7 m,水深60cm,水温31℃±1℃的玻璃泳池中进行游泳训练,具体训练方案参照(表1)[14]。Gobatto等研究得出5%-6%体重负重游泳为大鼠乳酸阈强度,因此本实验CT组游泳负重小于3%体重,HIIT组游泳负重大于5%[15]。大鼠负重按标准称量金属块于气球袋中缚大鼠尾部。训练过程中,若大鼠出现反复沉浮、失去平衡或协调性下降等情况,用器皿将其捞起休息片刻待恢复后继续训练,若大鼠漂浮水面静止不游动,用软毛刷等给予刺激,促其运动,以保证运动训练量。于每次训练结束后,用毛巾吹风机等干燥器具和手段将大鼠身体完全干燥,防止大鼠因皮毛湿润受凉。训练期间,及时观察并记录大鼠活动及进食饮水状况。末次训练后禁食12h后,称量大鼠体重,处死后取出肝脏于冰上用生理盐水清洗,剔除脂肪组织后称重,称取100mg新鲜肝脏组织冰上剪碎即刻放入盛有少量PBS缓冲液中,制备肝脏细胞悬液。另剪切一部分肝脏组织分置冻存管于液氮中速冻,-80℃超低温冰箱保存备用。
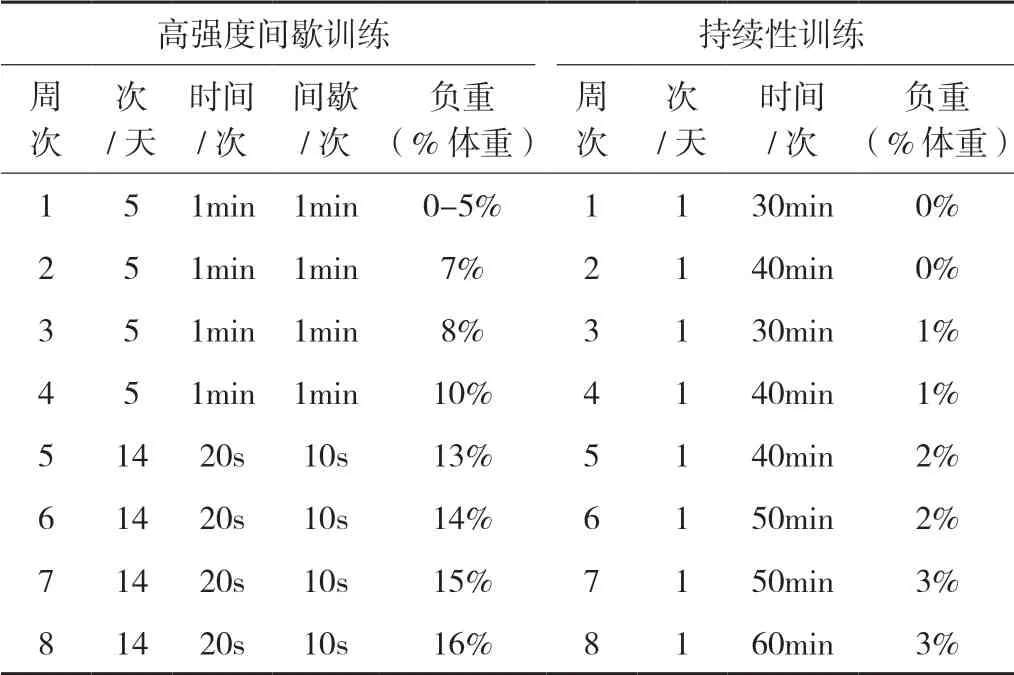
表1 高强度间歇训练(HIIT)和持续性训练(CT)方案
1.3 主要试剂和仪器
BCA蛋白定量试剂盒(货号23225)购于Thermo Scientific公司;肝脏TG检测试剂盒(货号A110-1-1)购于南京建成;细胞核蛋白与细胞浆蛋白抽提试剂盒(货号P0027)、线粒体提取试剂盒(货号C3606)、JC-1线粒体膜电位检测试剂盒(货号C2006)购于碧云 天公 司;CPT-1α(货 号ml058994)、β-HAD(货号ml058964)及ACC(货号ml059228)脂肪酶 ELISA试剂盒购于上海酶联生物;PGC-1α(货号20658-1-AP)购于Proteintech公司、p-AMPK(货号2535S)购于Cell Signaling、p-ACC蛋白一抗(货号AA110)购于碧云天公司,内参蛋白GAPDH一抗(货号为60004-1-Ig)购于proteintech生物公司,抗兔、抗鼠二抗(货号BS13278、BS12478)抗购于Bioworld公司。
蔡 司 显 微 镜(Axio imager A2),Biorad Western blotting 发光仪(ChemidocTM Touch Gel Imaging System #1708370),Tecan酶标仪(M200)
1.4 指标检测与方法
1.4.1 肝指数计算
测量各组大鼠体重和肝脏重量,按照公式计算:肝指数=肝脏重量(g)/体重(g)
1.4.2 生物化学法检测肝脏TG含量
GPO-PAP酶法检测肝脏TG含量。取新鲜肝脏组织剪碎冰浴匀浆,无水乙醇提取匀浆介质,2500 rpm离心10 min,取上清液,酶标仪检测TG含量,酶标仪检测波长510 nm吸光值,按照说明书带入公式计算出肝脏TG含量。
1.4.3 油红染色检测肝脏脂质含量
肝脏冰冻切片取6μm进行脂质染色,用PBS清洗3次后,采用4%多聚甲醛固定10 min, 油红O染液染色10 min, 苏木素染液复染5 min, 清洗后封片,脂滴颜色为橘红色,光镜显微镜400倍下随机选取5个视野,图像分析系统选用Image-J进行分析,计算每个视野下脂滴面积百分比。
1.4.4 ELISA检测肝脏组织酶活性
采用ELISA法检测肝脏组织CPT-1α、β-HAD、ACC脂肪氧化酶及CS酶活性,取部分肝脏组织剪碎加入缓冲液,冰浴匀浆后,离心取上清液,按照试剂盒说明书计算肝脏脂肪氧化酶活性。
1.4.5 流式细胞仪检测肝脏线粒体膜电位
新鲜肝脏组织约100mg,置于PBS冰上剪碎,冰浴上进行匀浆,经多次梯度离心后收集到线粒体沉淀,用线粒体储存液重选线粒体。对线粒体样本进行BCA蛋白定量。取50ug纯化线粒体,装载JC-1荧光探针后上流式细胞仪(ACEA NovoCyteTM)检测荧光强度。采集数据后,采用Novo ExpressTM软件进行分析,设置PE通道检测JC-1聚集物,发红色荧光,FL1(FITC)通道检测JC-1单体,发绿色荧光。若JC-1荧光染料聚集在线粒体基质中,将形成聚合物产生红色荧光,表明此时线粒体膜电位较高,相反,JC-1荧光染料在线粒体膜电位较低时,以单体形式存在,发出绿色荧光。由此,采用红、绿荧光的相对比例来衡量线粒体去极化的比例,反映线粒体膜电位的变化情况。以20μM浓度CCCP处理后的阳性对照为参照画门,检测线粒体膜电位,Q2-2区线粒体膜电位越高,Q2-4区膜电位越低。
1.4.6 肝脏细胞核蛋白与胞浆蛋白提取
取定量肝脏组织样本约100mg,采用细胞核蛋白与细胞浆蛋白抽提试剂盒,按照比例配置组织匀浆液,冰浴充分匀浆后4℃,1500g离心5min,上清液为部分细胞浆蛋白。向沉淀中添加抽提液,涡旋混匀后冰浴10-15分钟,4℃ 12,000-16,000g离心5min,上清液即为细胞浆蛋白。再次向沉淀中加入细胞核蛋白抽提液,每隔1-2分钟高速涡旋混匀,持续30分钟后,后4℃,12,000-16,000g离心10min,上清液即为细胞核蛋白,BCA法测定各样本蛋白浓度,-70℃冻存待用。
1.4.7 Western blot检测
按照BCA试剂盒说明书步骤提取蛋白并进行蛋白定量,50ug蛋白上样量经12.5% SDS PAGE凝胶电泳分离,后PVDF转印,5%脱脂奶粉室温封闭1.5h封闭 后加 抗PGC-1α、p-AMPK、p-ACC、GAPDH一抗于4℃冰箱过夜。次日,TBST洗膜3次每次10min,加二抗室温孵育1.5h,TBST洗膜后,使用ECL超敏化学试剂(美国bioworld)反应一定时长后,置于化学发光成像系统(BIO-RAD,美国)进行曝光,发光结果采用Image Lab Software 5.2(BIO-RAD,美国)处理分析。
1.5 数据统计处理
所有数据结果使用Execl软件(美国Microsoft)整理并表示为均值±标准差(mean±SD),采用GraphPad Prism 5.01软 件(美 国GraphPad Software)对数据进行双因素方差分析(Two-way ANOVA)并作图,P<0.05时为具有显著统计学差异。
2 实验结果
2.1 大鼠体重及肝指数
由图1及表2可知,营养性肥胖大鼠与普通大鼠相比,大鼠体重、肝脏重量及肝指数均显著增高(P<0.05)。与NC组相比,8周HIIT与CT运动干预后,NCT组大鼠体重显著降低(P<0.05),NHI组肝脏重量显著下降(P<0.05)。与OC组相比,8周HIIT与CT运动干预后,OHI、OCT组大鼠体重、肝脏重量及肝指数均显著降低(P<0.05)。
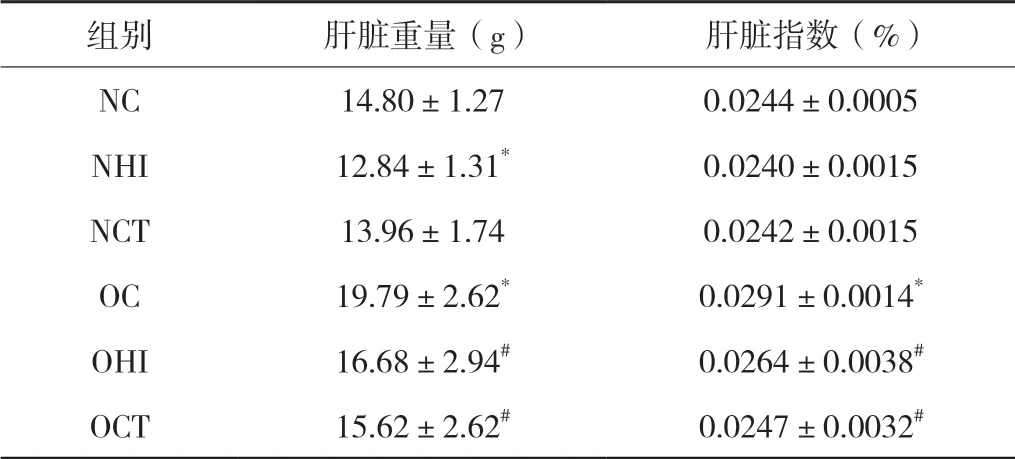
表2 各组大鼠肝脏重量及肝指数变化
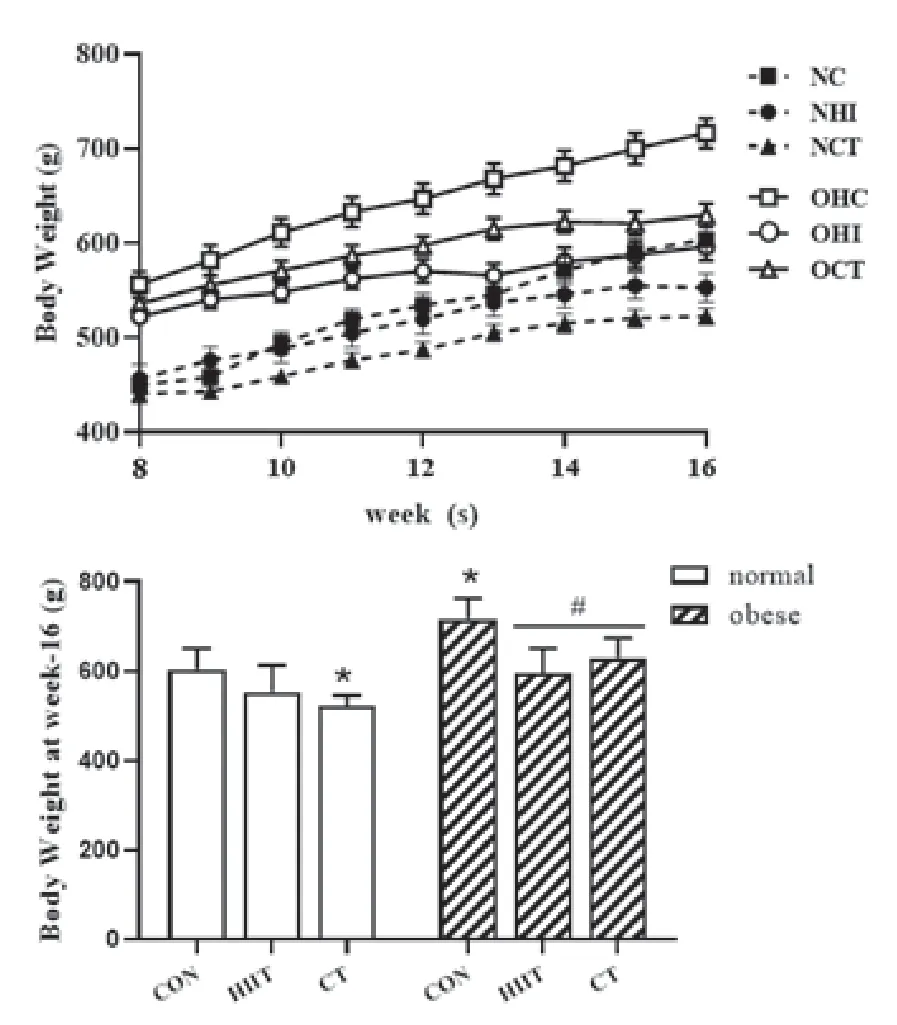
图1 不同运动方式干预后正常、肥胖大鼠体重变化
2.2 大鼠肝脏脂质含量
与NC组大鼠相比,OC组大鼠肝脏组织脂滴含量显著增高,(P<0.05)。8周运动训练干预后,普通、肥胖大鼠肝脏脂滴均显著下降(P<0.05)见图2。OC组大鼠肝脏TG含量显著增高,HIIT运动干预后显著降低NC和OC肝脏TG含量(P<0.05),而CT对肝脏TG含量的干预效果不明显,见图3。

图2 肝组织油红O染色(比例尺=20μm)及脂肪滴总面积百分比

图3 各组大鼠肝脏TG含量
如图4所示,与NC组大鼠相比,OC组大鼠AMPK与ACC磷酸化水平无显著变化。与OC组大鼠比较,HIIT干预后,肝脏AMPK与ACC磷酸化水平显著增高(P<0.05),而CT仅对肥胖大鼠p-ACC含量有显著影响(P<0.05)。此外,与普通大鼠相比,肥胖大鼠脂肪合成酶ACC活性显著增高(P<0.05),CPT-1α、β-HAD等脂肪分解酶活性无显著变化。HIIT可显著提高普通、肥胖大鼠CPT-1α、β-HAD等脂肪分解酶活性(P<0.05),同时降低肥胖大鼠脂肪合成酶ACC活性(P<0.05),而CT对各组大鼠线粒体脂肪氧化酶活性作用不明显,见图5。

图4 各组大鼠肝脏AMPK/ACC蛋白表达
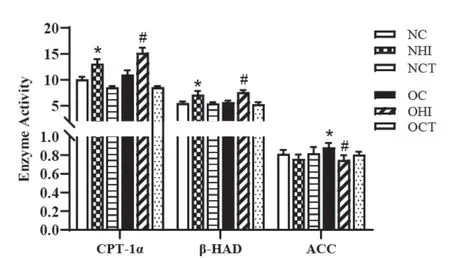
图5 各组大鼠肝组织线粒体脂肪氧化酶活性变化
2.3 大鼠肝脏线粒体功能
与NC组大鼠相比,OC组线粒体低膜电位比例显著增高(P<0.05);与OC组大鼠相比,8周HIIT、CT运动训练干预后OHI与OCT组线粒体低膜电位比例显著降低(P<0.05),见图6。与安静组相比,8周HIIT与CT干预使肝细胞核PGC-1α蛋白表达量升高(P<0.05),8周HIIT运动干预可显著提高普通、肥胖大鼠线粒体柠檬酸合酶(CS)活性(P<0.05),见图7。

图6 各组大鼠肝组织线粒体膜电位

图7 各组大鼠肝组织线粒体PGC-1 α表达量即CS活性
3 分析与讨论
3.1 不同运动方式对大鼠体重及肝指数的影响
近些年,诸多人体与动物实验研究关注高强度间歇运动(HIIT)与持续性运动(CT)两种不同运动方式对超重、肥胖及与之相关慢性病的影响[16-18]。本研究中,高脂膳食诱导的营养性肥胖大鼠在进行8周HIIT或CT干预后,其体重均低于安静肥胖大鼠,说明两种运动方式均可达到减轻体重的效果。目前,大量研究已充分证实肥胖与NAFLD之间具有较高度相关,肥胖不仅与NAFLD的初始阶段有关,如单纯性脂肪变性(SS,simple steatosis),而且与其严重程度有关,从流行病学的观点来看,两种疾病在世界范围内的发病率持续上升[19]。Pegah Golabi等对NAFLD患者结合膳食或运动干预后实验研究的荟萃分析结论表明:患者每周3-7天,为期8-48周的运动训练可动员30.2%的肝脏脂肪,运动对分解肝细胞内甘油三酯的促进作用独立于对体重的影响,并且有氧与抗阻运动方式对其影响不存在显著差异[20]。本研究发现,与正常大鼠相比,肥胖肝脏重量及肝指数指标均显著增高,说明肥胖在一定程度上导致脂肪在肝脏组织中异位沉积,表现为NAFLD发展的早期阶段。肥胖大鼠在进行8周HIIT与CT干预后,其肝脏重量与肝指数呈显著下降,提示两种运动方式对缓解肝脏脂肪异位沉积均具有显著效果。
3.2 不同运动方式对大鼠肝脏AMPK/ACC通路调节下脂代谢的影响
脂肪代谢不平衡往往是诱发NAFLD的直接病因[21]。研究表明:导致肝脏脂质沉积的FFAs主要来自外周脂肪分解[22]。其次,来自肝脏脂肪从头合成(DNL,de novo lipogenesis)[23]。Samuel 等研究发现:骨骼肌IR会导致高血糖症和高胰岛素血症,两者作用可促进脂肪合成酶表达水平,使肝脏中葡萄糖合成FFAs增加[24]。另一方面,FFAs的清除是决定FFAs稳态的另一重要环节。肝脏FFAs主要通过线粒体β氧化和再酯化合成甘油三酯进一步代谢。NAFLD早期肝细胞内FFAs内流增加,增强线粒体脂肪氧化,是代偿性降低肝脏脂肪积累的适应性表现。Kakimoto等研究表明肝脏线粒体脂肪氧化能力在HFD喂养4周时有所降低,而在喂养8周时却得以恢复,提示HFD诱导的受损肝脏线粒体功能具有一定重塑性[25],其可能与提高线粒体功能及肉碱棕榈酸转移酶1(CPT-1)、轻脂酞辅酶脱氢酶(β-HAD)活性有关[26-27]。Ningning Wang等人采用膳食诱导型肥胖小鼠为实验对象,在进行8周HIIT或CT干预后,HIIT可通过调节乙酰辅酶A羧化酶(ACC)等脂质合成基因及CPT1α、β-HAD等β氧化基因mRNAs水平,显著抑制肝脏脂质合成[17]。本研究结果显示,与正常大鼠相比,肥胖大鼠肝脏脂质沉积现象明显,肝细胞TG含量显著增高,油红染色脂滴含量大幅增加,在经过8周运动训练干预后,肝脏甘油三酯含量显著下降,其中肥胖大鼠的HIIT干预效果优于CT,提示HIIT与CT两种不同的运动方式对肝脏脂质代谢的调节作用存在不同机制。
AMPK是细胞内重要的能量调控分子,也是肝脏重要的脂代谢调节分子之一。AMPK激活后对改善NAFLD的作用主要通过三个方面发挥作用:1)抑制肝脏从头合成作用。研究表明,ACC是AMPK下游的重要调节因子之一,存在于肝细胞内,可催化乙酰CoA进行脂肪酸的从头合成,是肝脏TG合成的重要限速酶。磷酸化的p-AMPK可使ACC磷酸化失活,从而抑制脂肪酸的从头合成[28]。2)提高肝脏脂肪酸氧化。AMPK激活后对ACC的失活作用,可进一步抑制丙二酰辅酶A(M-CoA),其为线粒体脂肪酸氧化过程CPT-1限速酶的抑制剂[29]。因此,AMPK激活可促进脂肪酸在CPT-1的协助下进入线粒体基质进行β氧化。研究发现:AMPK表达下降可使肝脏脂肪生成增加,脂肪酸氧化减少[30]。相反,肝脏AMPK过表达可降低脂质生成相关基因表达,从而降低肝脏TG含量,同时增加脂肪酸氧化相关基因表达,促进线粒体β氧化[31-32]。3)增强线粒体功能。线粒体是细胞ATP生成部位,细胞ATP生成与消耗直接影响AMPK的激活程度,同时线粒体也是脂肪被彻底氧化的核心场所,线粒体功能与脂肪氧化效率密切相关[33]。
AMPK对细胞内ATP/ADP比值的变化敏感,其主要由干扰ATP生成(如线粒体抑制剂/解耦剂)或加速ATP消耗(如运动)的能量挑战引起的AMP/ATP比值增加而被激活。研究证实,激活AMPK通路是运动改善脂肪肝的重要机制之一[34-35]。人体研究表明,运动与膳食干预是改善成人[36]及青少年[37]NAFLD患者的有效手段。动物实验证实,运动训练课降低NAFLD表现,而停训将导致脂肪肝变性[38]。Xuejie等研究报道,急性和慢性运动均可间接激活2型糖尿病大鼠肝脏AMPK/ACC信号通路,提高肝脏胰岛素敏感性,而慢性或长期运动将进一步通过AMPK/ACC信号通路调节肝脏脂质代谢[39]。有研究发现,运动增加NAFLD小鼠AMPK和CPT1蛋白表达水平,促进脂肪酸β氧化,降低体重,减轻和逆转肝脂肪变性[40]。本实验研究发现,普通与肥胖大鼠相比,AMPK/ACC信号通路表达水平无显著差异,肥胖大鼠ACC酶活性显著高于普通大鼠,提示肥胖大鼠肝脏脂肪合成率较高。HIIT可显著上调普通、肥胖大鼠肝脏AMPK、ACC磷酸化水平,并显著提高线粒体β氧化酶CPT-1、β-HAD活性,同时抑制肥胖大鼠脂肪合成酶ACC活性。正常与肥胖大鼠在8周CT运动干预后ACC磷酸化水平显著增高,ACC酶失活增加,抑制脂肪 合成。
3.3 不同运动方式对大鼠肝脏线粒体功能的影响
线粒体脂肪氧化水平对维持肝脏细胞脂质平衡具有重要意义,线粒体功能失调可导致肝细胞发生脂肪蓄积,触发炎症与纤维化反应导致NAFLD的发生发展[41]。肥胖、T2DM患者线粒体过氧化物酶体增殖物激活受体γ共激活因子1(PGC-1)表达下调,线粒体DNA突变,线粒体数量减少,氧化磷酸化能力下降[42-43]。Sanyal等研究发现,NASH患者肝脏脂肪β氧化显著增高,线粒体结构受损,线粒体脊缺失,提示营养性肥胖造成的长期β氧化代偿性增强可导致线粒体受损和功能降低[44]。同样有研究发现:NASH的严重程度与肝脏线粒体功能下降显著正相关[45]。啮齿类动物研究表明,跑步可增强肝脏线粒体功能,提高新鲜提取肝脏的棕榈酸氧化水平,同时增加肝脏CPT-1酶活性[46-47]。此外,肝细胞凋亡也参与了NAFLD的发生和进展,胞浆中线粒体状态变化则是细胞凋亡病理改变的重要部分[48]。研究表明:不同NAFLD阶段的肝脏线粒体ETC复合物活性、耗氧率、氧化磷酸化(OXPHOS)效率以及线粒体膜电位呈现出不同变化特征,导致这些差异的原因可能与疾病病程肝脏氧化应激程度不同有关。如Koliaki等发现肝脏线粒体OXPHOS效率在简单脂肪变性机体中显著增高,而在NASH患者中显著下降[49]。基因瘦素缺陷ob/ob小鼠和瘦素抵抗db/db小鼠以中度肝炎症和轻度纤维化为特征[50],其肝脏线粒体氧化能力有所增强,而ETC复合物活性被显著抑制,NASH的肝脏线粒体ETC明显受损[51-52]。线粒体膜电位作为检测细胞凋亡的有效指标,反映了肝脏细胞在不同时期的状态。营养性肥胖机体肝脏组织由于脂质过氧化产物增加,易引起线粒体膜上通透性增加,导致跨膜电位降低, 膜完整性及线粒体呼吸链受损[53]。研究发现,与普通大鼠相比,9周高脂膳食大鼠肝脏线粒体膜电位显著下降,而对其进行每天1小时,每周 5天,为期8周的运动训练干预后,与安静组相比,大鼠肝脏膜电位得以恢复,这一改变与运动训练提高线粒体内膜卵磷脂与脑磷脂的含量比值有关[54]。提示,运动干预促进线粒体内膜结构物质合成水平增高,线粒体膜通透性被稳定,膜电位正常,线粒体生物机能增强。与之前研究结果相似,本研究同样发现,与普通大鼠比较,营养性肥胖大鼠线粒体低膜电位比例显著增高,8周HIIT或CT干预均可使线粒体低膜电位比例明显降低,并趋于普通大鼠水平,说明不同运动方式对优化线粒体功能的重要调节作用。其次,8周HIIT使普通、肥胖大鼠肝脏线粒体生物发生关键因子PGC-1表达水平、CS活性均显著增高,而CT对线粒体的作用效果弱于HIIT,提示,肝脏线粒体在HIIT运动干预下表现出更强的运动适应性。
4 结论
综上所述,HIIT运动干预可通过AMPK/ACC通路调节肥胖大鼠肝脏脂代谢酶活性,提高线粒体功能及脂肪氧化水平,缓解营养性肥胖大鼠肝脏脂质沉积,干预效果更佳。CT运动干预可提高肥胖大鼠ACC磷酸化水平,抑制肝脏脂肪合成,亦可在一定程度上缓解肝脏脂质沉积,两者在线粒体水平调节肝脏脂代谢的分子机制仍有待进一步研究。

