食管鳞癌组织微小RNA-138、微小RNA-145表达水平与1型/2型辅助性T细胞漂移和预后的关系
原野 刘涛 刘华
食管癌是我国常见的恶性肿瘤之一,我国2015年食管癌发病24.6万例,死亡18.8万例[1]。食管癌中以鳞癌最为常见,占90%以上[2]。诊断及治疗技术的发展改善了食管鳞癌病人的预后,但其治疗后仍容易产生复发、转移及耐药等[3]。微小RNA(micro RNA,miR)长度为20到24个核苷酸,可以结合靶基因实现转录后调控基因表达[4-5]。miR能够影响1型辅助性T细胞(T-helper 1,Th1)和2型辅助性T细胞(T-helper 2,Th2)的细胞因子分泌功能,引起机体Th1/Th2免疫平衡状态失调,即发生Th1/Th2漂移,导致自身免疫疾病及肿瘤疾病的发生[6-7]。miR-138的编码基因位于3p21.32。研究显示,miR-138在胶质瘤[8]、肺癌[9]等恶性癌症中表达下调,导致下游促癌因子如SIRT1表达升高,抑制肿瘤细胞的自噬,促进肿瘤细胞的恶性增殖。miR-145的编码基因位于5p32。研究表明,miR-145在人类前列腺癌[10]、结直肠癌[11]等肿瘤中表达降低,诱导干性细胞标志过度表达,促进肿瘤的恶性增殖。本研究检测miR-138、miR-145在食管鳞癌中的表达,分析两者表达与Th1/Th2漂移和病人预后的关系。
对象与方法
一、对象
2015年5月~2018年5月期间我院收治的112例食管鳞癌病人为食管鳞癌组。纳入标准:(1)手术切除标本经术后病理确诊为食管鳞癌;(2)术前未接受放化疗;(3)具备手术指征,均完成食管癌根治术;(4)无严重的术后并发症,预计生存时间>3个月。排除标准:合并其它肿瘤;术前合并严重的心肺功能衰竭;伴自身免疫性疾病。食管鳞癌组,男性73例,女性39例;年龄33~76岁,平均年龄(54.51±5.73)岁;分化程度:高中分化70例,低分化42例;肿瘤分期:Ⅰ~Ⅱ期86例,Ⅲ期26例;肿瘤位置:上中胸段78例,下胸段34例;肿瘤直径≤5 cm 49例,>5 cm 63例。同期70例健康体检人群作为对照组,男性45例,女性25例;年龄34~77岁,平均年龄(52.32±5.86)岁。两组性别、年龄等比较差异无统计学意义(P>0.05)。研究对象对研究知情同意并签署同意书。本研究经我院伦理委员会审核通过。
二、方法
1.实时荧光定量聚合酶链反应(Real time fluorescence quantitative polymerase chain reaction,qRT-PCR)检测:将手术切除的食管鳞癌组织和癌旁组织(距离肿瘤组织边缘>3 cm)超声破碎研磨,离心去除细胞碎片,以Trizol提取组织RNA。以逆转录试剂盒将RNA逆转录合成cDNA。进行qRT-PCR检测。总体系20 μl,包括FastFire qPCR PreMix 10 μl,引物2 μl,模板2 μl,纯水6 μl。引物序列见表1。反应条件为:94 ℃预变性10分钟,94 ℃变性15秒,55 ℃退火30秒,70 ℃延伸30秒,共40个循环。结果以2ΔΔCt值表示,共进行3次平行试验,取平均值。

表1 引物序列
2.酶联免疫吸附试验(ELISA)检测:取食管鳞癌组入院时及对照组体检当日静脉血5ml,4 ℃ 4 000 r/min离心5分钟,留取上层血清,-80 ℃保存待测。ELISA检测血清中Th1型细胞因子γ干扰素(IFN-γ)、白细胞介素(IL)-2与Th2型细胞因子IL-4、IL-10的水平。向酶标板每孔添加100 μl样品及标准品,37 ℃孵育90分钟,加入200 μl生物素标记抗体,37 ℃孵育60分钟,TBS洗涤3次,加入100 μl ABC液,37 ℃孵育30分钟,TBS洗涤3次,加入TMB液后37 ℃避光孵育30分钟,加终止液后上酶标仪读OD450值。以标准品的浓度为横坐标,以各标准品的OD值为纵坐标,绘制标准曲线。
3.随访:出院后每3个月进行1次随访,以电话或门诊复查的方式随访,随访3年,随访截止日期2021年6月30日,随访截止至病人死亡或随访结束。
三、统计学分析
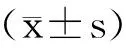
结果
1.食管鳞癌组织及癌旁组织中miR-138、miR-145表达水平:食管鳞癌组织中miR-138、miR-145的表达水平分别为(1.155±0.232)、(1.110±0.217),癌旁组织中分别为(4.155±0.732)、(3.910±0.617),食管鳞癌组织中miR-138、miR-145的表达水平明显低于癌旁组织,差异有统计学意义(P<0.05)。
2.食管鳞癌组织中miR-138、miR-145表达水平的相关性:采用Pearson线性相关分析食管鳞癌组织中miR-138与miR-145表达水平的相关性,结果发现,两者表达水平呈正相关(r=0.596,P<0.05)。见图1。
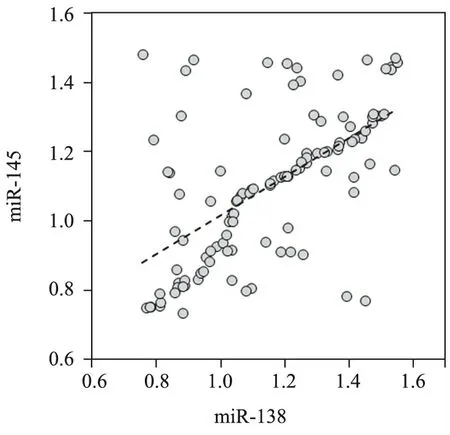
图1 食管鳞癌组织中miR-138、miR-145表达水平的相关性
3.食管鳞癌组织中miR-138、miR-145表达与临床病理参数的关系:食管鳞癌组织中miR-138、miR-145的表达与肿瘤分期有关,差异具有统计学意义(P<0.05),而miR-138、miR-145的表达与病人性别、年龄、肿瘤直径、分化程度及肿瘤位置无关,差异无统计学意义(P>0.05)。见表2。
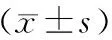
表2 食管鳞癌组织中miR-138、miR-145表达与临床病理参数的关系
4.两组血清Th1和Th2类细胞因子的表达比较:食管鳞癌组病人血清Th1型细胞因子IFN-γ、IL-2水平明显低于对照组,而Th2型细胞因子IL-4、IL-10水平明显高于对照组(P<0.05)。见表3。

表3 食管鳞癌组、对照组血清Th1和Th2类细胞因子的表达比较(ng/L)
5.食管鳞癌病人miR-138、miR-145表达与Th1/Th2漂移的关系见表4。。结果表明,miR-138、miR-145表达与Th1型细胞因子呈正相关,而与Th2型细胞因子呈负相关(P<0.05)。
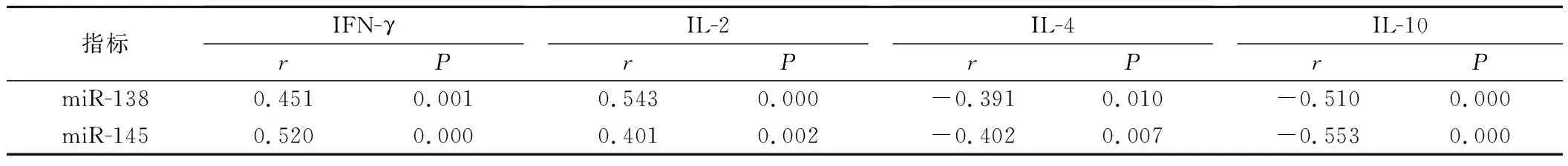
表4 食管鳞癌病人miR-138、miR-145表达与血清Th1和Th2类细胞因子的关系
6.不同miR-138、miR-145表达情况食管鳞癌病人生存情况:随访3年,失访1例。随访期间死亡70例,3年总体生存率(overall survival,OS)为36.94%(41/111)。根据miR-138表达的平均值1.155将病人分为miR-138高表达组和低表达组,miR-138高表达、低表达病人的3年OS分别为58.49%(31/53)、17.24%(10/58),miR-138低表达病人3年OS明显较低(Log-rankχ2=4.151,P<0.05);根据miR-145表达的平均值1.110将病人分为miR-145高表达组和低表达组,miR-145高表达、低表达病人的3年OS分别为52.73%(29/55)、21.43%(12/56),miR-145低表达病人的3年OS明显较低(Log-rankχ2=3.863,P<0.05)。见图2。
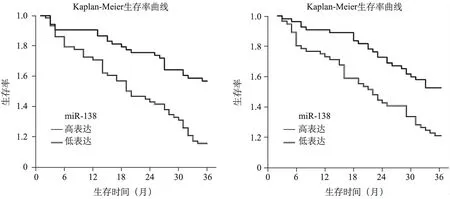
图2 不同miR-138、miR-145表达情况食管鳞癌病人的生存曲线
讨论
食管癌病人通常预后较差[12]。食管鳞癌是食管癌主要的组织病理学亚型。目前,食管癌的治疗以手术及放化疗为主,病人生存预后不理想[13]。分子靶向及免疫治疗是近年来肿瘤治疗新的发展方向。肿瘤的发生发展与肿瘤的免疫逃逸关系密切。目前研发出针对免疫检查点进行治疗的药物,如纳武单抗等,能够显著改善肿瘤病人的临床疗效,延长生存时间[14-15]。
miR是细胞内无蛋白编码功能的核苷酸分子。miR通过参与构成RNA诱导的沉默复合物,抑制基因的表达,影响细胞的增殖分化等过程。研究发现,肿瘤中存在大量miR表达失衡的现象,形成复杂的调控网络,在肿瘤细胞的增殖、迁移过程中发挥重要的生物学作用[16]。miR-138、miR-145分别位于人类3号和5号染色体。生理状态下,miR-138、miR-145参与胚胎干细胞的分化调节,还参与免疫细胞如调节性T细胞的分化成熟过程,进而影响机体1型和2型辅助性T细胞的平衡。此外,miR-138、miR-145在人类多种疾病,如支气管哮喘、成骨细胞分化障碍等疾病中均存在异常表达的现象,影响疾病的发生发展[17-18]。本研究表明,食管鳞癌中miR-138、miR-145表达水平明显降低。食管鳞癌中miR-138表达下调的原因与转录调控异常有关。Tang 等[19]研究表明,HOXA4能直接结合miR-138启动子区域,调控miR-138的表达,肿瘤发生时HOXA4表达下调,导致miR-138表达水平降低。miR-145的表达受到甲基化调控的影响,Gao 等[20]报道,鼻咽部鳞癌中miR-145表达下调与启动子区域的高甲基化有关,抑制肿瘤细胞中miR-145的甲基化后,miR-145表达上调,并通过激活癌基因肌成束同源蛋白1的表达,促进肿瘤进展。食管鳞癌中miR-145的表达下调亦可能与甲基化修饰有关。
本研究结果发现,miR-138、miR-145的低表达与较高的肿瘤分期、淋巴结转移有关,表明miR-138、miR-145的低表达可促进食管鳞癌的恶性进展。miR-138、miR-145在肿瘤中均发挥抑癌基因的功能,Wang 等[21]报道,miR-138能够靶向抑制致癌基因人类端粒酶逆转录酶(human telomerase reverse transcriptase,hTERT)的表达,在结直肠癌中miR-138表达下调,hTERT显著激活,导致肿瘤的恶性进展;此外,miR-145也具有抑制癌基因表达的功能,Li 等[22]报道,miR-145能够抑制原癌基因的表达,进而抑制下游谷氨酰胺的合成,发挥抑制肿瘤代谢的功能,因而miR-145的低表达促进肿瘤代谢,导致肿瘤进展。本研究结果表明,miR-138、miR-145低表达病人生存预后较差,证实miR-138、miR-145在食管鳞癌中具备重要的肿瘤抑制功能,检测miR-138、miR-145的表达水平有利于评估食管鳞癌病人的生存预后。
正常机体免疫的平衡涉及 Th1 和 Th2活性之间的稳态。Th1细胞驱动1型通路(细胞免疫)来对抗病毒和其他细胞内病原体,消除癌细胞,并刺激迟发型超敏反应。Th2细胞驱动2型通路(体液免疫)并上调抗体产生以对抗细胞外生物,提高对异种移植物的耐受性。任何一种模式的过度激活都会导致疾病。本研究发现,与对照组相比,食管鳞癌病人Th1型细胞因子水平显著降低,而Th2型细胞因子水平显著升高,提示食管鳞癌病人存在Th1/Th2漂移的现象。相关性分析证实,miR-138、miR-145的表达与Th1/Th2漂移密切相关,表明食管鳞癌中miR-138、miR-145可能是通过促进Th1/Th2漂移,进而导致食管鳞癌的恶性进展。Qiu 等[17]研究表明,miR-138,miR-544,miR-145等能够通过结合并抑制转录因子Runx3的表达,促进Th1/Th2漂移,进而导致疾病进展,而在过表达Runx3后,则能够重新恢复Th1/Th2的平衡。因此,以miR-138、miR-145为靶点进行治疗可能通过恢复Th1/Th2平衡,阻止食管鳞癌的进展。本研究通过相关性分析发现miR-138与miR-145的表达水平呈正相关。两者之间相互作用关系尚不清楚,但两者在食管鳞癌中均发挥抑癌基因的功能,并且具有相同的下游作用靶点,如Runx3,进而影响Th1/Th2漂移状态。因此,两者在食管鳞癌中可能通过相互协同发挥生物学功能,同时针对两个靶点的治疗可能提高肿瘤的治疗疗效。
综上所述,食管鳞癌组织中miR-138、miR-145表达下调,并且两者的表达呈正相关,miR-138、miR-145的低表达与较高的肿瘤分期有关,miR-138、miR-145的低表达可能通过促进Th1/Th2漂移,参与食管鳞癌的进展。

