miRNA-155、miRNA-21和Th1、Th2、Th17相关细胞因子在急、慢性布鲁菌病患者中的表达及其意义
徐 峥,谢松松,阿孜古丽·阿布来提,谭风雷,张跃新
(1新疆医科大学第一附属医院,乌鲁木齐 830054;2石河子大学第一附属医院,新疆 石河子 832000)
布鲁菌病(Brucellosis,以下简称布病),是全球范围内重要的人畜共患性传染病之一。21世纪以来我国布病发病率呈迅速增长的趋势[1],已成为严重影响农牧区人民健康和经济发展的重要地方性传染病。布鲁菌作为胞内寄生菌,可通过其免疫调节机制实现免疫逃逸进而造成机体慢性感染,T细胞亚群及其细胞因子共同组成的免疫调节网络在其中发挥着不可替代的作用。既往的研究认为,Th1类细胞及其相关细胞因子多表达在布病急性期,具有促炎作用[2-3],Th2类细胞及其相关细胞因子多表达在布病的慢性期,发挥抑炎作用,不利于机体对布鲁菌的清除[4-5],而Th17类细胞及其细胞因子在布病中的表达目前尚无一致性报道。随着研究的深入,人们还发现一类内源性基因非编码的单链小分子RNA(miRNAs),可通过整合进RNA诱导的沉默复合体(RISC)的方式与靶mRNA的结合,降解靶mRNA或抑制蛋白质的翻译从而调控基因表达,影响细胞的分化、增殖和凋亡[6],T细胞亚群及其细胞因子均可受到miRNAs的调控,影响其分泌和表达。其中又以miRNA-155、miRNA-21与Th1、Th2类细胞关系密切:miRNA-155可下调已经活化的IFN-γ受体,促使Th0向Th1分化[7],同时又可抑制靶基因Jarid 2,增强Th17的促炎效应[8]。miRNA-21通过在T细胞上表达Sprouty1,刺激Th2的分化[9],同时可抑制树突状细胞产生IL-12,下调Tbet和IFN-γ表达量,抑制Th1的分化。布病作为一种与免疫紧密关联的感染性疾病,机体应对感染的过程中也可能存在miRNAs与T细胞亚群细胞因子间复杂的调控网络,基于本团队学者[10-12]在对布病感染后机体Th1/Th2类免疫反应的研究基础之上,本研究通过分析miRNA-155、miRNA-21以及细胞因子IL-18、IL-33等指标,观察布病急、慢性期患者miRNAs以及Th1、Th2和Th17相关细胞因子的表达,探讨以上指标在不同分期的布病患者中表达的免疫特点与临床意义。
1 资料与方法
1.1 研究对象本研究属于前瞻性设计,于2020年1-11月选取石河子大学医学院第一附属医院收治确诊的布病患者共73例。急性期患者42例,其中男性22例,女性20例;慢性期患者31例,其中男性19例,女性12例;健康对照者30例,其中男性16例,女性14例。所有病例参照2017年中华传染病杂志颁布的《布病诊疗专家共识》[13]进行诊断,临床分期以病程在6个月以内为急性期;病程超过6个月为慢性期。
1.2 主要试剂及仪器Human Th Cytokine Panel试剂盒购自美国Biolegend公司,TaqDNA聚合酶和dNTP,荧光实时定量PCR试剂,逆转录试剂盒购自天根公司。
1.3 标本采集与处理细胞因子的采集:分别采集清晨空腹状态的急、慢性布病患者以及健康对照者的外周静脉血5 mL,其中采用抗凝管采集的血标本送往流式细胞仪进行检测,不含抗凝剂管的血标本离心后分离血清,于-80℃备用。miRNAs的采集:分别采集清晨空腹状态的急、慢性布病患者以及健康对照者的外周静脉血5 mL,离心后留取上层血浆样本1 mL至无RNA酶的EP管中,于-80℃备用,剩余血样用于提取外周血单个核细胞。
1.4 CBA法检测细胞因子水平收集布病患者清晨静脉血标本4 mL,4 000 r/min离心5 min,分离血清,用移液枪将血清分装移至1.5 mL的EP管中,-80℃冰箱保存备用。采用CBA技术检测急、慢性期布病患者及对照者血清中Th1类细胞因子(IFN-γ、TNF-α、IL-18)、Th2类细胞因子(IL-10、IL-33)和Th17类细胞因子(IL-17)水平,严格按照试剂盒说明书操作,并进行质控。用流式细胞分析仪读取数据,根据标准曲线计算样本中各细胞因子的浓度值。
1.5 qRT-PCR法检测miRNAs水平对外周血单个核细胞提取总RNA,按照说明书进行反转录操作,所得cRNA于-20℃条件保存备用。以U6为内参(引物primer express 2.0软件设计由上海生工生物技术有限公司提供),根据mirbase数据库,分别检测miRNA-155-5p以及miRNA-21-5p,采用PCR仪(美国ABI 7500型)进行定量检测,扩增条件为:95℃10 min,(95℃10 s,58℃30 s,72℃10 s)40个循环。反应后分析熔解曲线,采用2-△△Ct法计算miRNAs的相对表达量。
1.6 统计学处理采用SPSS26.0统计软件进行结果分析。计量资料符合正态分布且方差齐,采用(±s)表示;多组间比较采用单因素方差分析,进一步两两比较采用t检验。相关性分析采用Pearson相关分析法,以P<0.05为差异具有统计学意义。
2 结果
2.1 Th1相关细胞因子在急、慢性布病患者以及健康对照者中的表达与对照组相比,急、慢性期布病组IFN-γ、TNF-α、IL-18水平均升高(P均<0.05);与急性组相比,慢性组IFN-γ、TNF-α、IL-18水平均下降(P均<0.05)(表1)。
表1 3组人群血清Th1类细胞因子含量比较(±s,pg/mL)

表1 3组人群血清Th1类细胞因子含量比较(±s,pg/mL)
组别急性组慢性组对照组F值P值例数42 31 30 Th1类细胞因子IFN-γ 71.98±29.57 28.70±17.23 6.39±2.45 89.91 0.00 TNF-α 45.01±29.68 20.47±14.94 5.25±1.86 33.85 0.00 IL-18 366.62±218.54 153.88±53.44 57.31±36.54 43.86 0.00
2.2 Th2相关细胞因子在急、慢性布病患者以及健康对照者中的表达与对照组相比,急、慢性期布病组IL-10、IL-33水平均升高(P均<0.001),与急性组相比,慢性组IL-10、IL-33水平升高(P均<0.05)(表2)。
表2 3组人群血清Th2类细胞因子含量比较(±s,pg/mL)

表2 3组人群血清Th2类细胞因子含量比较(±s,pg/mL)
组别急性组慢性组对照组F值P值例数42 31 30 Th2类细胞因子IL-10 41.37±9.85 45.31±5.08 5.43±1.45 315.58 0.00 IL-33 93.91±48.04 124.24±86.55 11.80±5.94 32.50 0.00
2.3 Th17相关细胞因子在急、慢性布病患者以及健康对照者中的表达与对照组相比,急、慢性组IL-17表达均升高(P均<0.05),与急性组相比,慢性组IL-17表达下降(P<0.05)(表3)。
表3 3组人群血清Th17类细胞因子含量比较(±s,pg/mL)

表3 3组人群血清Th17类细胞因子含量比较(±s,pg/mL)
组别急性组慢性组对照组F值P值例数42 31 30 Th17类细胞因子IL-17 19.06±11.81 14.02±2.27 5.90±2.84 24.83 0.00
2.4 miRNA在急、慢性布病患者以及健康对照者中的表达与对照组相比,急、慢性组miRNA-155表达均增高(P均<0.01);与慢性组比较,急性组miRNA-155的表达增高显著(P<0.01)。与对照组相比,急、慢性组miRNA-21表达均增高(P均<0.01);与慢性组比较,急性组miRNA-21表达变化差异无统计学意义(P>0.05)(表4)。
表4 miRNA-155和miRNA-21在3组人群中的相对表达水平(±s,pg/mL)
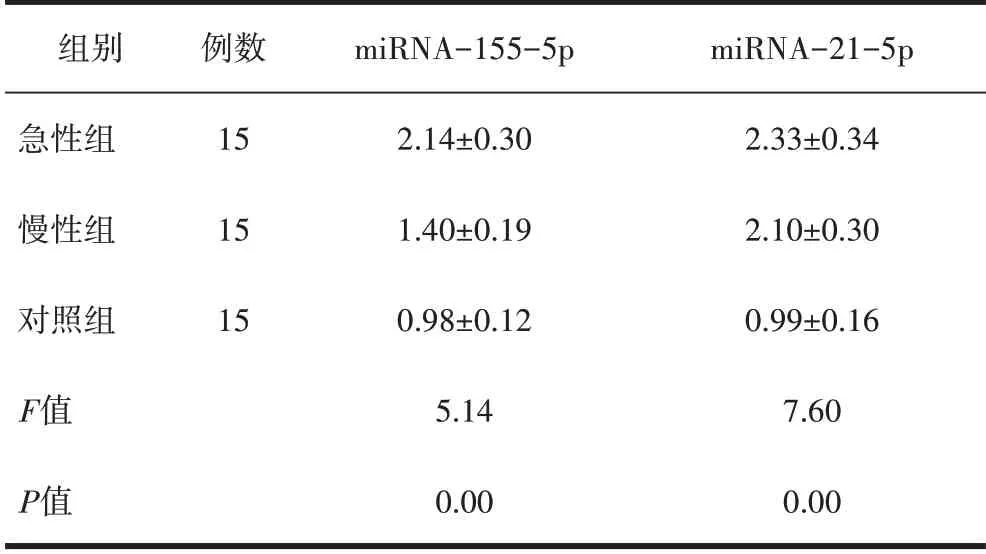
表4 miRNA-155和miRNA-21在3组人群中的相对表达水平(±s,pg/mL)
组别急性组慢性组对照组F值P值例数15 15 15 miRNA-155-5p 2.14±0.30 1.40±0.19 0.98±0.12 5.14 0.00 miRNA-21-5p 2.33±0.34 2.10±0.30 0.99±0.16 7.60 0.00
2.5 各检测指标间的相关性分析IL-18表达水平与IFN-γ、TNF-α的表达水平均呈正相关(r=0.664、0.659,P均<0.01)。IL-33表达水平与IL-10的表达水平呈正相关(r=0.554,P<0.01)。miRNA-155表达水平与IFN-γ、IL-18、TNF-α、IL-17的表达以及ESR、CRP均呈正相关(r=0.747、0.689、0.678、0.673、0.501、0.591,P均<0.01)。miRNA-21表达水平与IL-10、IL-33的表达及ESR、CRP均呈正相关(r=0.847、0.643、0.475、0.558,P均<0.01)。
3 讨论
布鲁菌作为胞内菌,通过胞内寄生和复制的方式调节和逃逸机体免疫,妨碍机体对其清除,这往往是布菌导致多脏器系统受损、布病迁延难愈的原因之一。机体免疫对其清除主要依赖于细胞免疫,T细胞亚群及相关细胞因子在其中发挥了重要的作用。本研究结果显示,急、慢性布病患者的Th1、Th2和Th17类细胞因子表达均升高,在急性期以Th1和Th17类细胞因子表达为主,慢性期以Th2类细胞因子表达为主。在细胞因子的检测中,除了经典Th1细胞因子IFN-γ和TNF-α,本次研究还发现IL-18主要表达在布病急性期,与IFN-γ和TNF-α关联性较强,显现出表达趋势一致的现象。而IL-33在慢性期显著增高,与Th2类细胞因子IL-10表达趋势一致。已有研究证实IL-18和IL-33分别作为Th1和Th2类细胞因子,在多种疾病中参与了机体免疫Th1/Th2类反应[14-15],本次结果也证实,在布病中IL-18和IL-33分别参与了Th1和Th2类反应,可协同经典细胞因子,作为研究机体Th1/Th2类免疫反应的靶标。
此外,综合细胞因子以及miRNAs的检测结果提示,在布病急性期,以miRNA-155和Th1、Th17类细胞因子表达为主。其中,miRNA-155与Th1类细胞因子IFN-γ关联性最强,基于研究已证实miRNA-155能够通过上调IFN-γ的分泌,进而促进Th1类细胞表达[16],由此可以推测,miRNA-155不仅参与到布菌感染后的机体免疫的反应中,并可能通过上调Th1细胞或细胞因子IFN-γ的表达,增强Th1和Th17类免疫效应。与miRNA-155在布病急性期的显著增高不同,miRNA-21的表达呈现出在急、慢性期均增高的特点,在其他疾病的研究中证实,miRNA-21可能与疾病的慢性化有关[17],但在本研究中未发现miRNA-21在布病急、慢性期的表达差异。
CRP和ESR作为常规检测指标已应用于布病的临床诊断中,它们均在布病急性期升高明显,其检测值反映出布病感染后的炎症变化,具有良好的敏感度和特异性[18-19]。在本次相关性分析中提示,miRNA-155和miRNA-21均与ESR和CRP存在正相关关系,这不仅提示miRNAs的表达与布菌感染后机体的炎症变化关系密切,并且综合上述分析或可推测,在布病中,miRNAs可通过调控细胞因子进而影响T细胞分化极性,最终影响布病的发生和发展。
综上所述,miRNA-155和miRNA-21以及Th1、Th2和Th17类细胞因子在布病患者中存在异常表达,其表达水平与布病的急、慢性分期紧密相关,调控因子miRNA-155与Th1类细胞因子(IFN-γ、TNF-α、IL-18)和Th17类细胞因子(IL-17)之间存在一定的协同关系,进一步提示在布病中可能存在miRNAs调节细胞因子影响Th细胞分化进而影响布病的发生与分期。但由于本次研究的样本量相对较少,在下一步的深入研究中将通过对miRNAs与Th细胞分化信号通路的研究,进一步发现在急、慢性患者中上述不同调节位点的作用与机制,以期为布病的分期和治疗提供新的靶点。

