不同浓度丁酸钠抑制氧化型低密度脂蛋白诱导THP-1细胞炎症反应的研究
丁龙坤,席 月,闫 曼,杨大凯,周 林,吴 亮
(1江苏大学医学院,江苏镇江 212013;2江苏省苏北人民医院,江苏 扬州 225001)
动脉粥样硬化(atherosclerosis,AS)是多种心血管疾病的主要病理基础,巨噬细胞源性泡沫细胞在动脉内膜中的持续累积是动脉粥样硬化斑块形成的关键[1-2]。19世纪时Ross等学者提出了动脉粥样硬化形成的“炎症假说”,其核心是过量的氧化型低密度脂蛋白(oxidized low density lipoprotein,Ox-LDL)诱发巨噬细胞转变为泡沫细胞,并最终导致动脉粥样硬化斑块形成[3],同时多个炎症相关的信号通路也处于活化状态[4]。但目前仍缺乏通过降低炎症反应干预动脉粥样硬化斑块发生和发展的有效方法。
研究发现肠道微生物的某些代谢产物具有免疫调控功能[5-6]。短链脂肪酸(short-chain fatty acids,SCFAs)是一类由肠道中某些厌氧菌发酵人体无法消化膳食纤维等所产生的具有显著抑炎功能的活性分子[7-8],主要包括乙酸、丙酸和丁酸,其中丁酸盐的抗炎功能最为突出[9],Singh等[10]发现丁酸盐可以影响诱导调节性T细胞增殖和IL-10表达。Chang等[11]研究表明丁酸盐可以作为组蛋白脱乙酰基酶抑制剂,抑制人源单核细胞白血病(THP-1)细胞炎症反应。但丁酸盐是否可以抑制动脉粥样硬化形成过程的炎症反应目前仍缺乏研究。本研究以Ox-LDL刺激THP-1细胞炎症反应,探讨丁酸盐抑制高脂状态下巨噬细胞炎症反应能力,为临床预防和治疗动脉粥样硬化提供一条新思路。
1 材料与方法
1.1 细胞株人源单核细胞白血病细胞(THP-1细胞)购自上海细胞库,由本研究室自行培养于含10%胎牛血清的RPMI 1640培养基中,选取第4~10代细胞用于本研究。
1.2 主要试剂和仪器氧化型低密度脂蛋白(oxidized low density lipoprotein,Ox-LDL)购自广州奕源生物科技有限公司;分析纯丁酸钠(sodium butyrate,NaB)购自合肥博美生物科技有限责任公司;RPMI 1640细胞培养液和胎牛血清购自以色列BI公司;总RNA提取试剂盒、反转录试剂盒和实时定量PCR试剂盒(SYBR Green染料法)均购自南京诺唯赞公司;PCR扩增引物由苏州金唯智生物科技公司合成;RIPA裂解液、蛋白酶抑制剂(PMSF)、细胞核蛋白和细胞浆蛋白抽提试剂盒购自南通碧云天公司;NLRP3、Caspase-1、LC3-Ⅱ、Beclin-1、NF-κB p65、β-肌动蛋白和组蛋白H1抗体购自武汉博士德生物科技有限公司。实时定量PCR仪和凝胶成像分析系统均为美国Bio-Rad公司。
1.3 方法
1.3.1 细胞培养及实验分组复苏后的THP-1细胞培养于含10%胎牛血清的RPMI 1640培养基中,置于37℃5%CO2环境中培养,待细胞融合度达到80%时吹打收集细胞并调整密度,按5×105/孔密度接种于6孔细胞培养板中。鉴于较高浓度(>1 mmol/L)的NaB可能对细胞活力产生影响[12],故本实验中NaB浓度低于1 mmol/L。实验分组设置如下:正常对照组、Ox-LDL组和不同浓度NaB组。Ox-LDL终浓度为50 mg/L,NaB终 浓度 分 别为50、100、200、400和800 μmol/L。正常对照组细胞不做任何处理,Ox-LDL组细胞以终浓度为50 mg/L的Ox-LDL处理24 h,NaB组预先使用不同浓度NaB孵育THP-1细胞24 h,再添加Ox-LDL处理24 h。各组细胞于实验结束时中止培养,收集细胞用于后续研究。
1.3.2 实时荧光定量PCR检测严格按照试剂盒说明书法提取THP-1细胞总RNA并反转录为cDNA,用于后续实时荧光定量PCR法检测。反应总体系为20 μL,以95℃预变性1 min,95℃变性5 s,58℃退火20 s,72℃延伸30 s,反应共计40个循环。以β-肌动蛋白基因作为内参,通过公式2-△△Ct计算mRNA的相对表达量,所用引物序列见表1。

表1 引物序列
1.3.3 ELISA法测定细胞因子水平收集各组细胞培养上清液1 mL,以4℃、12 000 r/min离心5 min后收集上清液用于ELISA检测。检测时严格按ELISA试剂盒说明书操作,检测培养液上清中IL-1β、TNF-α、TGF-β和IL-10表达量。反应完毕后通过酶标仪检测450 nm处吸光度值,绘制各种细胞因子标准曲线并用于计算各组上清液中细胞因子含量。
1.3.4 免疫印迹法检测提取细胞总蛋白,具体操作如下。收集的细胞以冰上预冷的磷酸盐缓冲液洗涤两次,加入100 μL RIPA裂解液于冰上裂解30 min,裂解完成后以12 000 r/min离心10 min收集上清液并检测蛋白浓度后用于免疫印迹分析。细胞核蛋白和胞浆蛋白分离严格按说明书进行操作。在细胞总蛋白中按1∶4比例加入5×SDS-PAGE上样缓冲液并煮沸8 min使蛋白完全变性。以恒压80 V电泳120 min,电泳完毕后以恒流300 mA转印90 min,使蛋白转印至PVDF膜。以5%脱脂奶粉室温封闭1 h,各种一抗按1∶1 000比例稀释,于4℃下过夜孵育,次日以TBST缓冲液洗涤3次,每次15 min。加入1∶5 000稀释的羊抗兔IgG-HRP于室温下孵育1 h,以TBST缓冲液洗涤3次后滴加ECL曝光液进行显色,Image J软件分析条带灰度值。
1.4 统计学分析采用SPSS 22.0统计学软件分析,计量数据以均数±标准差(±s)表示。使用单因素方差分析(one-way ANOVA)进行检验,组间差异使用LSD法进行分析,以P<0.05为差异有统计学意义。
2 结果
2.1 不同浓度NaB作用下Ox-LDL诱导THP-1细胞IL-1β和TNF-α表达经Ox-LDL处理后,THP-1细胞IL-1β和TNF-α的mRNA和蛋白表达量较正常对照组均显著升高(P<0.01)。分别经终浓度为50、100、200和400 μmol/L的NaB预处理后,与Ox-LDL组相比,THP-1细胞TNF-α的mRNA和蛋白表达量显著降低(P<0.01);分别经终浓度为50 μmol/L和100 μmol/L的NaB预 处 理 后,与Ox-LDL组 相 比,THP-1细胞IL-1β的mRNA和蛋白表达量显著降低(P<0.01)(图1)。
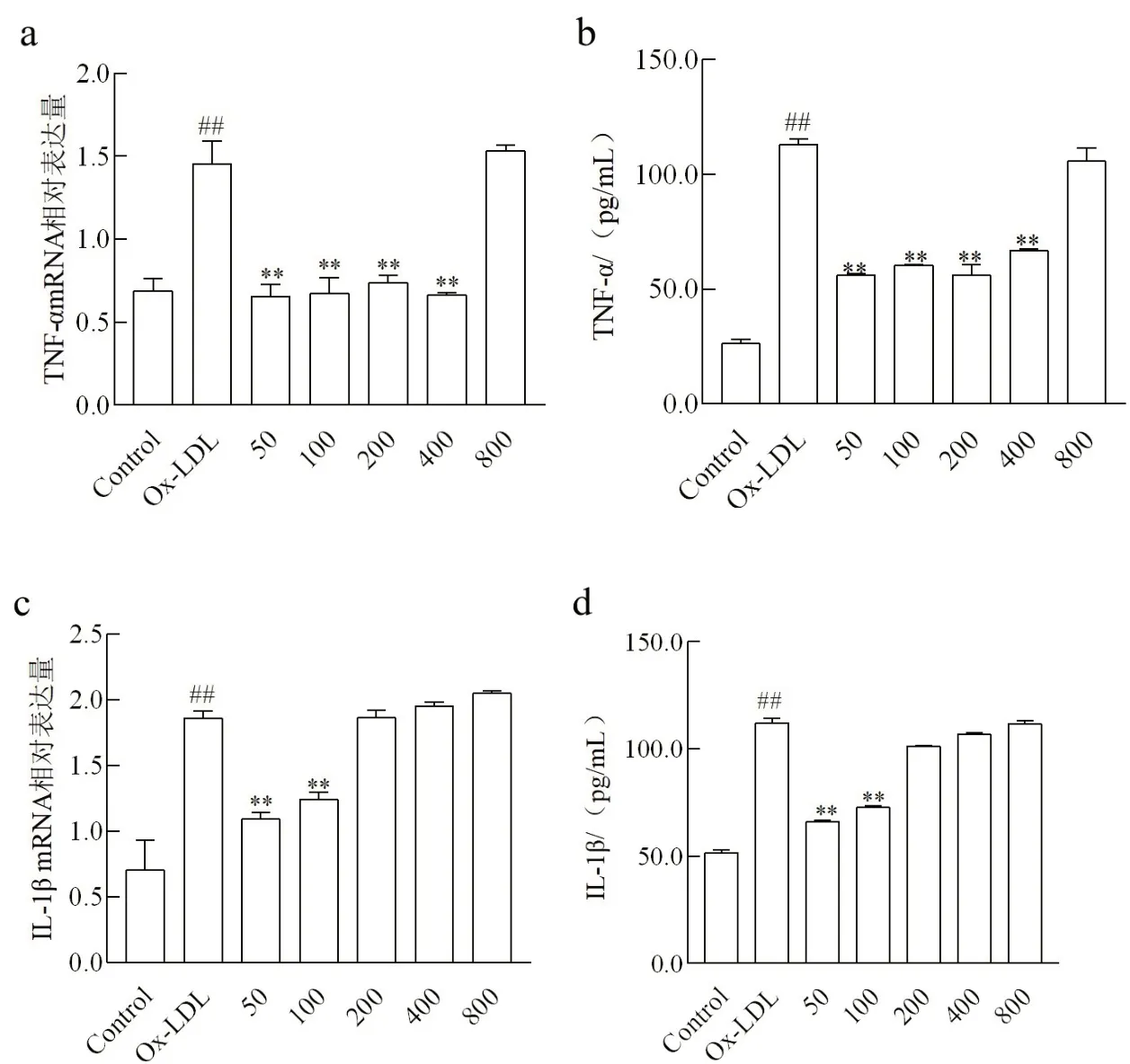
图1 实时定量PCR法和ELISA法检测THP-1细胞IL-1β和TNF-α表达
2.2 不同浓度NaB作用下Ox-LDL诱导THP-1细胞IL-10和TGF-β表达Ox-LDL处理后,THP-1细胞IL-10的mRNA和蛋白表达量较正常对照组显著降低(P<0.05);细胞预先分别以终浓度为200、400和800 μmol/L的NaB处理后,细胞IL-10的mRNA和蛋白表达量较Ox-LDL组显著升高(P<0.01)。Ox-LDL处理后,Ox-LDL组细胞TGF-β的mRNA和蛋白表达量较正常对照组显著下降(P<0.01);而预先分别以终浓度200、400和800 μmol/L的NaB处理后,细胞TGF-β的mRNA和蛋白表达量较Ox-LDL组显著上升(P<0.01)(图2)。
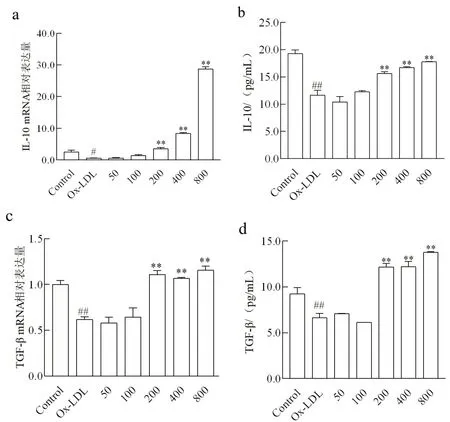
图2 实时定量PCR法和ELISA法检测THP-1细胞IL-10和TGF-β表达
2.3不同浓度NaB作用下Ox-LDL诱导THP-1细胞NLRP3炎症复合体表达Ox-LDL处理后,THP-1细胞NLRP3和Caspase-1表达量较正常对照组显著升高(P<0.01)。经终浓度为400 μmol/L和800 μmol/L的NaB预处理后,细胞NLRP3的mRNA和蛋白表达量均较Ox-LDL组显著降低(P<0.01)。与Ox-LDL组比较,5种浓度的NaB均可以显著抑制THP-1细胞Caspase-1的mRNA和蛋白表达(P<0.01)(图3)。
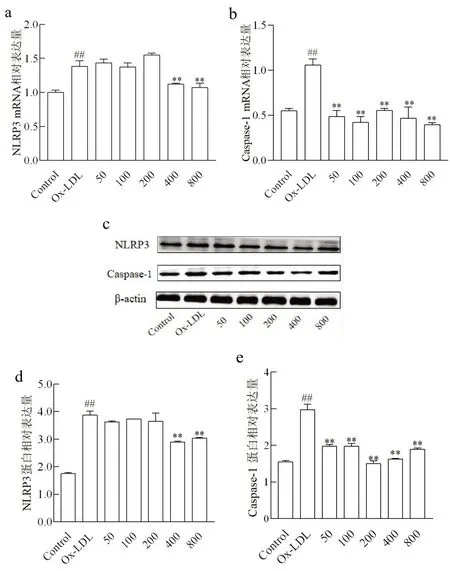
图3 实时定量PCR法和免疫印迹法检测THP-1细胞NLRP3炎症复合体的表达量
2.4 不同浓度NaB作用下Ox-LDL诱导THP-1细胞NF-κB信号通路活化能力使用免疫印迹技术检测不同浓度NaB预处理后THP-1细胞胞浆与细胞核中NF-κB p65蛋白表达。结果显示,Ox-LDL组细胞核内NF-κB p65蛋白表达量较对照组显著上升(P<0.01),胞浆中NF-κB p65蛋白表达量较对照组显著下降(P<0.01);与Ox-LDL组相比,50、100、200、400、800 μmol/L组细胞的细胞核中NF-κB p65蛋白表达量显著下降,且胞浆中NF-κB p65蛋白表达量显著上升(P<0.01)(图4)。
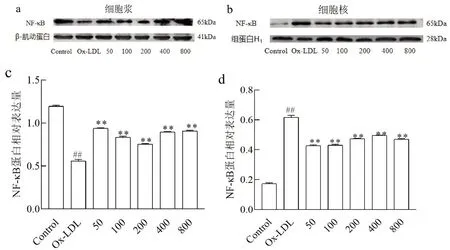
图4 免疫印迹法检测THP-1细胞的细胞核和胞浆中NF-κB p65表达量
2.5 不同浓度NaB作用下Ox-LDL诱导THP-1细胞自噬能力通过免疫印迹技术检测THP-1细胞自噬相关蛋白LC3-Ⅱ和Beclin-1蛋白表达量以评估自噬水平。Ox-LDL组细胞LC3-Ⅱ和Beclin-1表达量较正常对照组显著上升(P<0.01)。THP-1细胞经终浓度为200、400和800 μmol/L的NaB预处理后,Beclin-1表达量较Ox-LDL组显著增加(P<0.01);而5种浓度NaB预处理后,THP-1细胞LC3-Ⅱ表达量较Ox-LDL组均显著增加(P<0.01)(图5)。
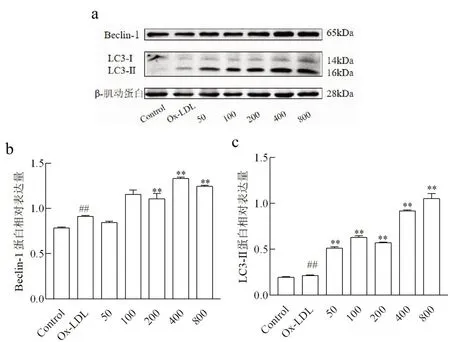
图5 免疫印迹法检测THP-1细胞Beclin-1和LC3-Ⅱ表达量
3 讨论
研究表明,高脂血症患者血液中存在着高浓度Ox-LDL,同时伴有内皮细胞黏附分子,如单核细胞趋化蛋白(Monocyte Chemoattractant Protein-1,MCP-1)等大量表达[12],当Ox-LDL侵入血管内壁后,即被单核-巨噬细胞经清道夫受体摄取后逐渐形成泡沫细胞,进而导致血管内壁炎症反应的发生,这是动脉粥样斑块形成的关键[13-14]。NF-κB信号通路是调控炎症反应的重要通路之一,当细胞处于正常状态时,由p65和p60组成的二聚体复合物NF-κB主要位于胞浆。当细胞受到外界刺激后,NF-κB二聚体由胞浆移位至胞核,调控细胞因子的转录表达。因此测定细胞浆与细胞核内NF-κB p65蛋白含量变化可以反映细胞炎症状态[15]。刘孟楠等[16]研究颈动脉粥样硬化的家兔模型发现,家兔体内存在着NLRP3炎症小体、Caspase-1和IL-1β的高表达,并且家兔体内炎症复合体的活化与NF-κB信号通路磷酸化有关。本研究中,THP-1细胞经Ox-LDL刺激后出现NF-κB p65入核,并伴随NLRP3复合体活化和多种促炎细胞因子表达上调,表明Ox-LDL可以通过NF-κB信号通路激活NLRP3炎症复合体,进一步诱发巨噬细胞炎症反应。
SCFAs是膳食纤维被肠道内某些厌氧菌发酵后的产物,主要包括乙酸盐、丙酸盐和丁酸盐,不仅可以作为结肠细胞能量来源,还具有抑制免疫细胞活化的功能,其中以丁酸盐的抗炎效果最为显著[17-19]。梁晶冰等[20]发现丁酸钠可以通过抑制NLRP3炎性复合体活化保护严重烫伤小鼠的肠道屏障功能。本研究中,低浓度(50和100 μmol/L)丁酸钠可以下调THP-1细胞促炎细胞因子IL-1β和TNF-α表达量,而进一步提高丁酸钠浓度其抑制效果并未显著增强,但高浓度丁酸钠(200、400和800 μmol/L)的预孵育可以显著提高THP-1细胞抑炎细胞因子IL-10和TGF-β表达量。可能是由于高浓度的丁酸钠诱发细胞凋亡,激活细胞凋亡密切相关的JNK细胞信号通路,同时细胞以提高抗炎细胞因子表达水平的方式保护细胞[21]。上述研究结果表明丁酸钠可以诱导M1型巨噬细胞极化为M2型,其抗炎机制可能依赖于抑制NF-κB信号通路和NLRP3炎症复合体的活化。
细胞自噬是真核细胞对细胞内物质进行周转的重要过程。该过程中,一些损坏的蛋白或细胞器被双层膜结构的自噬小泡包裹后,送入溶酶体(动物细胞)或液泡(酵母和植物)中进行降解并得以循环利用,对于维持细胞稳态有重要意义[22]。Beclin1是细胞发生自噬过程中的关键蛋白,是自噬体形成的标记物之一,LC3也是一种自噬标记蛋白,以可溶性LC3-Ⅰ和脂溶性LC3-Ⅱ两种形式存在,LC3-Ⅰ与自噬小泡膜表面的磷脂酰乙醇胺结合后转变为LC3-Ⅱ,与自噬体双层膜的延伸密切相关,因此Beclin1和LC3-Ⅱ的表达量与细胞自噬程度呈正相关。近年来研究还发现,适度自噬可以减少炎症细胞数量和促炎因子表达量,并可以直接抑制NLRP3炎症复合体活化[23]。本研究发现,丁酸钠可以显著上调THP-1细胞LC3-Ⅱ和Beclin1表达量,即上调巨噬细胞自噬水平。该结果表明,丁酸钠可以通过诱导巨噬细胞自噬,以抑制巨噬细胞NLRP3炎症复合体活化和各种促炎细胞因子表达,减少动脉粥样硬化形成过程中伴随的炎症反应的发生。
综上所述,丁酸盐可以有效地抑制在细胞模型中由Ox-LDL诱发的巨噬细胞炎症反应,为临床上减轻巨噬细胞源性泡沫细胞在动脉管壁形成持续性炎症提供了一定的理论依据。但通过肠道菌群产生丁酸盐改善动脉粥样硬化仍需更多的临床试验以确定实际效果。

