杜仲叶抗氧化研究进展
李博闻, 张立攀
(河南省商业科学研究所有限责任公司,郑州 450000)
机体的新陈代谢会不断产生自由基,正常情况下自由基的产生与消除处于动态平衡,但一旦平衡被打破,自由基就会大量积累并攻击细胞,干扰人体正常的生理生化反应,诱发各种疾病,研究表明氧化反应几乎和所有疾病都有着紧密的联系[1-2]. 为了减缓氧化反应,抗氧化剂或抗氧化食品得到了广泛的推广应用,抗氧化剂具有消除活性氧(reactive oxygen species,ROS),抑制自由基反应,修复细胞损伤等作用. 传统的抗氧化剂包括合成和天然两类,但是合成抗氧化剂具有潜在的毒副作用,所以天然抗氧化剂因其安全性高、抗氧化能力强等优点备受消费者青睐. 天然抗氧化剂来源广泛如自然界的动植物及微生物,大量研究证明中药材也是抗氧化天然产物的重要载体,如灵芝多糖、枸杞多糖、金银花多酚、杜仲叶黄酮等[3-5],且其药效与抗氧化功能联系密切[6-7]. 大多数中药材兼具药食两用及传统食用习俗优势,有着广泛的开发前景.
杜仲在我国种植面积广泛,资源丰富,既是我国特有的名贵中药材又是“药食两用”物质,中医常以皮入药,具有降糖、降压、预防骨质疏松、抗氧化、抗衰老、抗癌等诸多功效[8]. 但杜仲皮资源短缺,价格昂贵,极大限制了杜仲资料的开发利用,研究表明杜仲叶与皮具有相似的功效成分包括黄酮类、绿原酸、环烯醚萜类、多糖、多酚、木脂素等. 杜仲叶资源丰富,方便采集. 近年来,关于杜仲叶的研究主要集中在药用领域,且以抗氧化活性的研究居多,因此针对杜仲叶抗氧化活性成分、影响因素、抗氧化机理、评价方法等进行系统性整理,以便为杜仲功能性产品的开发提供理论依据.
1 杜仲叶抗氧化活性成分
1.1 绿原酸
绿原酸(chlorogenic acid,CA)是植物体内重要的次级代谢产物,具有抗病毒、抗菌、保肝利胆、降压、降脂、消除自由基等功能[9].《中国药典》将绿原酸作为杜仲叶质量控制的唯一指标. 杜仲叶中绿原酸含量高于杜仲皮,可达1%~5%[9]. 李文娜等[10]发现杜仲叶绿原酸提取物对DPPH·、O2-、·OH、烷基自由基清除能力均高于绿原酸、VC,IC50达14 μg/mL. 曾桥等[11]利用响应面法优化杜仲叶茯砖茶绿原酸提取工艺并发现在0.28 mg/mL时其还原能力远高于VC.
1.2 总黄酮
黄酮是以2-苯基色原酮为母体的一类植物代谢产物,广泛分布于自然界中,具有抑菌、抗氧化、消炎、防癌等功能[12],目前杜仲叶中共分离出十几种黄酮类化合物,如芦丁、金丝桃苷、山柰酚、山柰酚-3-O-葡萄糖苷、槲皮素、异槲皮苷等. 杜仲不同部位黄酮含量差异性较大,以杜仲叶含量最高达9.02%[12],且老叶含量高于嫩叶. 钟淑娟等[13]发现杜仲叶黄酮对ATBS+、DPPH·及Cu2+清除能力均高于雄花、皮、籽.
1.3 总多酚
杜仲叶富含多酚类化合物,研究表明杜仲叶抗氧化活性物质以总黄酮和总多酚为基础[14]. 刘迪等[7]利用大孔吸附树脂纯化杜仲叶多酚,并证明其具有良好的体外抗氧化能力. 李陆军等[15]采用表面活性剂法提取杜仲叶多酚,得率达6.77%,并且对·OH、ABTS+、DPPH·自由基具有明显的清除能力.
1.4 多糖
多糖是细胞壁的重要组成部分,资源丰富,杜仲叶中粗多糖含量为0.98 g/100 g,具有抗病毒、抗衰老、降血糖、免疫调节、抗氧化等功效. 雷燕妮等[16]分离制备杜仲叶多糖并发现其对DPPH·、O2-、·OH等均具有较强的清除能力. 曾桥等[17]研究发现当杜仲叶多糖在100 μg/mL时对ABTS+清除率达98.74%,当60 μg/mL时,对DPPH·自由基清除率达69.28%.
1.5 环烯醚萜类化合物
杜仲鲜叶中环烯醚萜类化合物含量高于老叶,约5.07 mg/g[18]. 杜仲叶中共分离出20多种环烯醚萜类化合物包括车叶草甘、京尼平苷酸、桃叶珊瑚苷、杜仲苷、杜仲醇、哈帕甙乙酸酯等[19]. 药理学研究表明环烯醚萜类化合物具有诸多功能活性,如京尼平苷酸具有保肝利胆、增强免疫力等功效,桃叶珊瑚苷具有抑菌、利尿、抗病毒等功能[20]. 彭胜[21]通过对杜仲叶抗氧化活性成分分析检测,发现绿原酸、桃叶珊瑚甙、京尼平甙酸、总黄酮等均具有良好的自由基清除能力.
2 影响抗氧化活性的因素
2.1 种植因素
1)产地. 杜仲在我国种植面积广泛,主要分布在河南、湖北、陕西、江西、安徽等地[22],不同产地的气候、温湿度、海拔、土壤条件等差异性较大,杜仲叶活性成分的形成和积累与其生长的自然环境密切相关[23]. 吴可心等[24]对陕西、四川等8个地区杜仲叶活性成分检测,发现四川地区的杜仲叶综合价值最高.
2)采摘季节. 为了保证杜仲叶的质量和产量,及时采摘能够减少有效成分损失,保持最佳外形质地,兰济艳等[25]对杜仲叶活性成分进行动态监测,发现最佳采收期宜控制在7—8月份.
3)品种. 品种是影响杜仲活性成分的重要因素,同一杜仲,即使同属,品种不同,质量也不尽相同,据统计杜仲良种共39种,每个品种都有其选育目的,如药用、胶用、茶用等. 此外,矮树种杜仲叶抗氧化活性普遍比高树种强[26].
4)植株部位与树龄. 杜仲叶、籽、皮、花等化学成分相似但含量相差较大[26],如杜仲叶中黄酮含量高于其他部位,抗氧化能力更强[14]. 中药材药效常与生长时间关系密切,如中医常以20年以上杜仲皮入药,而关于杜仲叶随树龄增加的成分变化研究目前较少,张威鹏等[27]发现随树龄的增加杜仲叶中黄酮类物质、苯丙素类物质逐年减少,木质素类含量呈递增趋势,25年生杜仲叶中木质素含量最高.
5)施肥条件. 生态因子是影响杜仲叶的功能成分的直接或间接的因子,其中微量元素能够干扰根系营养、代谢、药效成分的构成及化学成分积累. 彭密军等[28]对杜仲叶面喷施铁、锌、锰复合肥,可以提高总黄酮、总多酚、绿原酸等成分含量.
综上所述,杜仲树种培育应针对不同产地、采摘季节、品种、植株部位与树龄、施肥条件等因素实施调控,以达到优化活性成分的目的,全面提升杜仲叶产量,满足其高质量发展需求.
2.2 加工方法
杜仲叶产地采摘后需要干燥并储藏,杜仲叶颜色和活性物质是评价品质优劣的重要参考指标,如不及时加工会造成严重破坏和损失.《中国药典》传统采用低温烘干和常温晒干两种方法处理,近年来随着科技进步又出现了一些新型干制方式,如微波干燥、真空冻干等. 研究表明不同的烘干技术对有效成分的影响较大,而抗氧化特性是与这类物质密切相关,如微波真空干燥、真空冷冻干燥处理12 h 后的杜仲叶京尼平苷酸、桃叶珊瑚苷、绿原酸含量均高于自然晾干和烘干[29]. 自然晾干容易使暴露在空气中的抗氧化物质氧化降解,热风烘干虽能提高干燥效率,但同时高温会引起共价键破坏,导致多酚、黄酮等物质损失;微波加热具有高效、节能、方便快捷等优点,但对于热敏性成分破坏性较大. 因此在杜仲叶食品开发加工过程中应注意选择合适的干燥方法以避免活性成分的丢失.
杜仲叶杀青处理是为了灭酶,减少活性成分的分解和损失,如微波、蒸汽、炒制等. 屠万倩等[30]采用蒸制、发酵处理杜仲叶后发现桃叶珊瑚苷、京尼平苷酸和车叶草苷等明显提高,蒸制微波风干法相比烘干法、发酵法对绿原酸破坏较少. 刘雯等[31]采用不同杀青工艺对杜仲叶茶处理,发现微波杀青方式活性成分损失率最小. 因此,在进行杜仲叶产品开发时应考虑加工方法对活性成分含量的影响,在保证色香味的基础上最大限度地保留功能物质,开发新型杜仲叶食品.
3 杜仲叶活性成分提取方法
杜仲叶活性成分的提取方法主要包括超声提取、微波法、酶解法、水提法、超临界CO2法等. 不同提取方法对各种活性成分的提取率影响较大,详见表1.
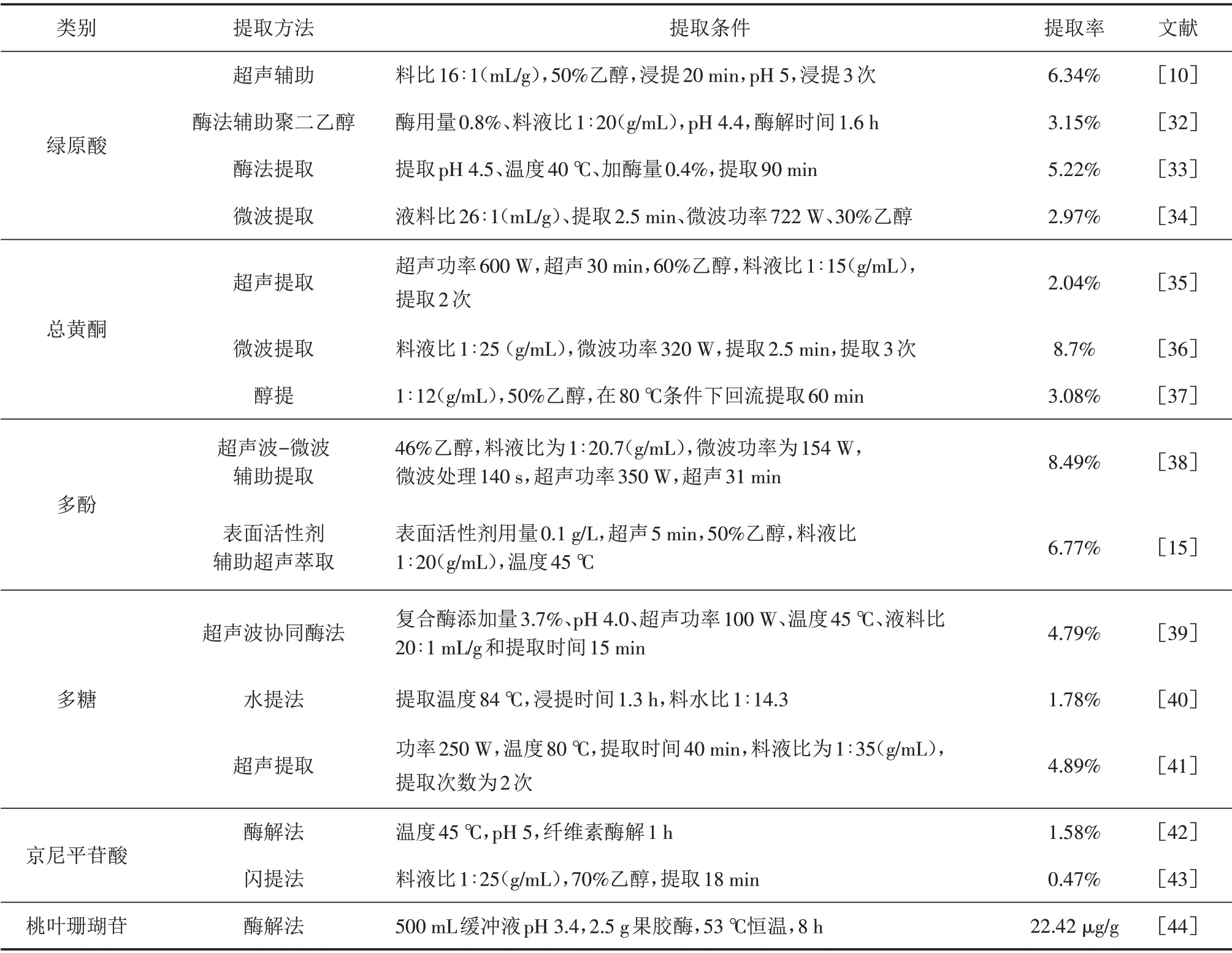
表1 不同加工方法对杜仲叶活性成分提取率的影响Tab.1 Effects of different processing methods on the extraction rate of active components from Eucommia ulmoides leaves
基于分析结果可知相比其他提取方法,超声辅助提取对杜仲叶绿原酸提取率最高[32-34],酶法提取次之. 超声提取是中药提取常用方法,具有高效、省时、节能等优点,酶法提取具有反应条件温和、易控制、环保等优点.
不同提取方法对杜仲叶总黄酮的提取效率存在显著性差异[35-37],以微波提取率最高,为8.7%. 微波提取利用微波高强度穿透细胞壁的原理,促使细胞破裂,使大量活性成分溶出,具有加热迅速、高效节能、环保等优点.
关于杜仲叶多酚的提取研究较少,王翔等[38]采用超声-微波辅助提取杜仲叶多酚,提取率达8.5%,比传统提取方法提高了33.57%. 超声微波联用可以同时具有空化效果和微波高能功能,弥补两者不足,避免高温分解和破坏活性成分结构.
不同提取方法对杜仲叶多糖的影响较大[39-41],超声辅助提取效果较好,相比传统水提法提取率提升了64.5%,明显优于传统提取工艺.
不同的提取方法对京尼平苷酸和桃叶珊瑚苷提取率的影响差异性较大[42-44],陈玉甫等[44]分别利用水提法、醇提法、酶解法提取杜仲叶桃叶珊瑚苷和京尼平苷酸,结果发现桃叶珊瑚苷:水提法8.27 μg/g、酶解法22.42 μg/g、醇提法9.13 μg/g;京尼平苷酸:水提法36.63 μg/g、酶解法110.05 μg/g、醇提法47.4 μg/g,表明酶解法提取效果最佳.
综上所述,超声提取法有利于绿原酸、多酚、多糖的提取,微波法有利于总黄酮的提取,酶解法有利于京尼平苷酸和桃叶珊瑚苷的提取. 因此选择合适的提取条件、提取方法对提升目标提取物的含量影响较大,加强提取工艺的优化,避免活性成分的损失,为杜仲叶提取物功能食品的开发提供科学的理论指导.
4 杜仲叶抗氧化作用机制与评价方法
4.1 抗氧化作用机制
由活性氧引发的自由基会使人体内的脂质与蛋白质发生链式氧化反应,这些自由基进攻生物分子的不饱和位点,对有机分子产生一些不应有的修饰和损伤,这些大分子有蛋白质、碳水化合物、脂类物质和核酸等. 根据杜仲叶抗氧化机理研究进展归纳总结如下:
1)清除自由基. 研究表明杜仲叶提取物能够有效清除自由基,如杜仲叶多糖在100 μg/mL时对ABTS+清除率达98.74%;
2)提升抗氧化酶活性,减少氧化应激反应. 抗氧化酶构成机体抗氧化防御体系包括超氧化物歧化酶(Total Superoxide Dismutase,T-SOD)、谷胱甘肽过氧化物酶(Glutathione peroxidase,GSH-Px)、过氧化氢酶(Catalase,CAT)等,T-SOD能够高效清除,抑制脂质的过氧化反应,GSH-Px能够明显清除H2O2、脂质过氧化物,CAT 能够加速机体内H2O2分解. 研究发现杜仲叶提取物能够降低丙二醛(Malondialdehyde,MDA)含量,显著提升小鼠肝脏抗氧化酶活性[45].
3)阻断脂质过氧化链反应. 活性氧能够影响细胞膜功能,使细胞膜不饱和脂肪酸氧化形成脂质过氧化物,进而影响机体正常的生理反应,引起疲劳、肌肉酸软等症状. 研究证明杜仲叶黄酮能够有效抑制小鼠肝、心、肾等组织脂质过氧化,减少MDA生成,维持细胞膜完整性[46].
4)减少DNA损伤. 正常情况下的DNA具有自我修复能力,以维持遗传物质的稳定性,但过多的自由基诱导氧化应激,导致细胞蛋白、核酸、脂质等遭受破坏. 研究发现杜仲叶50%醇提物可显著提升脑组织抗氧化能力,减少脑神经DNA损伤,并提高GSH-Px和T-SOD活力[47].
4.2 抗氧化评价方法
随着天然抗氧化剂研究热度的持续升温,评价方法也发生着日新月异的改进,目前关于杜仲叶抗氧化能力研究的评价方法主要分为化学测定法和细胞分析法,化学法主要包括清除自由基法、过氧化值法等,细胞分析法包括抗氧化酶活性测定法、脂质过氧化法、DNA氧化损伤测定法等,详见表2.

表2 杜仲叶主要抗氧化评价方法Tab.2 Main antioxidant evaluation methods of Eucommia ulmoides leaves
清除自由基法主要测定还原能力及对·OH、ABTS+、DPPH·、O2-等自由基清除能力. 李文娜等[10]结合还原能力、DPPH·、·OH、O2-、烷基自由基等体系比较杜仲叶绿原酸提取物、绿原酸标准品和VC体外抗氧化活性,发现杜仲叶绿原酸提取物清除以上自由基能力最强,且对红细胞溶血有一定的抑制作用.
过氧化值法(peroxide value,PV)是评价油脂氧化程度的常用方法,郑国栋等[47]通过超声提取制备杜仲叶萃取物,发现其对油脂过氧化值和酸价的影响显著优于VE、2,6-二叔丁基对甲酚(Butylated hydroxytoluene,BHT).
抗氧化酶活性测定法能够直接体现机体的抗氧化能力,机体的抗氧化酶防御系统包括过氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)和过氧化氢酶(CAT)等,SOD能够歧化自由氧离子为H2O2和O2,CAT能够催化H2O2转变为H2O和O2,GSH-Px 可以清除H2O2和脂质过氧化物,因此整个抗氧化体系相互保护,协同作用.
脂质过氧化物法基于分光光度法测定细胞内脂质不饱和双键氧化为醛、酮等化合物的原理,贾征等[45]通过测定小鼠组织脂质过氧化物丙二醛(MDA)含量反映细胞过氧化程度,发现杜仲叶黄酮对脂质过氧化有明显抑制作用. 通过测定机体抗氧化酶活性能够客观直接反映机体清除自由基能力. 研究证明杜仲叶多糖能够减少MDA含量,提升T-SOD、GSH-Px活力.
DNA 氧化损伤测定法基于CuSO4-Phen-VC-H2O2-DNA 化学发光体系,能够生成·OH,伴随DNA 的氧化降解产生很强的发光反应,采用此方法可以考察抗氧化剂对DNA损伤的保护作用. 如杜仲叶50%醇提物对小鼠大脑DNA损伤保护作用最佳,可有效改善大脑损伤状态[46].
5 结论
近年来,关于探寻天然抗氧化剂新型原料的征程一直未间断,天然抗氧化剂来源广泛,无毒副作用,具有较强的自由基清除能力. 杜仲叶作为“药食两用试点物质”有一定的先天优势,开发潜力巨大. 药理研究表明杜仲叶提取物不仅具有明显的抗氧化功能,还具有极高的药用价值,因此以杜仲叶天然提取物代替合成抗氧化剂是今后药品、保健食品、饮料等行业发展的一个热点方向,能够拓展杜仲单一药用价值至功能性食品、饮料、化妆品等领域,加快杜仲资源的深入开发利用.
目前关于杜仲叶的研究大多集中在医药领域,功能性食品开发方向的进展较为缓慢,主要体现在产品单一、功效范围狭窄、标准不完备等方面,另外,杜仲叶中含有多种营养成分如氨基酸,多糖、膳食纤维、维生素、矿物质等,适合开发营养健康食品,杜仲叶中多种功效成分,结合中药配伍理论,科学组合可以进一步拓展其应用功能和适用人群的范围,有利于多功能食品的开发,应加快杜仲叶天然抗氧化功能在油脂、坚果、饮料等易氧化食品类别中的应用步伐,杜仲叶抗氧化天然产物开发不足,其提取纯化研究不能和工业化接轨,应加强天然抗氧化成分提取、分离纯化方面的研究,尽快实现产业化,应进一步研究杜仲叶各活性成分.

