宫颈癌组织中HPV16 E6、E7蛋白水平与患者临床病理特征及预后的关系
路 玲,张媛媛,徐 瑶,吴宝华,徐 蕾,吴海燕
(1.成都医学院第一附属医院妇科,四川 成都 610500;2.新疆医科大学附属肿瘤医院妇科,新疆 乌鲁木齐 830054)
宫颈癌是全球女性最常见的生殖系统恶性肿瘤,据统计2018年全球宫颈癌新发病例超过56万人,由于宫颈癌导致的死亡病例超过31万人[1]。宫颈癌是我国女性发病率第二高的恶性肿瘤,早期宫颈癌由于症状和体征不明显易被忽略,导致疾病的进展和蔓延,晚期宫颈癌患者预后通常较差,五年生存率低于40%,严重威胁我国女性健康安全[2]。过去的研究已证实宫颈癌的发生发展与人乳头瘤病毒(human papilloma virus,HPV)感染密切相关,目前HPV16、HPV18、HPV31、HPV33、HPV35等15种高危型HPV已被报道参与宫颈癌的发生和进展[3],其中又以HPV16、HPV18感染率最高,占所有高危型HPV感染的70%以上[4]。16型人乳头瘤病毒E6蛋白(human papilloma virus type 16 E6 protein,HPV16 E6)和16型人乳头瘤病毒E7蛋白(human papilloma virus type 16 E7 protein,HPV16 E7)均是HPV16基因编码的蛋白质,相关研究表明其参与宫颈癌[5]、非小细胞肺癌(non-small cell lung cancer,NSCLC)[6]的发生和进展,但宫颈癌中HPV16 E6、HPV16 E7水平与患者临床病理特征和预后的关系尚不完全明确,本研究通过免疫组织化学法检测宫颈癌组织中HPV16 E6、HPV16 E7蛋白表达情况,旨在为宫颈癌患者的治疗及预后评估提供相关依据。
1 资料与方法
1.1一般资料 选取2016年3月—2018年3月于成都医学院第一附属医院行宫颈癌根治术的宫颈癌患者87例,年龄25~73岁,平均(50.11±10.14)岁;采用国际妇产科联盟(International Federation of Obstetrics and Gynecology,FIGO)标准进行分期,其中ⅠA期~ⅠB1期56例,ⅠB2期~ⅡA期31例;中、高分化60例,低分化27例。留取每例患者术中切除的肿瘤组织、癌旁组织(距肿瘤组织>2 cm)、正常宫颈组织标本,每种组织标本为一组。本研究中选取的左右组织均为宫颈癌根治术中收集到的肿瘤组织、癌旁组织以及正常组织,组织新鲜,经甲醛固定后采用石蜡包埋保存。纳入标准:①患者均初发宫颈癌,诊断标准依据《宫颈癌诊疗规范(2018年版)》[7];②患者身体状况良好,能够接受手术治疗;③患者术前未接受放、化疗、靶向治疗及生物免疫治疗;④患者未合并其他恶性肿瘤、自身免疫性疾病、精神神经疾病。排除标准:①患者为宫颈癌复发或其他脏器肿瘤转移;②患者合并心脏、肾脏等重要脏器功能不全;③患者术前接受过放、化疗、靶向治疗及生物免疫治疗。采用电话、微信、电子邮件、门诊等方式对患者进行随访,随访间隔为3个月,随访患者死亡则停止随访,随访时间截止至2021年3月。本研究经医院伦理委员会审核并通过,所有患者及家属均知情同意且签署知情同意书。
1.2方法
1.2.1试剂与耗材 HPV16 E6、HPV16 E7蛋白兔抗人一抗均购自美国SCBT公司;SP免疫组织化学法试剂盒、DAB-Kit显色液、磷酸盐缓冲液(phosphate buffer salin,PBS)、苏木精染液、中性树胶均购自北京中杉金桥生物遇险公司;高性能组织病理切片、光学显微镜均购自德国徕卡公司。
1.2.2免疫组织化学法检测HPV16 E6、HPV16 E7表达水平 将病理组织切片采用二甲苯脱蜡处理,梯度乙醇水化后滴加3%过氧化氢溶液封闭15 min消除内源酶,加入柠檬酸型抗原修复液(pH=6.0±0.1),采用高压抗原修复法修复抗原,冷却后使用PBS冲洗,滴加山羊血清封闭内源性生物素。HPV16 E6、HPV16 E7一抗均按照说明书所示进行1∶100稀释,与切片在4 ℃湿盒中孵育过夜,次日PBS冲洗后加入辣根过氧化物酶标记的二抗室温下孵育1 h,PBS冲洗后滴加DAB-Kit显色30 s左右,水洗终止显色,再滴加苏木精复染1 min,梯度酒精脱水后中性树胶封片,显微镜下观察并对染色结果进行评分。
1.2.3结果判读 显微镜下观察HPV16 E6、HPV16 E7蛋白均表达于细胞核和细胞浆中,但主要在细胞核中表达。以镜下出现棕黄色颗粒为蛋白阳性表达,高倍镜下随机取5个视野并计数1 000个细胞,根据阳性细胞所占比例进行评分。根据染色强度评分:未着色为0分、淡黄色为1分、棕黄色为2分、褐色为3分;根据阳性细胞所占比例进行评分:<10%为0分、10%~40%为1分、40%~70%为2分,>70%为3分。以上述两项得分相乘,<2分为蛋白阴性表达,2~3分为(+),4~7分为(++),≥8分为(+++),已评分≥2分为蛋白阳性表达。
1.3统计学方法 应用SPSS 22.0统计软件分析数据。计量资料比较采用t检验,计数资料采用χ2检验,采用Kaplan-Meier生存曲线比较患者生存情况,采用COX回归分析各项因素对患者预后的影响。P<0.05为差异有统计学意义。
2 结 果
2.1不同组织中HPV16 E6、HPV16 E7蛋白表达情况 癌旁组织中HPV16 E6、HPV16 E7蛋白阳性率高于正常组织,肿瘤组织中HPV16 E6、HPV16 E7蛋白阳性率高于癌旁组织和正常组织,差异有统计学意义(P<0.05),见表1。
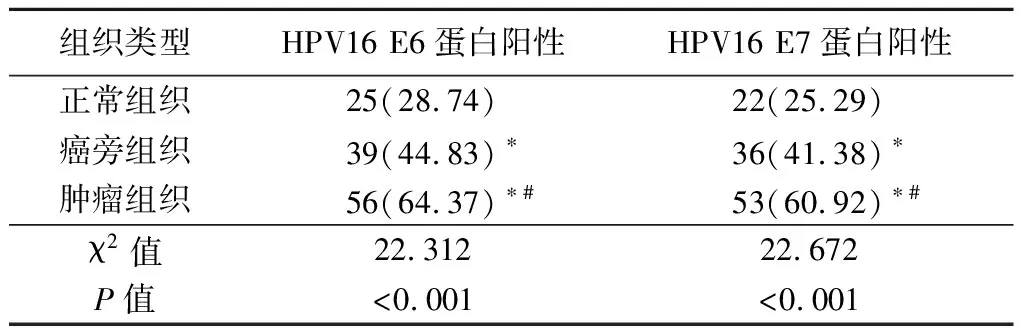
表1 不同组织中HPV16 E6、E7蛋白阳性率比较
2.2HPV16 E6、HPV16 E7蛋白与临床病理特征的关系 3中组织中HPV16 E6、HPV16 E7蛋白表达在不同的患者年龄、肿瘤组织学类型中差异无统计学意义(P>0.05),但在肿瘤FIGO分期、分化程度、合并淋巴结转移情况、肌层浸润深度以及肿瘤直径中差异有统计学意义(P<0.05),见表2,3。

表2 HPV16 E6蛋白与临床病理特征的关系
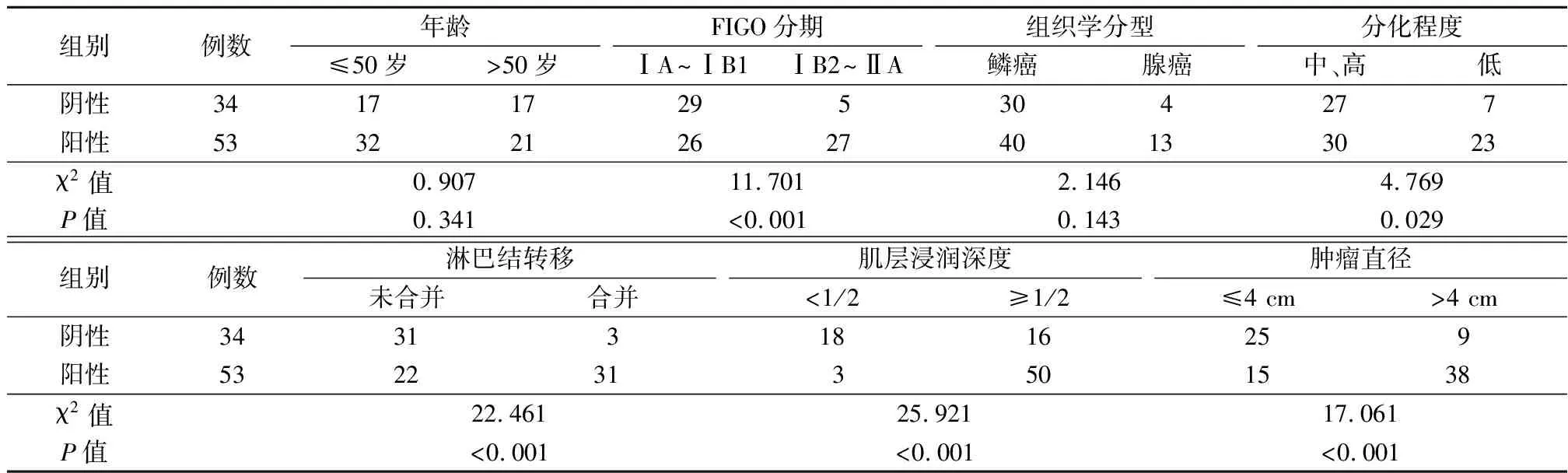
表3 HPV16 E7蛋白与临床病理特征的关系
2.3HPV16 E6、HPV16 E7与患者生存率的关系 截至2021年3月,宫颈癌患者87例中存活60例,死亡25例,失访2例,患者3年生存率68.97%,所有死亡患者均死于宫颈癌复发或进展。Kaplan-Meier生存曲线分析结果显示前宫颈癌组织HPV16 E6及HPV16 E7蛋白阳性表达患者3年生存率低于阴性表达患者,差异有统计学意义(P<0.05),见图1。

图1 HPV16 E6、HPV16 E7表达与患者生存率的关系
2.4HPV16 E6、HPV16 E7与患者预后的关系 以患者预后(预后良好=0,预后不良=1)为自变量,以HPV16 E6(阴性=0,阳性=1)、HPV16 E7(阴性=0,阳性=1)、年龄(<50岁=0,>50岁=1)、FIGO分期(ⅠA~ⅠB1=0,IB2~ⅡA=1)、组织学分型(腺癌=0,鳞癌=1)、分化程度(低分化/中=0,高分化=1)、淋巴结转移(未合并=0,合并=1)、肌层浸润深度(<1/2=0,≥1/2=1)、肿瘤直径(≤4 cm=0,>4 cm=1),多因素分析显示,HPV16 E6阳性、HPV16 E7阳性、FIGO分期(IB2~ⅡA)、肌层浸润深度(≥1/2)、肿瘤直径(>4 cm)均可作为宫颈癌患者预后不良的独立危险因素(P<0.05),见表4。

表4 HPV16 E6、HPV16 E7与患者预后的多因素回归分析
3 讨 论
研究表明,宫颈癌的发生发展与HPV感染具有密切联系,在宫颈癌组织中检出率极高,持续HPV感染能够引起宫颈不典型增生,是宫颈癌的常见诱因之一[8]。随着医学研究的进步,到目前为止人类已分离并鉴定了超过150种HPV基因型,并根据其致癌能力的差异将HPV分为主要引起良性病变的低危型HPV(如HPV6型、11型)和能够引起细胞恶性转化的高危型HPV(如HPV16型、18型)[9]。HPV是一种小型环状DNA病毒,主要感染皮肤以及生殖器,但相关文献报道HPV与口腔鳞癌、乳腺癌等恶性肿瘤的发生相关,但结果尚不完全明确[10-11]。
病毒蛋白HPV16 E6、E7与HPV的致癌性密切相关,研究显示E6、E7蛋白不具备酶的活性,通过与宿主细胞内蛋白形成复合物的形式参与细胞生命活动的调控[11]。E6蛋白能够与细胞内泛素连接酶结合并改变构象,特异性结合细胞内p53蛋白,导致p53泛素化并降解[12-13],p53是目前已知具有最强的抑癌基因,E6通过降解p53表达产物抑制抑癌基因活性,从而参与肿瘤的发生和发展,具有较强的促肿瘤作用。而E7蛋白能够与抑癌基因pRb产物特异性结合并导致其失活,导致细胞周期失控,抑制细胞凋亡过程,引起细胞过度增殖,诱导肿瘤疾病的产生[14]。相关研究表明HPV感染后E6、E7共同发挥作用,E7蛋白促进肿瘤的生长,而E6蛋白大大提高E7的致癌能力,仅E7蛋白异常表达常导致尖锐湿疣等良性病变的发生,而联合E6蛋白异常表达则常导致恶性病变而发生。
本研究显示宫颈癌组织中HPV16 E6、E7蛋白阳性率明显高于癌旁组织和正常组织,且与肿瘤FIGO分期、分化程度、合并淋巴结转移情况、肌层浸润深度以及肿瘤直径相关,提示宫颈癌组织中HPV16 E6、E7蛋白存在过表达情况,且促进肿瘤的生长和进展。李芳等[15]研究显示HPV16 E6、E7 DNA水平升高对宫颈癌淋巴结转移具有预警作用,可作为反映宫颈癌淋巴结微转移的指标;王慧玲等[16]研究显示抑制宫颈癌细胞中HPV16 E6、E7蛋白的表达能够抑制宫颈癌细胞的上皮间质转化过程,促进肿瘤细胞的凋亡。上述结果均反映HPV16 E6、E7蛋白过表达促进了宫颈癌的发生和发展。本研究结果显示HPV16 E6、E7蛋白阳性的宫颈癌患者3年生存率低于阴性患者,单因素回归分析结果显示HPV16 E6、E7蛋白阳性表达均能够给增加患者死亡风险,而多因素回归分析结果显示HPV16 E6、E7蛋白阳性表达均与患者预后不良相关,可作为患者预后的独立预测指标发挥临床作用。
综上所述,宫颈癌患者肿瘤组织中HPV16 E6、E7蛋白呈高表达,且与患者临床病理特征和预后相关,可作为患者预后的独立预测指标,可能为宫颈癌诊断和治疗的提供相关靶点,本研究的不足之处在于研究样本量较少,且能够对HPV16 E6、E7蛋白促进宫颈癌发生发展的机制进行研究,需要在后续研究中加以补足。

