阿司匹林和氯吡格雷联合应用对小鼠脑缺血恢复期RAGE及sRAGE表达的影响
温少红,刘向荣,赵顺英,董雯,陈青芳,陈文涛,李子孝,2,王春娟,2
卒中是我国居民的第三位死亡原因,其中缺血性卒中占80%,是获得性长期残疾的第一大原因[1]。研究证实阿司匹林和氯吡格雷联合治疗21 d可降低轻型缺血性卒中或TIA患者的卒中复发率和致残率[2-3]。但目前缺少阿司匹林和氯吡格雷联合治疗有效性的机制研究。
晚期糖基化终末产物受体(receptor for advanced glycation end products,RAGE)是免疫球蛋白超家族成员之一,广泛存在于神经元、胶质细胞和内皮细胞中[4-5],可以作为细胞坏死性死亡的传感器,促进炎症发生并加剧缺血性脑损伤[6-7];另一方面,可溶性RAGE(soluble RAGE,sRAGE)作为诱饵受体,可以与细胞表面的RAGE竞争配体,从而阻断RAGE介导的炎症相关跨膜信号转导[8]。脑缺血引起的炎症级联反应会导致神经组织损伤和细胞死亡,同时也在组织重塑和修复中发挥重要作用[9]。因此,推测RAGE和sRAGE在缺血性卒中的病理生理机制中可能发挥重要作用。本研究旨在探索阿司匹林和氯吡格雷联合应用对小鼠大脑中动脉远端缺血再灌注模型恢复期RAGE及sRAGE表达的影响及其可能机制。
1 材料与方法
1.1 实验动物 选取8~10周C57BL/6雄性小鼠60只,购于北京华阜康生物科技控股有限公司。本实验遵照北京市神经外科研究所实验动物福利伦理委员会要求进行(动物伦理批号:202002003),实验小鼠采用标准饲料和纯净水分笼饲养,饲养温度22~24 ℃,相对湿度50%~60%,12 h循环照明。
1.2 模型制作 小鼠称体重后,随机分为假手术组、溶剂组、阿司匹林和氯吡格雷联合组(双抗组),每组各20只。小鼠大脑中动脉远端缺血再灌注模型(distal middle cerebral artery occlusion-reperfusion,dMCAO-R)制作方法如下:异氟醚麻醉小鼠,在小鼠右眼和右耳之间进行皮肤切口,在颅骨上钻孔,使用30G钝头针压迫暴露的大脑中动脉远端;血管闭塞60 min后取针实现脑血流部分再灌注[10]。假手术组在颅骨上钻孔后只分离血管,不压迫大脑中动脉远端。术中通过激光多普勒血流仪(瑞沃德,中国)监测脑血流判断模型是否成功,体温维持仪维持小鼠术中肛温37±0.5 ℃。
1.3 实验用药的溶液配制与给药 本研究所用阿司匹林为拜耳医药保健有限公司生产的阿司匹林肠溶片(每片100 mg,批号BJ49807);氯吡格雷为赛诺菲(杭州)制药有限公司生产的硫酸氢氯吡格雷片(每片75 mg,批号9A866)。阿司匹林和氯吡格雷混合液配制方法:①取阿司匹林肠溶片用研钵磨碎,将药粉转移至离心管内,加入8.333 mL饮用水,吹打均匀并标记;②取硫酸氢氯吡格雷片用研钵磨碎,将药粉转移至另一离心管内,加入6.250 mL饮用水,吹打均匀并标记;③分别取6.250 mL阿司匹林混合液、6.250 mL氯吡格雷混合液、12.500 mL饮用水混合,此混悬液中阿司匹林和氯吡格雷的浓度均为3 mg/mL。模型前小鼠体质量为25 g,阿司匹林和氯吡格雷给药剂量均为12 mg/kg,因此每只小鼠每次需混悬液体积100 μL。双抗组再灌注后即刻灌胃给予阿司匹林和氯吡格雷混悬液100 μL,后每日同剂量灌胃1次,连续21 d;溶剂组给予同等体积饮用水灌胃,持续21 d;假手术组不给药。实验流程见图1。
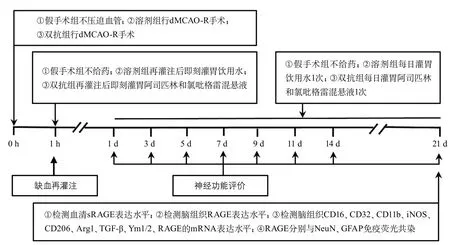
图1 实验流程图
1.4 神经功能评价 脑缺血后1、3、5、7、9、11、14、21 d分别进行改良加西亚神经功能评分,该评分包括本体感觉、胡须碰触、肢体对称性、侧转向和前肢行走5项,每项满分3分,总分15分[11]。1.5 取材 21 d神经功能评价结束后,进行小鼠眼球内眦采血和脑组织取材。
眼球内眦采血:麻醉小鼠后,用左手手指压迫小鼠颈部两侧,使眼球充分外突,右手持毛细采血管沿内眦插入内眼角,轻轻向眼底方向刺入,收集血液。3000 rpm离心10 min留取血清置于-80℃冰箱备用,后续用于酶联免疫吸附剂测定(enzyme linked immunosorbent assay,ELISA)检测血清中sRAGE表达水平(每组6只)。
脑组织:①麻醉小鼠后,使用手术器械依次剪开头皮、颅骨,取出小鼠大脑,分离缺血侧皮层组织置于-150 ℃冰箱备用。部分用于免疫印记实验检测RAGE相对表达水平(每组5只);部分用于实时荧光定量PCR检测炎症因子及RAGE的mRNA表达水平(每组5只)。②麻醉小鼠后,依次采用磷酸盐缓冲液、固定液对小鼠进行心脏灌流,灌流结束后取大脑依次浸泡于固定液、30%蔗糖溶液中,后续进行冰冻切片及免疫荧光染色(每组4只)。
1.6 酶联免疫吸附试验 取血清样本,采用小鼠晚期糖基化终末产物特异性受体ELISA试剂盒(CSB-EL001441MO,武汉华美生物)检测血清sRAGE表达水平。具体方法如下:向酶标板中依次加入样本或标准品、生物素化的抗RAGE抗体、辣根过氧化物酶标记的亲和素,洗涤后用底物显色。底物在过氧化物酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。用酶标仪(TECAN,瑞士)在450 nm波长下测定吸光度(optical density,OD),计算样本中sRAGE浓度。
1.7 免疫印迹试验 取小鼠缺血侧皮层组织样本,研磨后12 000 rpm离心20 min,取上清液经BCA蛋白检测试剂盒(Pierce,美国)定量后依次进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳、蛋白转膜、膜的封闭、一抗(Proteintech,美国,稀释比例1∶800)孵育、二抗(抗鼠IgG,CST,美国,稀释比例1∶2500)孵育、发光液显影,通过G:BOX化学发光成像系统(Syngene,英国)检测蛋白条带,使用Image J软件分析图像并计算RAGE的相对表达量。内参抗体为甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)(景杰生物,中国,稀释比例1∶1000)。
1.8 荧光实时定量PCR 应用RNA提取试剂盒(Qiagen,德国)提取小鼠缺血侧皮层组织RNA,应用逆转录试剂盒(Takara,日本)将mRNA逆转录成cDNA,之后进行实时荧光定量PCR扩增。应用2-ΔΔCt计算溶剂组、双抗组与假手术组之间扩增指标的相对表达量。扩增指标包括CD16、CD32、CD11b、诱导型一氧化氮合成酶(inducible nitric-oxide synthase,iNOS)、CD206、精氨酸酶1(arginase1,Arg1)、转化生长因子β(transforming growth factor β,TGF-β)、几丁质酶样蛋白(chitinase-like 3,Chil3/Ym1/2)、RAGE。引物购自英维捷基(上海)贸易有限公司,其序列见表1[12],其中RAGE引物序列采用Primer Premier 6.0软件设计。

表1 引物序列
1.9 免疫组织荧光染色 取小鼠脑组织样本进行冰冻切片。切片依次进行破膜、封闭、一抗孵育、二抗孵育、4',6-二脒基-2-苯基吲哚(4',6-diamidino-2-phenylindole dihydrochloride,DAPI)封片。其中一抗RAGE(Proteintech,美国,稀释比例1∶200)分别与神经元特异核蛋白(neuronal nuclei,NeuN)(Merck,美国,稀释比例1∶500)、胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)(CST,美国,稀释比例1∶500)免疫荧光共染,标记神经元和星形胶质细胞,DAPI标记细胞核。使用激光共聚焦显微镜(Carl Zeiss AG,德国)观察RAGE与梗死周边区神经元、星形胶质细胞共定位情况并拍照,使用Image J软件对RAGE+NeuN+细胞计数。1.10 统计学方法 采用GraphPad Prism 8.0.2软件进行统计分析,计量资料符合正态分布,以表示;多时间点多组比较采用双因素方差分析,在整体差异有统计学意义的情况下进行Bonferroni法两两比较;单时间点多组比较采用单因素方差分析,在整体差异有统计学意义的情况下进行Tukey检验两两比较。以P<0.05为差异有统计学意义。
2 结果
2.1 神经功能评分结果 缺血再灌注后1、3、5、7、9、11、14、21 d评价小鼠改良加西亚评分,结果显示3组间本体感觉、胡须碰触和总分差异均有统计学意义。两两比较显示,溶剂组各时间点各分项评分及总评分均低于假手术组,差异有统计学意义;双抗组各时间点各分项评分及总评分均低于假手术组,差异有统计学意义;双抗组3 d时胡须碰触评分(P=0.0067)、3 d时总评分(P=0.0140)、9 d时总评分(P=0.0406)高于溶剂组,差异有统计学意义(表2)。
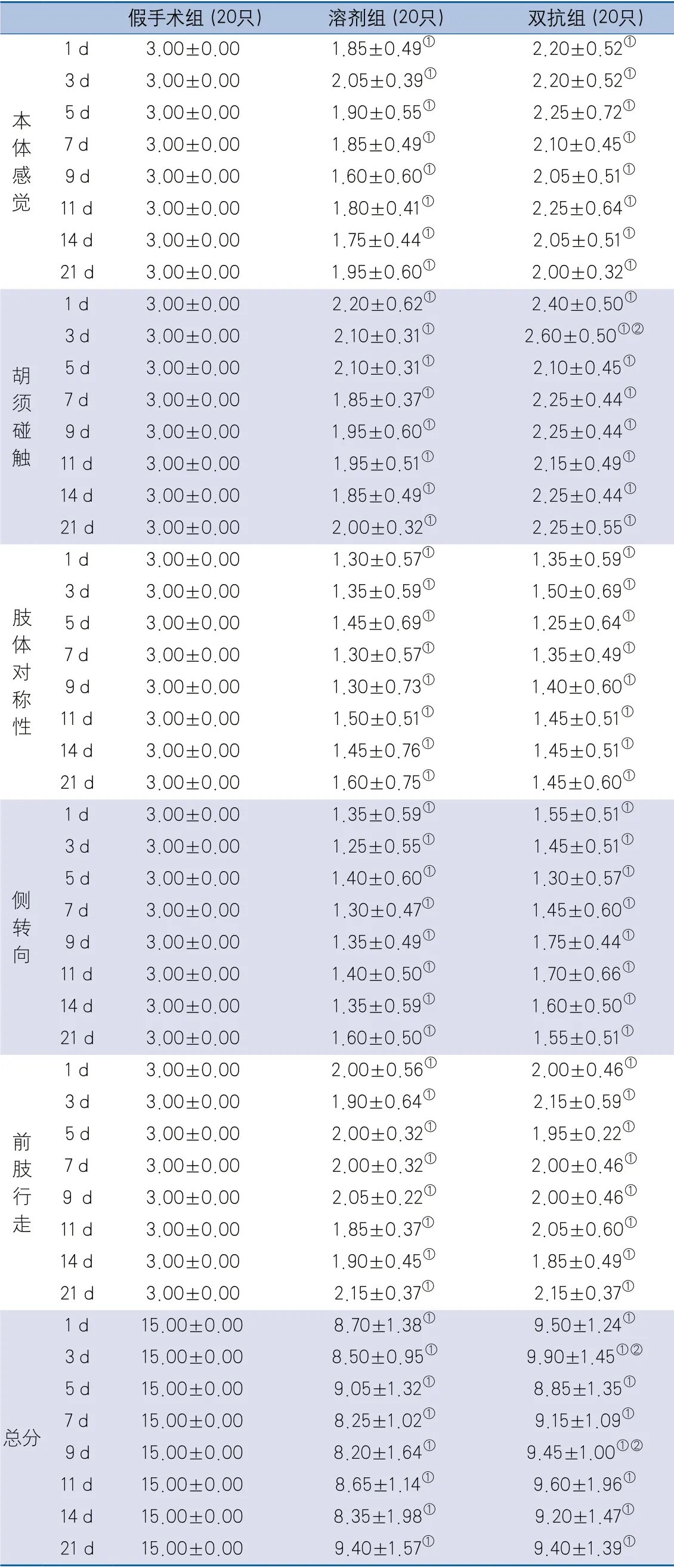
表2 缺血再灌注后小鼠不同时间改良加西亚评分结果[单位:分]
2.2 血清sRAGE及缺血侧皮层RAGE表达水平缺血再灌注21 d时,3组间血清sRAGE水平差异有统计学意义,两两比较显示,双抗组血清sRAGE水平高于溶剂组(P=0.0120);3组间缺血侧皮层RAGE相对表达量差异无统计学意义(表3,图2)。
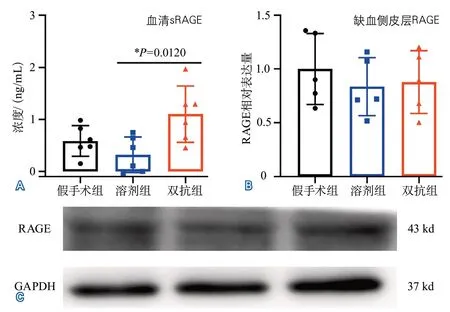
图2 缺血再灌注21 d小鼠血清sRAGE浓度及缺血侧皮层RAGE相对表达量
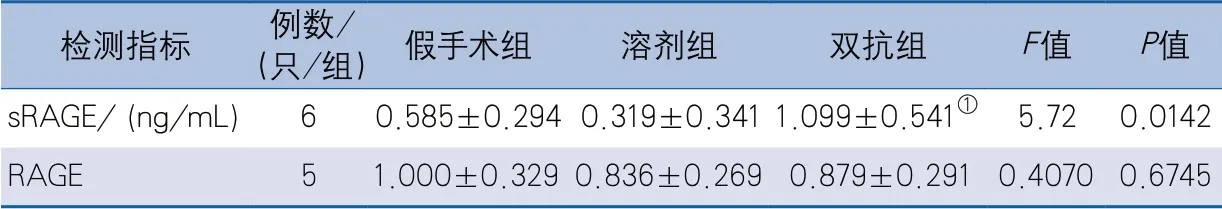
表3 缺血再灌注21 d小鼠血清sRAGE浓度及缺血侧皮层RAGE相对表达量
2.3 缺血侧皮层炎症因子及RAGE的mRNA相对表达情况 缺血再灌注21 d,3组间除Arg1外,缺血侧皮层其他炎症因子和RAGE的mRNA相对表达量差异均有统计学意义(表4)。两两比较显示,与假手术组相比,溶剂组各炎症因子和RAGE的mRNA水平均升高,差异有统计学意义;与假手术组相比,双抗组除CD32、iNOS外,其他其他炎症因子和RAGE的mRNA水平均升高,差异有统计学意义;与溶剂组相比,双抗组iNOS(P=0.0164)、RAGE(P=0.0071)的mRNA表达水平降低,差异有统计学意义(表4)。
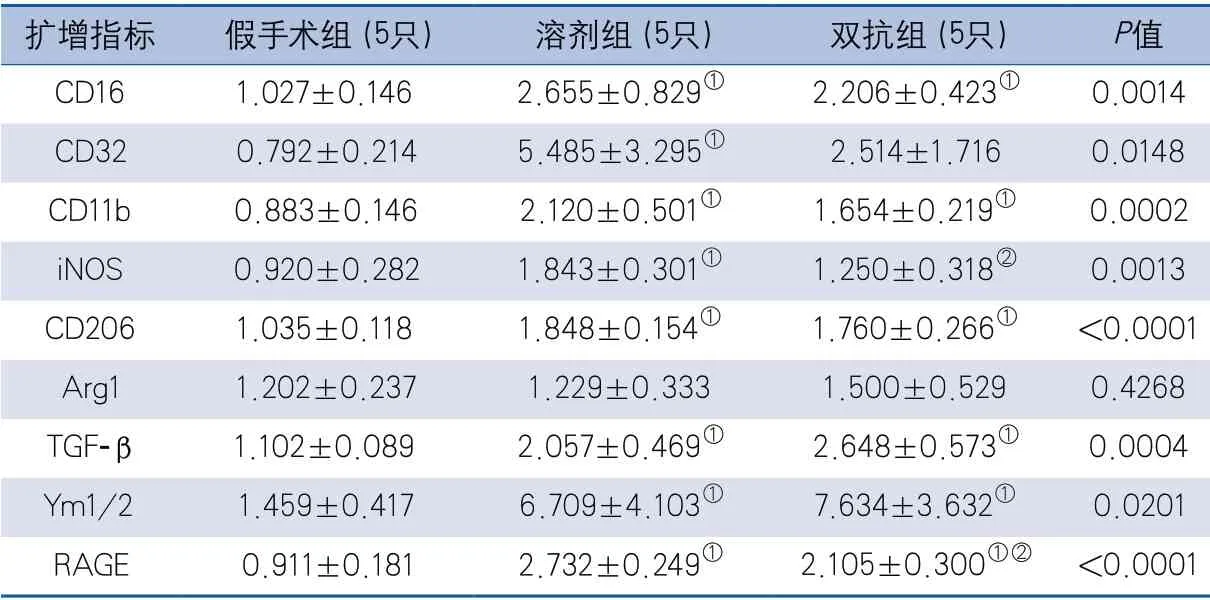
表4 缺血再灌注21 d小鼠缺血侧皮层炎症因子及RAGE的mRNA相对表达量
2.4 缺血小鼠脑梗死周边区RAGE和神经元、星形胶质细胞共定位情况 缺血再灌注21 d,采用Image J软件统计RAGE+/NeuN+细胞在单位面积(1 mm2)的数量,假手术组为421.391±122.56个,溶剂组为814.437±165.758个,双抗组为328.798±35.183个,3组间差异有统计学意义(F=18.24,P=0.0007);两两比较显示,假手术组、双抗组与溶剂组的差异均有统计学意义(P=0.0088、0.0012)(图3)。
3 讨论
目前,阿司匹林和氯吡格雷联合治疗已广泛应用于临床预防轻型缺血性卒中和TIA的复发,因其可以改善卒中患者发病90 d的功能预后,降低卒中复发的整体致残率[3-4]。根据临床研究结果以及本课题组前期的基础研究,阿司匹林和氯吡格雷联合治疗的最佳临床获益时间为卒中发生后的前3周内[2,10,13],因此本研究选择小鼠脑缺血再灌注后21 d作为各项指标的考察时间,旨在探索阿司匹林和氯吡格雷联合治疗可能的保护机制。本研究神经功能评价的结果显示,阿司匹林和氯吡格雷联合给药可以在一定程度上提高脑缺血再灌注小鼠改良加西亚评分(3 d时胡须碰触评分、3 d时总分、9 d时总分),提示其可以促进脑缺血再灌注小鼠短期神经功能的恢复。
RAGE是一种涉及多种慢性炎症状态的多配体模式识别受体,可以结合并介导一系列与损伤相关分子模式分子的细胞反应。细胞和动物模型实验证实,阻断RAGE信号可以减轻炎症反应,减少糖尿病血管并发症、心血管疾病以及肿瘤的进展[14]。本研究中,缺血再灌注21 d时,双抗组小鼠血清sRAGE水平较溶剂组升高(P=0.0120),缺血侧皮层中RAGE的mRNA相对表达量较溶剂组降低(P=0.0071),提示阿司匹林和氯吡格雷联合治疗除了抗血小板外,还可能通过上调sRAGE的表达水平,减轻脑缺血后的炎症反应。
本研究还考察了小胶质细胞相关炎症因子的相对表达量,其中双抗组和溶剂组的CD16、CD32、CD11b、CD206、Arg1、TGF-β、Ym1/2表达水平差异无统计学意义。既往研究提示缺血性卒中后梗死周边区小胶质细胞发生动态极化[12]:M2型小胶质细胞(抗炎表型)表达在7 d内短暂性升高而后逐渐下降,M1型小胶质细胞(促炎表型)表达在3 d时开始逐渐升高直至14 d出现下降。推测在本研究选取的考察时间,即卒中后21 d,小胶质细胞不同表型的表达已处于动态平衡,因此未能观测到相关炎症因子的变化。值得关注的是,双抗组小鼠缺血侧皮层中促炎因子iNOS的表达水平较溶剂组显著下降(P=0.0164)。缺血诱导的iNOS+炎症细胞除了直接释放NO外,还通过产生各种炎症因子触发炎症级联反应,从而导致神经元损伤[15]。推测iNOS与RAGE在缺血性卒中的发生发展中产生了协同作用,另一方面iNOS表达水平下调也可能与sRAGE表达上调相关。sRAGE可在心血管疾病中抑制氧化应激和炎症反应,被认为是心血管事件发生和复发的重要标志物[16]。已有报道提示sRAGE在急性缺血性卒中患者功能预后中具有保护性作用,发病48 h时其血浆表达水平是急性缺血性卒中患者预后显著的预测指标[17]。
本研究在动物模型中对脑缺血后RAGE、sRAGE及相关炎症因子表达水平的变化进行了分析,但测定的时间点为恢复期(21 d),不能明确上述指标在脑缺血急性期内的变化趋势,并与小鼠缺血急性期内的神经功能变化相对应。后续研究将进一步深入探索脑缺血后上述炎症指标的变化曲线及其可能的互相影响的机制。
【点睛】阿司匹林和氯吡格雷联合应用可在小鼠脑缺血恢复期调控RAGE表达,减轻炎症,发挥脑保护作用。

