铱单原子和纳米粒子在N2O分解反应中的协同催化
杨静怡,李庆贺,乔波涛
(中国科学院大连化学物理研究所,大连 116023)
负载型金属催化剂被广泛应用于现代化工生产过程中.由于贵金属价格昂贵、资源有限,提高金属利用效率一直是负载型催化剂制备科学的核心问题之一.高分散(也即减少被负载金属尺寸)是提高金属利用效率的最简单有效的方式之一.随着金属尺寸的减小,其暴露的表面活性原子数目增加.当催化剂中的活性金属以单个原子中心的形式分散在载体上时,负载金属的利用效率达到最大.因此,自2011年中国科学院大连化学物理研究所张涛院士团队与清华大学李隽教授和亚利桑那州立大学刘景月教授共同提出“单原子催化”概念以来[1],单原子催化迅速发展为多相催化领域的研究前沿和热点.在过去的10年中,单原子催化剂的制备方法发展迅速,除了最初的共沉淀法,还逐渐发展出了强静电吸附法、有机金属配位聚合法、载体稀释法、电化学法及原子层沉积法等多种方法[2~5].其中,原子捕获法利用金属与载体间的强相互作用,经过物理混合与后续高温焙烧即可实现,是一种简单、快速、有望实现批量制备高载量高热稳定的单原子催化剂的普适性方法.2016年,Datye教授和王勇教授团队[6]最先报道了利用不同形貌的CeO2载体在高温氧气气氛下捕获PtO2气相物种,制备得到Pt1/CeO2单原子催化剂.随后,吴宇恩教授团队[7]直接在氨气气氛下加热固体金属前体,形成易挥发的M(NH3)x物种,利用氮掺杂的碳载体进行捕获,制备了一系列高热稳定的单原子催化剂.2020年,本课题组也报道了MgAl1.2Fe0.8O4和MgAl2O4尖晶石载体在高温条件下捕获RuO2和PtO2,制备了Ru1/MgAl1.2Fe0.8O4,Ru1/MgAl2O4和Pt1/MgAl1.2Fe0.8O4单原子催化剂[8,9].由于该方法通常在800~1000 ℃的高温条件下进行,因此制备得到的单原子催化剂具有优异的热稳定性[10].
然而,高热稳定的单原子催化剂也面临着催化活性不足、反应适用范围窄的问题[11].如何拓宽单原子催化剂的应用场景,挖掘单原子催化剂在高温反应中的应用潜力成为催化领域中的难点.近年来一些研究表明,利用单原子和纳米粒子对反应物分子吸附强度的不同,可以实现单原子和纳米粒子的协同催化.如,Newton教授等[12]和Kaper教授等[13]均发现在低温CO氧化反应中,金属态的Pt纳米粒子可以为CO提供强的吸附位点,而氧化态的Pt单原子位点则为CO提供了活性氧,从而实现Pt基催化剂在低温条件下的CO 氧化.李亚栋院士团队[14]报道了同时负载有单原子和纳米粒子的Pd 催化剂,其比只有一种分散形式的Pd催化剂在酮醛加氢反应中表现出了更高的反应活性.因为单原子的存在为C=O基团的活化提供了更多的活性位点,而纳米粒子可以更高效地解离H2.邢巍研究员、葛君杰研究员和姜政研究员等[15]发现,Ir单原子位点不仅是良好的CO 氧化位点,而且可以有效协助/调节Ir纳米粒子上的CO 脱附,从而提高催化剂抗CO 中毒能力.因此,在催化剂上同时构建单原子和纳米粒子,是进一步开发单原子催化剂的应用和构建高效催化剂的途径之一.本文通过在Ir单原子催化剂上引入Ir纳米粒子,可以提高催化剂在氧化亚氮分解反应中的活性.研究发现,Ir纳米粒子可以更加有效地解离氮氧化物,而高价态的Ir单原子可以帮助Ir纳米粒子快速脱附产物氧气,从而使整体催化性能得到显著提升.本研究对理解单原子在催化反应中的作用提供了新认识.
1 实验部分
1.1 试剂与仪器
氧化铱,纯度99.99%,美国Alfa Aesar 公司;六水合氯铱酸(H2IrCl6),分析纯,美国Sigma-Aldrich公司;乙二醇、氢氧化钠和六水合硝酸镁,分析纯,天津科密欧化学试剂有限公司;异丙醇铝,分析纯,阿拉丁化学试剂有限公司;无水乙醇,分析纯,国药集团化学试剂有限公司.
ICP-OES 7300DV 型电感耦合等离子发射光谱仪(ICP-OES),美国PerkinElmer 公司;Thermo ESCALAB 250Xi 型X 射线光电子能谱仪(XPS),美国赛默飞公司;JEOL JEM-2100F 型和JEOL JEM-ARM200F型透射电子显微镜(TEM),日本电子株式会社;Micromeritics AutoChem II型2920化学吸附仪,美国Micromeritics 公司;Agilent 7890B 型气相色谱仪,日本Agilent 公司;Bruker EQUINOX 55 型红外光谱仪,美国Bruker公司.
1.2 实验过程
1.2.1 镁铝尖晶石载体的制备 镁铝尖晶石(MgAl2O4)通过乙醇溶剂热方法合成.具体操作步骤为:分别将76.92 g六水合硝酸镁(0.30 mol)、122.40 g异丙醇铝(0.60 mol)溶解到900 mL无水乙醇中,随后置于2 L带有聚四氟乙烯内衬的反应釜中,拧紧反应釜,在约900 r/min的搅拌速率下,加热至120 ℃,保持2 h,再升温至160 ℃,保持10 h.过液冷却至室温后开釜,对所得的前驱体进行抽滤,洗涤处理.随后将前驱体放入马弗炉中,以2 ℃/min 速率升温到120 ℃,保持2 h,然后升温至800 ℃焙烧5 h,最后得到MgAl2O4(MA)尖晶石.将合成的MgAl2O4粉末加入适量超纯水中并搅拌成泥浆,通过模具挤条造型,在120 ℃烘箱中干燥12 h,即可得到MgAl2O4粒子载体.
1.2.2 Ir 单原子催化剂的制备 单原子Ir1/MgAl2O4催化剂采用高温原子捕获的方法制备.首先将200 mg MgAl2O4粒子放在氧化铱粉末上面,并放入石英管内,以50 mL/min 流速通入空气,在900 ℃下焙烧10 h.焙烧结束后,上层粉末直接倒出.通过ICP测试,确定最终样品中Ir的负载量(质量分数)为0.45%.制备得到的单原子Ir催化剂经过300 ℃还原处理,并命名为IrSAC/MA.
1.2.3 Ir 纳米粒子催化剂的制备 取0.5 g H2IrCl6·6H2O 溶于50 mL 乙二醇中,加入25 mL 1.0 mol/L NaOH的乙二醇溶液,在室温下搅拌1 h.在Ar气保护下,溶液在160 ℃下反应1 h,得到Ir纳米溶胶.
取一定量的MgAl2O4或IrSAC/MA 催化剂粉末加入到50 mL 的乙二醇中,随后在80 ℃水浴中继续搅拌分散.取一定量的Ir纳米溶胶逐滴加入到载体的悬浊液中,并继续在80 ℃搅拌3 h,老化1 h,趁热过滤洗涤,在80 ℃干燥过夜.干燥后的粉末在300 ℃空气气氛下焙烧1 h,得到的催化剂分别命名为IrNP/MA和IrSAC+NP/MA.
1.2.4 催化剂的表征 先将催化剂在玛瑙研钵中研细,然后在乙醇中超声分散30 min.静置一段时间后,取上层清液滴至微栅上,干燥后进行TEM测试.
XPS 测试采用单色化AlKα(1486.6 eV,15 kV,10.8 mA)为激发源.将样品压片后用超高真空专用绝缘胶带固定在样品托上,在仪器快速进样室和样品制备室中分别逐级抽空后进入分析室测量.使用C1s信号(284.6 eV)为内标进行表面核电校正.
CO 吸附的原位漫反射红外光谱(CO-DRIFTs)实验在配有光电导(MCT)检测器的红外光谱仪上进行.将约20 mg催化剂粉末首先置于原位红外池(HC-500型,美国Pike technologies 公司)中,压平表面.在10%H2-90%He气氛、150 ℃下原位还原30 min,然后在He气氛下降低至室温(20 ℃),并保持He气吹扫1 h.待基线平稳后,采集背景信号,并将气体切换至流速为30 mL/min的3%CO-97%He进行CO吸附,记录红外吸附信号至吸附饱和,再将气体切换至流速为30 mL/min 的He 气进行吹扫,每隔30 s记录一次红外谱图.
氧气程序升温脱附(O2-TPD)实验在化学吸附仪上进行,由TCD(热导检测器)和在线质谱(Cirrus II,MKS)记录信号.称取约0.05 g 的催化剂样品,首先在流速20 mL/min 的20%O2-80%He 气氛中以10 ℃/min速率升温至400 ℃处理1 h,随后降温至30 ℃.温度稳定后,切换成He气,吹扫15 min,待基线稳定后以10 ℃/min的升温速率加热至900 ℃.
1.2.5 对N2O分解反应的催化性能评价 样品催化氧化亚氮(N2O)分解反应的测试采用常压固定床装置.反应原料气为10%N2O-90%Ar.石英管中装入一定量的催化剂样品并加入1.0 g石英砂稀释.通入15 mL/min的原料气,程序升温测试催化剂的活性.
N2O的转化率(XN2O,%)由下式计算:

式中:FN2O,in和FN2O,out(mol/min)分别为原料气和尾气中N2O的摩尔流量.
粒子催化剂的本征反应活性(TOF)由下式计算:

式中:nN2O(mol/s)为单位时间t内转化的N2O 的摩尔数;mcat(g)为催化剂用量;WIr(%)为Ir 的负载量;MIr(g/mol)为Ir的摩尔质量;DIr为Ir的分散度,其中单原子的分散度为1,粒子的分散度通过粒子的尺寸由下式计算:
式中:g是与颗粒形状相关的系数,对于球形颗粒,g值为6;d(nm)是纳米粒子的平均尺寸;ρIr(g/nm3)是Ir的密度;σ(nm2/atom)是Ir原子的表面积;NA是阿伏伽德罗常数,为6.02×1023.
2 结果与讨论
2.1 单原子和纳米催化剂的形貌表征
前期研究[16]发现,采用高温捕获法可以制备高热稳定的单原子催化剂.IrSAC/MA 样品的球差电镜表征结果表明,Ir全部以单原子形式分散[图1(A)和(B)].随后,采用乙二醇还原的方法制备了Ir纳米溶胶,并分别在MA和IrSAC/MA上负载了0.45%(质量分数)的Ir纳米溶胶,制备得到IrNP/MA纳米粒子催化剂和同时负载有Ir 单原子和Ir 纳米粒子的IrSAC+NP/MA 催化剂.图1(C)~(F)分别是实际负载量(质量分数)为0.45%和0.9%的IrNP/MA 和IrSAC+NP/MA 催化剂.在低倍电镜下,IrNP/MA 和IrSAC+NP/MA 样品上Ir纳米粒子的平均尺寸均(Dm)在1.2 nm左右.在高倍电镜下,IrSAC+NP/MA样品上同时分布有大量的Ir单原子,紧密围绕着Ir纳米粒子,而IrNP/MA上却鲜有Ir单原子出现.

Fig.1 STEM images and size distributions(insets)of IrSAC/MA(A,B),IrNP/MA(C,D)and IrSAC+NP/MA(E,F)
2.2 单原子和纳米催化剂的结构表征
通过CO-DRIFTs测试探究了Ir/MA催化剂上Ir物种的电子性质以及CO吸附行为.如图2所示,低温还原的IrSAC/MA 单原子样品上没有检测到CO 的吸附峰,说明Ir单原子在室温下不能吸附CO,这可能与Ir 单原子较高的氧化态以及较为饱和的配位环境有关[17].在IrNP/MA 样品上检测到了位于2071和1995 cm‒1处的吸附峰,可归属于CO在Irδ+上的孪生吸附峰[18,19].此外,还检测到了2045 cm‒1处的吸附峰,可归属于CO 在Ir 上的线式吸附峰[20,21].在IrSAC+NP/MA 样品上,CO 在Ir 上的吸附量出现了显著提高,并且出现了位于1876 cm‒1处的桥式吸附峰,说明单原子的存在会改变纳米粒子的吸附性能,由此改变纳米粒子对反应物和产物的吸附/脱附能力.

Fig.2 CO⁃DRIFTs spectroscopy of IrSAC/MA(a),IrNP/MA(b)and IrSAC+NP/MA(c)
随后,利用XPS对Ir催化剂上Ir物种的化学态进行了表征.如图3所示,在IrSAC/MA单原子催化剂上,Ir 物种主要以Ir2+和Ir4+的形式存在,而氧化态的Ir 对CO 吸附较弱,与红外结果相吻合.这也说明,N2O 的解离主要发生在低价态的Ir 物种上.在IrNP/MA 纳米粒子催化剂上,存在金属态的Ir(约占49%)和部分氧化态的Ir2+(约占51%);在IrSAC+NP/MA催化剂上则存在着3种价态的Ir 物种:Ir4+,Ir2+和的Ir0占比分别为18.8%,47.1%和34.1%(表1[22,23]).显然,IrSAC+NP/MA催化剂上Ir4+物种来源于Ir单原子,而Ir0物种则全部来源于纳米粒子.根据拟合结果可知,引入Ir 单原子后,Ir0物种在Ir 纳米粒子上的实际比例从49.2%增加到68.2%,说明Ir 单原子的存在改变了Ir 纳米粒子的电子结构,这与CO-DRIFTs结果中CO吸附量的增加相吻合.

Fig.3 Ir4f XPS spectra of IrSAC/MA(a),IrSAC+NP/MA(b)and IrNP/MA(c)
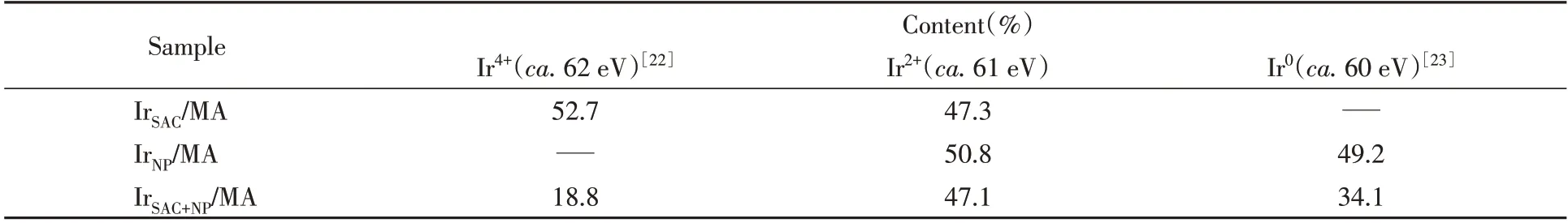
Table 1 XPS analysis of Ir4f on IrSAC/MA,IrSAC+NP/MA and IrNP/MA
2.3 单原子和纳米催化剂之间的协同催化
N2O是汽车尾气的成分之一,是一种严重的温室气体,其全球变暖潜能值比CO2高310倍[24].催化N2O分解为N2和O2被认为是最直接和环境友好的技术手段[25].利用N2O分解反应考察了不同分散形式的Ir/MA 催化剂的催化性能.如图4(A)所示,在催化N2O 分解反应中,IrSAC/MA 和IrNP/MA 催化剂上的N2O全转化温度(T100)分别为800和700 ℃,说明Ir纳米粒子比Ir单原子具有更高的活化N2O的能力.将两个催化剂进行物理混合,其全转化温度T100下降至600 ℃.而在单原子和纳米粒子共存的IrSAC+NP/MA催化剂上,反应的T100进一步下降至550 ℃,表现出了显著优于IrSAC/MA和IrNP/MA的催化活性.

Fig.4 Catalytic performance of N2O decomposition over IrNP/MA,IrSAC/MA and IrSAC+NP/MA catalysts(A)and N2O decomposition over 50 mg IrNP/MA and 25 mg IrSAC+NP/MA catalysts(B)
为了更直观地表现IrSAC+NP/MA和IrNP/MA催化剂活性的差别,减少了IrSAC+NP/MA在反应中的用量,将金属Ir的含量与IrNP/MA保持一致.如图4(B)所示,在低温段(<450oC)IrSAC+NP/MA和IrNP/MA的转化率相近,但是在高温段(>450oC)IrSAC+NP/MA 明显高于IrNP/MA 催化剂.根据式(3)计算催化剂上Ir 物种的分散度和本征反应活性TOF.从表2 可知,在单一分散形式的催化剂上,Ir 单原子的本征活性很低,在350 ℃几乎没有产物生成.相比之下,Ir纳米粒子表现出了很高的反应活性,在350 ℃时TOF值达到了0.053.在复合催化剂上,Ir物种的平均TOF值为0.078,同时高于Ir单原子和Ir纳米粒子.随后收集了3个样品的催化反应动力学相关数据.表2还给出了3个样品的表观活化能.可以看出,Ir单原子的活化能最高,为112.2 kJ/mol.Ir 纳米粒子和复合催化剂上Ir 的表观活化能相近,说明反应的路径相似,反应速率的增加则与指前因子有关.在复合催化剂上指前因子变大,意味着反应中的动态活性位点数量增多.

Table 2 Kinetic analysis of IrSAC/MA,IrSAC+NP/MA and IrNP/MA
根据文献[26]可知,N2O分解反应中,O2从催化剂表面脱附的过程是反应的决速步骤.由于单原子催化剂本身在该温度下对反应没有表现出反应活性,因此,单原子的存在可能有助于改善纳米粒子氧脱附能力,从而快速释放出反应活性位点.因此,采用程序升温脱附实验评价了不同催化剂上O2的结合能.在图5 中,位于400 ℃的峰可归属于分子O2从催化剂表面的脱附,800 ℃的峰归属于IrOx分解产生的O2.可以看到,O2分子在IrSAC+NP/MA上的脱附温度要低于IrNP/MA,表明,在单原子调节下,O2更容易从纳米颗粒上脱附,说明单原子和纳米颗粒之间的协同作用是提高催化剂氧脱附能力的关键.
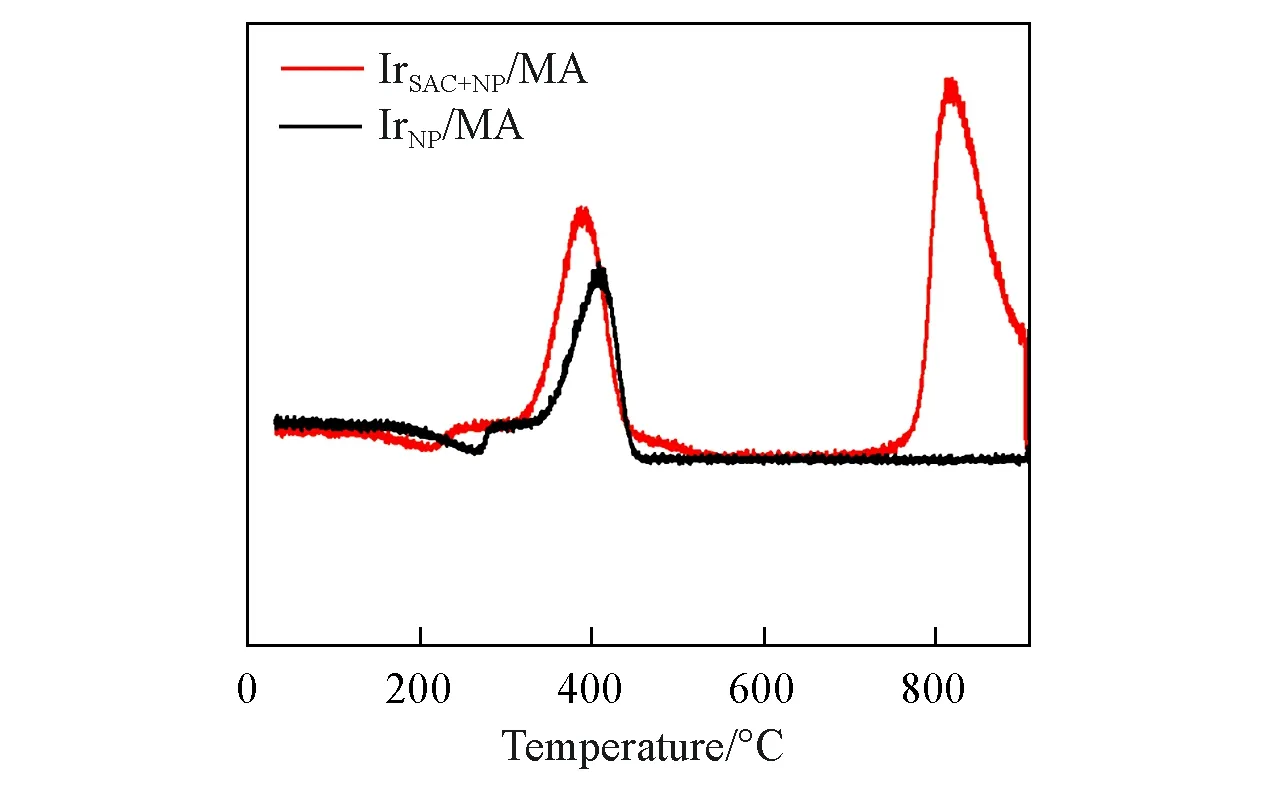
Fig.5 TPD profiles of O2 on IrNP/MA and IrSAC+NP/MA
3 结 论
通过比较纳米催化剂IrNP/MA以及与单原子混合存在的纳米催化剂IrSAC+NP/MA在反应中的活性,发现IrSAC+NP/MA催化剂具有更高的N2O催化分解活性.进一步的研究表明,金属态的Ir是催化N2O分解的反应活性位点,而单原子主要以Ir4+和Ir2+的形式存在.虽然Ir 单原子并不具有活化N2O 的能力,但是Ir单原子的存在可以改变Ir纳米粒子的电子结构和吸附性能,促进O2从Ir纳米粒子上脱附,由此提高Ir纳米粒子的催化活性.

