单原子材料在电化学生物传感中的研究进展
江博文,陈敬轩,成永华,桑 微,寇宗魁
(武汉理工大学材料复合新技术国家重点实验室,武汉 430070)
健康实时监测系统能通过生物传感实时跟踪分析人体的生理病理信息,该系统有可能增强不同应用领域的医疗保健服务,在健康诊断、早期症状检测和疾病快速筛查等方面具有显著优势[1].在新冠肺炎病毒(COVID-19)大流行之际[2,3],在没有开发特效药之前,对病毒等生物目标分子的实时检测非常重要[4].目前,对病毒的检测主要使用实时荧光定量聚合酶链式反应(PCR)和免疫学(试纸和酶联免疫吸附测定)的方法[5,6],但是这两个方法都无法到达对单个生物分子的检测水平,导致检测结果常出现假阴性(即患者体内有病毒,但是因为载量过低而难以检测).如图1(A)所示,检测血液或唾液中感染的细菌或者病毒,需要检测的灵敏度达到10−17~10−14范围内,即为pmol以下,这已超过现有多种检测灵敏度(10−12~10−9,pmol~nmol 水平)100倍以上[7],所以难以实现超低浓度生物分子的准确检测.鉴于此,快速检测超低浓度的生物分子成为目前生物检测中亟需解决的关键问题[8~10].

Fig.1 Applications of bacterial detection(green),viral targets(purple),and cancer biomarkers(blue: circulating tumor cells,red: protein biomarkers,orange: circulating nucleic acids)(A)[7],a portable sensing platform using an all⁃in⁃one screen⁃printed electrode(SPE) and a hand⁃held commercial potentiostat(PalmSens)(B)[12]
电化学生物传感器是一种将外界探测到的生物信号转换成电信号的装置[图1(B)][11,12],其主要是由换能器与探针组成[13].电化学生物传感器的原理主要是通过在探针上负载生物识别元件(如生物酶、抗原和抗体等),当生物识别元件与特定的生物分子接触时,其生物信号会通过换能器转变成电信号(如变化的电流、电压或电阻等),从而实现对生物分子定性定量的检测.同时,电化学传感还具有专一性强、分析速度快、准确性高、操作简单等优势[14~16],但受限于生物酶较差的稳定性和高成本[17,18],阻碍了电化学传感器的商品化.如何实现高的选择性和灵敏性是电化学生物传感器面临的关键挑战之一.
随着纳米材料与表征技术的不断发展,人们已经将研究领域聚焦到原子级别,2011年,张涛课题组[19]首次提出“单原子催化剂(Single-Atom Catalysis)”的概念,并成功制备了可以极大提高贵金属利用率的Pt1/FeOx单原子材料(SAM).SAM具有单一的电子轨道与原子结构,这使其具有媲美于生物酶的统一活性位点[20],此外,SAM相比于普通催化剂还具有很多其它优势(理论上百分百的原子利用率[21]、不饱和配位环境[22]、量子尺寸效应[23]和独特的电子云分布[24]),使得SAM具有高原子经济性、高活性与高选择性[25].单原子的统一活性位点使其拥有媲美于生物酶等的选择性,可以替代生物元件负载在电极表面,当化学环境统一的单原子与特定的生物底物接触时,其单原子的电子轨道会发生显著的改变,通过换能器将生物信号转换成电信号并放大[26],突破材料上的灵敏性与选择性极限的同时,兼备优异的稳定性.单原子探针将有望极大地提高对底物的检测灵敏度,放大生物传感信号,并有望超过目前现有检测灵敏度两个数量级以上,同时大幅缩短检测样品的用量与时间,实现高通量的健康实时监测分析.
研究表明,均一的单原子配位结构是实现其高选择性电化学传感的先决条件[22].本文综合评述了常见的合成均一配位结构SAM的方法,并重点介绍了SAM在电化学生物传感上的应用.最后,展望了SAM在传感领域的发展前景,并对该领域未来的发展方向和面临的挑战进行了广泛概述.
1 均一配位结构单原子的合成方法
在SAM的合成中,大多数合成策略是通过物理或化学限域效应来获得单原子,但合成过程中单原子团聚的现象仍不可避免,导致难以实现高负载单原子,因此需要调控其局域配位结构从原子尺度限制单原子的团聚.同时,为了实现高的生物分子监测选择性,需要构筑具有均一配位结构的SAM,从而获得统一的活性中心[27].因此,本文重点总结了均一配位结构单原子合成方法的最新研究进展.
1.1 配位优选法
配位优选法利用金属离子配合物,通过其强大的配位环境在热解过程中将金属固定,避免SAM在高温下聚集而导致失活.同时金属原子与杂原子之间的配位方式决定了热解产物的原子结构,从而获得均一配位环境的SAM.2016年,Li等[28]利用金属-有机框架(MOF)载体,将Co与Zn双金属进行负载并热解,在N2气氛下进行退火处理,MOF的热解可以生成N掺杂的多孔碳,得到了一种稳定的Co-N4配位环境的Co SAM,同时Zn原子的引入可以有效调控Co原子间距,并阻止Co原子的团聚,Co SAM的负载量高达4%.研究发现,随着温度的升高,一定数量的Co—N键断裂,从而得到另一种Co-N2配位环境的Co SAM.此外,Mn原子同样可以得到类似Co-N4的稳定配位环境,2018年,Wu等[29]采用两步掺杂和吸附法,成功地增加了三维(3D)碳颗粒中原子分散和氮配位Mn-N4的密度.首先,将锰掺杂的ZIF-8前驱体碳化,然后用酸溶液清洗,以制备具有最佳氮掺杂和微孔结构的部分石墨化碳主体.其次,额外的Mn 和N 源被吸附到3D 碳主体中,然后进行热解,以产生更高密度且均一的Mn-N4活性中心[图2(A)].除金属Co与Mn外,其它金属同样可以实现类似氮配位结构,2019年,Yang等[30]通过将多种金属阳离子与1,10-菲咯啉络合,再将所得金属配合物与商业炭黑共混,煅烧,成功合成了分布均匀且化学环境统一的Ni,Fe,Cr,Cu,Zn,Ru,Pt或它们组合的SAM,该方法主要是利用金属配合物会在炭黑表面形成“类卟啉”的稳定氮配位结构,从而防止了单原子团聚失活,该策略实现了单原子的通用合成和量级生产.
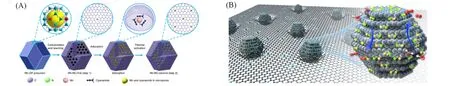
Fig.2 Schematic of atomically dispersed Mn⁃N4 site catalyst synthesis(A)[29],schematic illustration of WCx⁃FeNi catalyst consisting of Fe and Ni atoms stabilized on WCx nanocrystallites(majority component)surrounded by carbon sheets(B)[31]
虽然上述氮配位结构的SAM具有很高的稳定性,但强配位环境极大影响了金属单原子中心的电子环境,从而导致它们的催化活性降低.因此,Li等[31]利用含有茶酚和氨基的有机小分子作为多种金属盐的键合单元与Fe,Ni,离子组装,获得了结构均匀的金属有机配位杂化前驱体材料,再通过调控热处理条件,获得了基于金属基碳化钨纳米晶体,并且具有非氧、氮、硫等杂原子强配位的Fe,Ni,FeNi单原子催化剂[图2(B)],其实现了Fe和Co双金属单原子的高效负载及双金属中心的协同催化作用,并展现了优异的析氧反应(OER)性能.
1.2 自限反应原子层沉积法
原子层沉积(Atomic layer deposition,ALD)是一种用于薄膜生长的气相催化剂合成技术[32].ALD技术主要是将气相前驱体脉冲交替通入反应器[33],并将其吸附在具有表面官能团或具有高能表面载体缺陷位点上的方法,其利用前驱体分子之间的空间位阻和前驱体分子与载体之间的自限反应,进行单原子化学环境的精确调控(如实现对双核单原子位点的调控).2017年,Yan等[34]通过ALD将Pt原子沉积到具有丰富酚或苯羰基对的石墨烯载体中[图3(A)],并成功获得了具有双Pt同源的双金属活性位点催化剂,两个Pt中心之间的平均距离约为0.3 nm,双Pt催化剂对氨硼烷制氢表现出超高的活性和稳定性.ALD可以实现同源双核SAM的制备,还可以实现异源双核SAM的制备.2019年,Zhang等[35]通过ALD,在氮掺杂的碳纳米管上将单分散的Pt原子均匀分散在载体上.随后,在270 ℃下,使用双(乙基环戊二烯基)钌(II)作为前驱体,选择性地将Ru 原子沉积在Pt 单原子上,成功制备了Pt-Ru SAM[图3(B)],这种Pt-Ru键合的结构在析氢反应上展现出了优异的催化性能和稳定性;此外,ALD 循环次数和沉积温度同样可以实现不同负载量、形貌、尺寸、密度的单原子催化剂的合成,Xu 等[36]通过ALD技术,将高度分散的SAM Pt和Pt纳米团簇沉积到Fe改性的KL沸石上,在Pt ALD中,获得的催化剂称为PtFe-n/KL(n=1,2 或3),具体取决于Fe ALD 循环的次数.PtFe-1/KL 对于正庚烷芳构化表现出较高的稳定性和优异的催化性能(芳烃选择性达到90.1%).
Fig.3 Schematic illustration of bottom⁃up synthesis of dimeric Pt2/graphene catalysts(A)[34],schematic illustration of ALD synthesis of Pt⁃Ru dimers on nitrogen⁃doped carbon nanotubes(B)[35]
1.3 离子交换法
离子交换法是利用金属离子活性中心交换的过程,在保持原有基体骨架不变的基础上,控制催化剂材料的尺寸、形状、成分与内部结构的一种合成策略[37].根据离子交换的驱动力,可分为溶液离子交换、高温离子交换和电化学离子交换.2017 年,Pardo 等[38]利用溶液离子交换将MOFs 中的Mg2+和Cu2+离子转化为更稳定的Ni2+和Cu2+离子,而后用[Pd(NH3)4]2+交换部分Ni2+离子,并用NaBH4还原得到最终化合物Pd4-MOF[图4(A)],其在卡宾介导的重氮乙酸盐反应中优于其它金属催化剂,产率高于90%;2018年,Pardo课题组[39]继续采用溶液离子交换并用NaBH4还原的方法得到Pd2-MOF,其在低温催化CO2加氢制备甲烷的反应中表现出优异的性能.2020年,Zhou等[40]提出了一种高温阳离子交换策略,其依赖于硫化物和富氮聚合物壳层的阴离子框架,在高温过程中,阴离子框架会在碳化过程中产生富S和富N的空位,低沸点的母体金属Cd升华的同时,Cu原子再迁移到碳骨架上的空位中,并产生边缘双修饰Cu催化剂[图4(B)],S和N双修饰进一步促进了交换金属Cu物种的稳定.实验和理论结果均表明,在室温下苯的催化羟基化反应中,精确获得的S,N双修饰Cu位具有高活性和低反应能垒.2022年,Xiao等[41]开发了一种原位电化学驱动阳离子交换方法,其利用电化学对金属原子的氧化还原制造空位缺陷,成功使Ru单原子填充MnO2中的阳离子空位,并保留基体骨架.这种获得的催化剂表现出比商业RuO2高44倍的催化活性,并具有优异的稳定性.

Fig.4 Schematic illustration of the formation of Pd4⁃MOF catalyst(A)[38],scheme illustrating the proposed formation mechanisms of Cu SAM(B)[40]
2 单原子材料在电化学生物传感中的应用
SAM具有完全暴露的原子活性位点、特殊电子结构和不饱和配位环境等特性,在电催化、光催化和生物催化等领域已展现出十分优异的催化活性、选择性和稳定性[25,42].在电化学生物传感领域,与传统纳米结构材料相比,SAM在实现高效传感信号放大方面具有更大的优势.通过介绍近年来SAM在电化学、电化学发光和其它生物传感方式中的应用(表1)[43~54],对未来高灵敏、高选择性电化学生物传感材料的发展进行了展望[55,56].
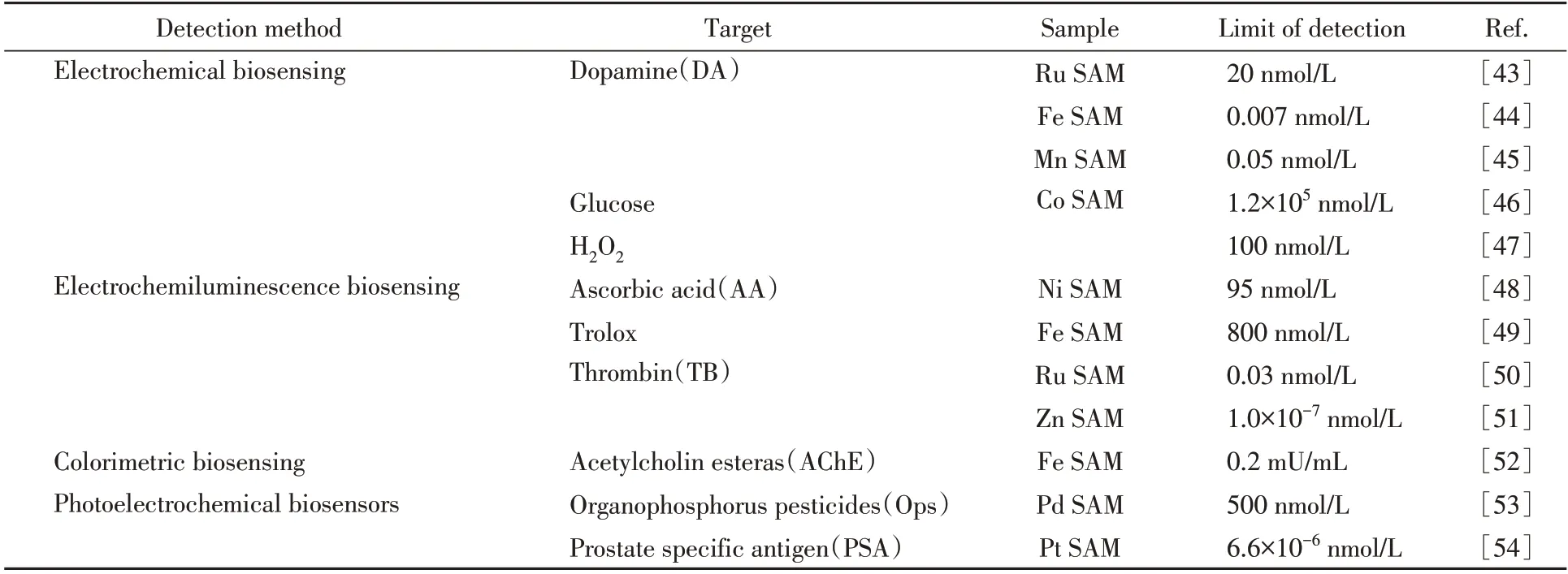
Table 1 Summary of single-atom materials biosensing
2.1 在电化学生物传感中的应用
单原子电催化剂具有独特的结构优势,在电解水、CO2还原和N2还原等领域得到了广泛的应用[57,58].传统的电化学生物传感通常利用生物酶、抗原和抗体等生物材料作为探针,导致其存在对温度敏感,只能在有限温度范围内进行检测;其次是寿命短,在应用环境极端恶劣情况下,难以长时间保持检测的准确度.随着纳米材料和表征技术的不断发展,已研发出一些单原子电催化剂与识别、电子元件结合集成的电化学生物传感器,可用于增强传感检测信号[59].这些电化学生物传感器不仅可提高电化学生物传感的使用寿命,同时还具有操作简单、灵敏度高、经济等优点,在识别金属离子、小分子、蛋白质和DNA检测领域具有广泛应用[60].
多巴胺(DA)是人体内一种重要的神经递质生物分子,能够在肾脏、心血管和中枢神经系统中传递兴奋和幸福的信息,在许多生理、病理方面起着至关重要的作用,因此实现对DA的高灵敏检测意义十分重大[60,61].二维(2D)材料常用于对DA的传感检测,在2D材料上合成单原子有利于提高传感的灵敏度.Xie等[43]报道一种在片状结构光滑表面上生长出单原子钌(Ru-Ala-C3N4)的方法,其结构与2D石墨烯结构类似[图5(A)],具有完美的仿生酶活性,可对DA进行高灵敏、高选择性的电催化生物传感检测[图5(B)和(C)].在60~4.9×105nmol/L线性浓度检测范围内,具有20 nmol/L相对较好的检测限度.Jin 等[44]通过一步热解法在石墨烯上合成了以Fe-N5为活性中心的单原子催化剂(Fe-N5SAM),可用于DA电化学生物传感检测.Fe-N5SAM呈2D褶皱层状,具有丰富的活性中心和独特的电子结构,有利于提高电催化中的电子转移.研究发现,以Fe-N5SAM构建的电化学生物传感器在人体血清中进行DA检测,具有高灵敏、良好的线性范围和检测下限的响应能力,并能稳定回收[图5(D)和(E)].在5~5×105nmol/L线性响应范围内,DA的检测下限能达到0.007 nmol/L,有望实际应用于人体血清中.
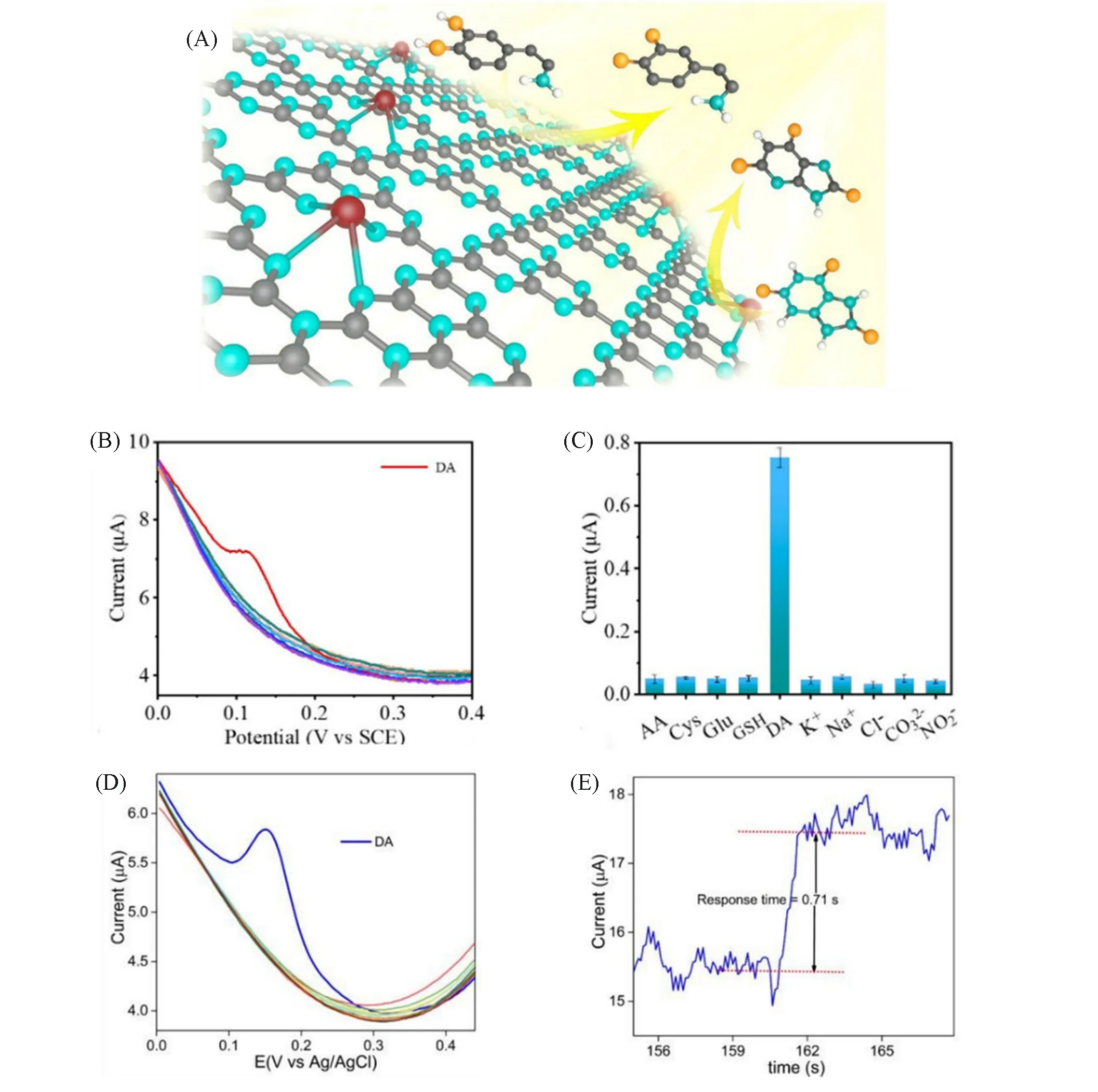
Fig.5 Schematic diagram of structural single⁃atom Ru catalyst(A),selectivity of Ru⁃Ala⁃C3N4/GCE toward DA(B,C) [43],differential pulse voltammetry(DPV) selectivity test of the GCE/Fe⁃N5 SAM sensor toward DA(10.0µmol/L)having 1000 nmol/L of other biological,cations and anions in the solutions(pH=7.4)(D)and response time of the GCE/Fe⁃N5 SAM sensor towards DA(E)[44]
Ebrahimi 等[45]和Huang 等[62]都报道了一种通过Mn 掺杂的MoS2纳米片合成的Mn-MoS2单原子催化剂,实现超灵敏电化学传感检测DA.与单一MnS2相比,Mn-MoS2的电荷转移能力更强,灵敏度比前者提高4 个数量级.其中,Mn 原子主要以取代Mo 原子(MnMo)和吸附在Mo 原子顶部(MntopMo)两种结构形式存在[图6(A)].相比较而言,MnMo比MntopMo更稳定,并且前者数量是后者的2倍.在对DA进行吸附氧化过程中,MnMo对DA是物理吸附,MntopMo对DA是化学吸附[图6(A)].由于化学吸附难以转移空穴对DA 进行氧化,因此MnMo更易转移空穴,氧化DA.Mn-MoS2单原子催化剂在缓冲溶液中检测限度为0.05 nmol/L,在10%血清中的检测限为5 nmol/L,在人工汗液中的检测限为50 nmol/L[图6(B)~(D)],可实现DA的检测.单独使用信号监测传感器(如晶体管等)难以准确灵敏地进行脑神经活体的电化学监测,通过与合成的SAM相结合而设计出的高灵敏生物传感器,可以实现对脑神经活体的电化学高效监测.Hou 等[46]研究出一种用于生理相电化学传感的SAM,他们在氮掺杂碳衬底上合成出以Co-N4为活性中心分散的Co单原子催化剂(Co SAM),对葡萄糖等生理相关化学品进行检测[图7(A)].由于Co SAM 对H2O2具有独特的电化学活性,而H2O2可以催化促进葡萄糖氧化酶氧化葡萄糖.因此,Co SAM可以以葡萄糖氧化酶作为识别单元,进行电化学信号放大,建立起电化学葡萄糖生物传感器,用于监测大脑中葡萄糖的含量[图7(B)].此外,Co SAM还可以基于其它氧化酶来设计生物传感器(如中枢神经系统中乳酸、谷氨酸等化学物质进行活体生物传感),为脑化学高精度活体分析提供一种新的方法.
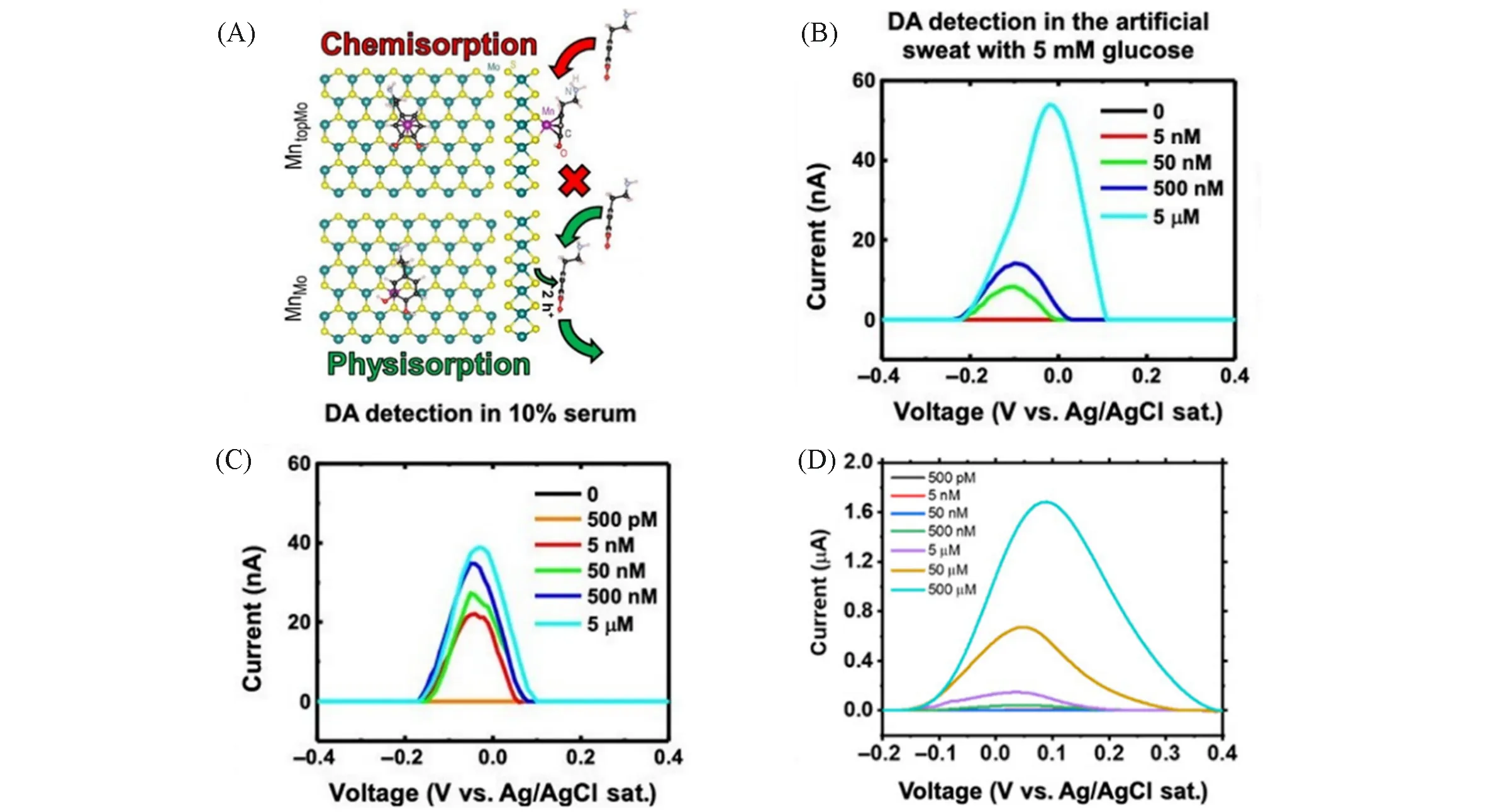
Fig.6 Top and side views of DA interacting with MntopMo(neutral defect) forming a chemical bond and DA adsorbed(physisorbed) on MnMo(A),the detection of 500 nmol/L DA in artificial sweat containing 5000 nmol/L glucose(B),10%serum in PBS using Pt CE and Ag/AgCl RE(C)and PBS(D)[45]
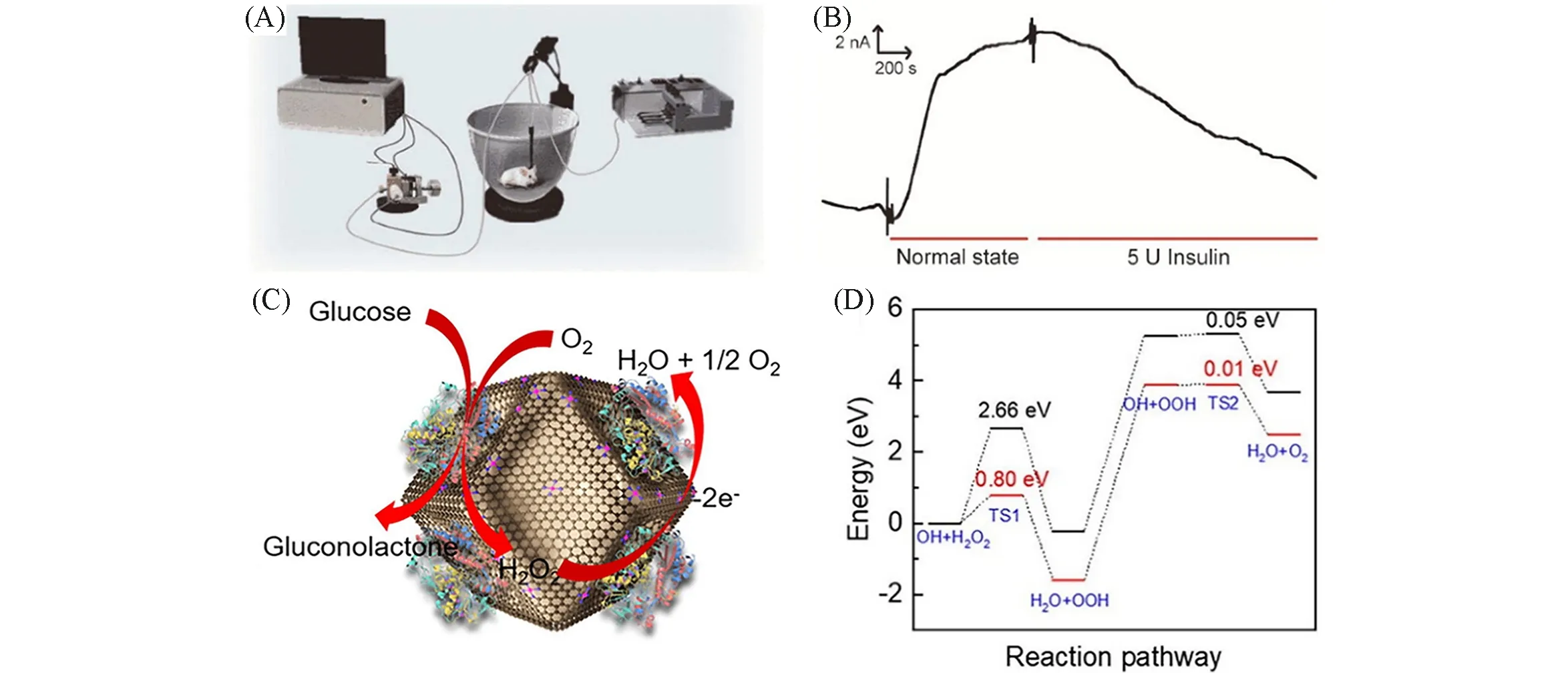
Fig.7 Schematic of online electrochemical system(OECS) with the GOx/Co⁃SAM⁃based biosensor for continuous monitoring of glucose in the brain of rats(A),typical amperometric responses of the OECS toward the microdialysate sampled from rat striatum under normal state and after intra⁃peritoneal injection of 5 U insulin(B)[46],the oxidation of glucose at the concave⁃shaped Co SAM&GOx modified gate electrode(C),free energy diagrams for H2O2 oxidation reaction on concave⁃shaped Co SAM(red line)and pyrolyzed ZIF⁃8(black line)(D)[47]
在诊断糖尿病方面,开发高灵敏性能的葡萄糖传感器也十分重要.传统葡萄糖手指穿刺检测存在灵敏度低、选择性和稳定性差等问题.Xiong等[47]也采用Co作为单原子活性中心,将合成的衬底换成凹面氮掺杂碳骨架.在凹面氮掺杂碳上合成出以CoN4为活性中心分散的单原子材料(Co SAM),其比平坦衬底上的Co 原子具有更高的电催化活性[图7(C)].通过理论计算研究了Co SAM 对H2O2氧化过程,发现其氧化过程遵循Eley-Rideal 机制,并且明显降低了第一步氧化脱氢的势垒[图7(D)],表明Co SAM对H2O2氧化更有利.因此,通过Co SAM对葡萄糖传感过程中产生的H2O2氧化痕量进行检测,实现了比无催化剂传感器件的灵敏度高出1000倍的限制,拓展了SAM生物传感器件在糖尿病诊断和医疗检测的应用范围.
2.2 在电化学发光生物传感中的应用
电化学发光(ECL)是一种结合电化学和光致发光的新型分析方法,其本质是一种在电极表面产生的活性物质通过高能电子转移转化为激发态发光的发光技术,这种技术克服了单一传感的限制.传统光致发光生物传感的分析技术不足,背景噪声大.但电化学发光生物传感可实现高重复性和准确性的启动和调节传感过程,这种方法对于被检测物的精确检测更具有优势.此外,电化学发光生物传感器还具有响应速度快、操作过程简单、无需外加光源和精准电位控制等优点[59,63].在传统的H2O2-luminol ECL体系中,H2O2在室温下易分解,难以定量分析.虽然O2-luminol ECL体系有更高的稳定性,但ECL反应效率很低.纳米材料作为共反应促进剂可以有效地提高O2-luminol ECL 体系的催化能力,从而提高ECL的反应效率.然而,由于金属纳米颗粒结构的复杂性,很难确定其确切的活性中心和区分催化机理[64].为了克服这些限制,采用具有活性中心均匀分布的SAM,能更好地对检测分子进行定量分析和提高对生物传感的灵敏精确度[30,65].

Fig.8 Two carbon⁃supported nickel SAM with the active centers of Ni⁃N4(Ni⁃N4/C)and Ni⁃N2O2(Ni⁃N2O2/C)(A),ECL intensity of the modified GCE with C,C⁃N,Ni⁃N4/C,and Ni⁃N2O2/C(B),selectivity of the de⁃veloped Ni SAM luminol ECL sensor(inset: linear relationship between AA concentration and ECL intensity)(C)[48],the mechanism of luminol⁃O2 ECL systems with Fe⁃N⁃C SAM as coreactant accelera⁃tor(D),the varied ECL signal with Trolox concentration in the range of 800—106 nmol/L(E),the linear relationship between the Trolox concentration and ECL peak intensity(F)[49]
利用碳基材料(如石墨烯和掺氮碳纳米管等),制备成的传感器直接检测抗坏血酸(AA)存在灵敏度和选择性低的局限性,通过在这些基底上合成金属单原子可实现对AA 的高灵敏生物传感.AA 是一种优良的抗氧化剂,对坏血病、尿石症和腹泻等医学诊断起着重要作用,因此实现对AA高灵敏检测十分重要[66].Gu 等[48]设计制备出在氮掺杂碳基底上具有两种单原子Ni 活性中心的SAM,其分别以Ni-N4(Ni-N4/C)和Ni-N2O2(Ni-N2O2/C)为活性中心分布[图8(A)].该研究发现,这两种单原子结构能够高选择性地将O2激活转化为活性氧(ROS),并且增强O2-luminol ECL体系的信号[图8(B)],由于AA能够消除ROS,会影响到ECL 的发射,从而实现对AA 的检测.AA 浓度与ECL 强度在350~70000 nmol/L范围内呈线性关系,检测限度为95 nmol/L.此外,在检测AA时,添加电解质、氨基酸等其它杂质未对ECL有明显影响,对AA检测具有良好的选择性[图8(C)].因此,使用Ni SAM在O2-luminol ECL系统传感中具有应用潜力.Zhu等[49]研发出一种在氮掺杂碳基底上合成以FeN4为活性中心分散的单原子催化剂(Fe-N-C SAM),其也可高选择性地将O2激活转化为ROS[图8(D)].与不添加催化剂的玻碳电极(GCE)、氮掺杂碳修饰电极和Fe3O4相比,Fe-N-C SAM修饰的电极具有更大的ECL信号强度.通过使用异丙醇和苯醌来验证Fe-N-C SAM 修饰的电极在O2-luminol ECL 体系中的活性中间体,证实了Fe-N-C SAM增强了ECL发射强度.对Trolox抗氧化剂进行检测时,在800~106nmol/L范围内呈线性响应,表现出对抗氧化剂较好的检测能力[图8(E)和(F)].
在MOF上负载明确位置的单原子,也可以将其视为一种特殊的SAM,并且进行ECL分子功能化,可以用于ECL 生物传感[67~69].Huang 等[50]开发出一种新颖的、带有分层孔壳的空心分层MOF(HH-UiO-66-NH2),进一步将Ru-(bpy)2(mcpbpy)2+作为配体中心,负载到HH-UiO-66-NH2载体上{bpy=2,2′-联吡啶,mcpbpy=4-(4′甲基-[2,2′-联吡啶]-4-基)丁酸},得到HH-Ru-UiO-66-NH2[图9(A)].HH-UiO-66-NH2的中空空腔和介孔壳不仅提高了负载能力,而且促进了电子和离子的快速扩散,以及框架内的协同反应,以提高发光体的利用率.通过使用HH-UiO-66-NH2制备成ECL生物传感探针,能够实现对凝血酶(TB)的高灵敏度和低限度生物传感检测[图9(B)和(C)].Fang 等[51]以沸石咪唑作为骨架连接锌原卟啉,生成了以ZnN4为活性中心,并且通过共价连接分散在ZIF-8 纳米颗粒表面(ZnP-NH-ZIF-8).ZnP-NH-ZIF-8在TB生物传感检测应用中具有优良的性能.与单独的ZnP和裸电极相比,制备的ZnP-NH-ZIF-8 在二氯甲烷和四正丁基高氯酸铵系统中表现出更好的氧还原反应催化动力学,ECL信号增强153倍.在结核适体和结核蛋白的选择性识别检测中,以ZnP-NH-ZIF-8制备的适体生物传感器展现出10−7~0.001 nmol/L的更宽的线性响应范围[图9(D)].
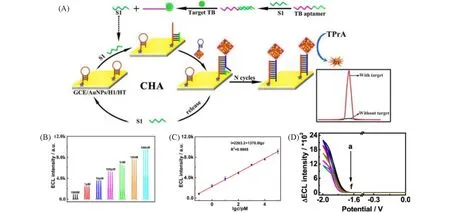
Fig.9 Diagram for construction of the HH⁃Ru⁃UiO⁃66⁃NH2 ECL aptasensor(A),ECL responses of different TB concentrations(B),calibrating plot for TB detection(C)[50],the ECL signals toward different TB concentrations of 10-7—0.001 nmol/L(D)[51]
2.3 在其它生物传感中的应用
比色生物传感方法是基于光学信号的生物传感器,其具有简单、成本低和灵敏度高的优势,通过视觉信号进行定量分析传感底物的含量,具有广阔的应用前景[70~72].比色生物传感的高灵敏度源自纳米酶的高选择性,而传统纳米酶存在活性中心密度低和元素分布不均匀两大问题,单原子纳米酶基于单原子活性中心集中,具有相同几何构型和电子结构,使其具有高活性和高选择性.利用单原子纳米酶所具有的特性来实现快速、高灵敏生物传感,已得到广泛使用[73].在氮掺杂碳基底中分散的金属原子-氮键位点的单原子催化剂(M-N-C SAM),具有与天然氧化酶(OD)、过氧化物酶(POD)、过氧化氢酶(CAT)和超氧化物歧化酶(SOD)等类似的催化活性,已成功用于比色生物传感中[74].
单原子铁具有类OD活性,可用于高效检测乙酰胆碱酯酶(AChE).Zhu等[75]发现以FeN2为活性中心的Fe-N-C纳米酶的类OD活性可以被疏基分子抑制[图10(A)].通过这一现象,实现对AChE和有机磷农药(OPs)的灵敏和选择性检测.在AChE催化下,将其水解为硫代胆碱,硫代胆碱可以阻断Fe-N-C纳米酶中的单原子铁,从而降低它们的OD活性.由于OPs对AChE活性的抑制,Fe-N-C纳米酶可以保持其OD活性,从而实现痕量OPs的灵敏比色生物传感检测.对于具有POD活性的单原子纳米酶也进行了深入研究[76,77].Guo等[78]开发一种FeN4-2B为活性位点的掺硼Fe-N-C纳米酶[图10(B)],与未掺杂的相比,掺硼的Fe-N-C纳米酶具有更高的POD酶活性、高温耐受性和选择性[图10(C)],理论推断是由于硼掺杂诱导电荷转移效应所导致.该单原子纳米酶可实现对AChE活性和相应的OPs进行高灵敏生物传感.关于Fe-N-C 纳米酶固有的POD 酶活性位点与电子结构的相关性研究,如Xu 等[52]在AChE和OPs的灵敏和选择性检测实验中,对以单原子铁为活性中心的金属-有机框架纳米酶(MIL-101)进行POD 活性的研究.他们将硝基和氨基两个相反电子调节官能团引入MIL-101 中,得到NO2-MIL-101 和NH2-MIL-101.结果表明,NO2-MIL-101 的POD 酶活性增强,而NH2-MIL-101 活性减弱.推断硝基官能化的NO2-MIL-101 纳米酶得到电子/几何构型的改善,优化了POD 酶活性.将NO2-MIL-101 用于AChE检测,发现其对OH*具有低反应能势垒,实现了0.2~50 mU/mL 范围内AChE 的高灵敏检测,并且也实现了对OPs的灵敏和选择性检测[图10(D)和(E)].

Fig.10 Schematic illustration of the inhibition of the oxidase⁃like activity of Fe⁃N⁃C SAzymes by mercapto molecules(A)[75],FeBNC SAzymes with similar single metal atom⁃based sites(B),the specific activi⁃ties(U/mg)of FeBNC SAzymes and Fe NC SAzymes(C)[78],schematic illustration of detecting AChE activity using a NO2⁃MIL⁃101⁃based biosensor(D),absorption spectra of NO2⁃MIL⁃101⁃based bio⁃sensor in the presence of different AChE concentrations(E)[52]
比色生物传感存在对颜色观察相对误差较大,待测物中存在其它有色物质无法进行检测等难以解决的缺陷,而光电化学免疫分析是一种基于抗原和抗体识别引起光活性纳米材料光电流变化的新型检测平台,可以避免比色生物传感的缺点.尽管具有不同结构、形态和元素的各种类型的纳米材料,已被作为光活性材料引用到光电化学免疫分析中,但大部分光活性纳米材料仍难以实现高效的光电转移,无法实现广泛的应用[79,80].具有光活性的SAM已受到光电化学免疫分析领域的广泛关注[81].光活性的SAM具有丰富的表面通道和独特的电子转移途径,已成为光电催化领域中的研究热点.虽然SAM在目前光催化领域具有极其突出的地位,但应用到生物传感仍处于初期阶段[82,83].
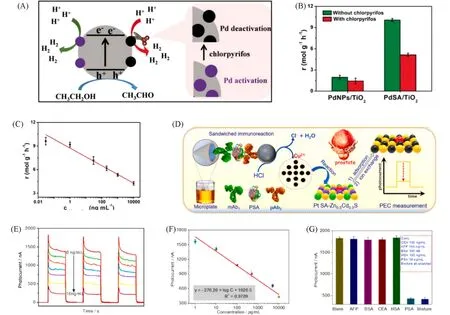
Fig.11 Principle of the PdSA/TiO2⁃based sensing platformutilizing photocatalytic H2 production(A),the inhibition behavior of chlorpyrifos on the photocatalytic HER performance of both PdSA/TiO2 and PdNPs/TiO2(B),the typically photocatalytic response of PdSA/TiO2 toward different concen⁃trations(0.03 ng/mL,1 ng/mL,30 ng/mL,200 ng/mL,1 mg/mL) of chlorpyrifos,10 mg/mL(C)[53],ion⁃exchange reaction between single⁃atom platinum⁃anchored Zn0.5Cd0.5S and the released copper ion(Cu2+)from CuO nano label(D),photocurrents of Pt SA⁃Zn0.5Cd0.5S⁃based photoelectro⁃chemical immunoassay toward different PSA standards(0,1,10,100,500,5000,and 10000 pg/mL)(E),calibration curve of Pt SA⁃Zn0.5Cd0.5S⁃based photoelectrochemical(PEC) immunoassay(F),specificity of Pt SA⁃Zn0.5Cd0.5S⁃based photoelectrochemical immunoassay(G)[54]
纳米生物传感器的使用虽在生物传感中取得了巨大进步,但仍存在信号输出缓慢、选择性低等瓶颈问题.目前,通过采用优异特性的SAM来建立生物传感器,实现了高选择性和高灵敏的快速信号传输.传统的OPs 毒死蜱检测方法通常需要繁琐的样品预处理和复杂的生物界面,给实时分析带来困难.Ge 等[53]在以TiO2为基底,使用钯金属单原子为活性中心,合成了PdSA/TiO2并作为光催化传感平台[图11(A)].利用OPs毒死婢可以明显地抑制PdSA/TiO2的光催化活性,从而实现对OPs毒死蜱高灵敏度和高选择性的检测.与PdNPs/TiO2相比,PdSA/TiO2光催化性能更好,在对毒死蜱的检测中具有更明显的光催化活性的抑制作用[图11(B)].使用Pd SA/TiO2用于光催化传感能够实现良好的线性检测关系,并且检测限度非常低,能达到500 nmol/L[图11(C)],为探索新型OPs生物传感提供了新方法.Li 等[54]构建了一种离子交换反应诱导的光电化学免疫传感器,合成了单原子铂锚定的Zn0.5Cd0.5S纳米结构(Pt SA-Zn0.5Cd0.5S),并对前列腺特异性抗原(PSA)进行灵敏定量检测.实验结果表明,Pt SA-Zn0.5Cd0.5S光电流显著提高,进一步提高了免疫分析灵敏度.在检测目标PSA时,通过CuO纳米颗粒为信号标签引入到免疫分析中,与酸反应放出的大量Cu2+与Pt SA-Zn0.5Cd0.5S进行离子交换反应,由于弱光活性物质CuxS 生成,导致其光电流猝灭,从而达到检测目的[图11(D)].在优化条件下,Pt SA-Zn0.5Cd0.5S 能够在3.0×10−5~3.0 nmol/L 范围内灵敏检测,且检测限度能达到6.6×10−6nmol/L,可作为早期抗原筛查和诊断的一种优质选择[图11(E)~(G)].
3 总结与展望
与传统的金属纳米粒子相比,具有原子分散活性位点、独特电子/几何结构和不饱和配位环境的SAM,已成功实现了生物传感的信号放大.尽管SAM在生物传感领域已取得了一些重要进展,但目前SAM传感仍然处于发展阶段,推进单原子生物传感发展仍然面临着一些需要解决的问题:(1)单原子化学环境的精确调控依然不足,化学环境高度统一的SAM对提高生物传感器的灵敏度至关重要,但目前对单原子精确调控的方法相对较少;(2)单原子产业应用需要实现大规模生产,但是,目前对单原子的合成还仅限于实验室阶段,难以进行大批量的单原子合成,阻碍了其基础研究和生物传感应用;(3)目前对SAM放大生物传感信号的机制研究较少,缺少单原子传感理论指导;(4)SAM生物传感检测的底物类型较少,只能检测几种类型的分析物.基于此,在未来单原子生物传感的研究中,可以从以下几个方面开展研究:(1)尝试设计全新的单原子合成策略,实现精确调控单原子的化学环境;(2)尝试利用更简单、可放大的合成方法,进行工业化单原子的合成;(3)利用先进原位表征技术和同步辐射,探索SAM信号的放大机制,从而设计高灵敏度的SAM生物传感器;(4)扩大SAM生物传感检测的底物范围,实现对具有应用潜力的目标底物的高灵敏检测.目前,SAM生物传感领域仍旧有较大的发展空间,期望本文能为SAM生物传感的进一步研究提供一些启发、经验和理论指导.

