敲除msn2对米曲霉生长和发酵产曲酸的影响
史亚楠 王德培,3 王一川 周昊 薛鲜丽,2
(1. 天津科技大学生物工程学院,天津 300450;2. 工业发酵微生物教育部重点实验室,天津 300450;3. 天津市微生物代谢与发酵过程控制技术工程中心,天津 300457;4. 日照金禾生化集团股份有限公司,日照 276899)
曲酸(kojic acid)化学名为5-羟基-2-羟甲基-1,4-吡喃酮,结构与葡萄糖相似,分子式C6H6O4,相对分子量142.11,纯品为无色柱状晶体,是具有还原性的有机弱酸[1-3],与三氯化铁反应呈特殊的红色[4]。曲酸具有抗菌性、抗氧化性以及抑制酪氨酸酶活性[5-6],在食品酿造、化妆品和医药领域占有重要应用价值。据调查国内现阶段曲酸需求量为500-600 t/年,而国内曲酸产量仅为200 t/年,进口曲酸价格昂贵。因此预测,未来曲酸将持续保持市场需求热度和较高的利润回报[7-10]。天然曲酸是来源于曲霉属利用糖类发酵产生的次级代谢产物,产曲酸菌集中于米曲霉(Aspergillus oryzae)和黄曲霉(Aspergillus flavus),而黄曲霉因可能产生黄曲霉毒素而被淘汰,米曲霉则成为发酵曲酸主要微生物。
msn2基因是编码C2H2锌指结构蛋白[11]的转录调节因子,发现于酿酒酵母中,之后在构巢曲霉和黄曲霉等多种丝状真菌均发现有同源基因,其编码蛋白可通过结合基因的启动子区域的STRE基序来调节压力响应基因表达[12-13]。当真菌细胞内msn2基因缺失后,发现其对高渗、高温、高盐、强光等极端环境的适应性显著下降。Chen等[14]对Msn2/4的下游靶基因进行了全面的研究发现,msn2/4突变株能够直接诱导编码抗氧化酶的基因表达,如sod1和sod2、prx1和tsa2。Chang等[15]敲除黄曲霉和寄生曲霉中msn2同源基因msnA,该基因缺失使菌株代谢的黄曲霉毒素量均有所提高,且曲酸产量分别提高4倍、29倍。
msn2自身转录活性受蛋白激酶A(protein kinase A,PKA)和雷帕霉素调控。在渗透压胁迫的状态下,转录因子Msn2被蛋白激酶HOG1磷酸化,从而结合到ctt1(编码胞质过氧化氢酶基因)和hsp12(编码热休克蛋白基因)启动子上,然后通过与RNA聚合酶Ⅱ全酶相互作用诱导转录。Msn2会激活YAP4表达,随后YAP4又激活gcy1、dcs2和gpp2转录[16],从而使蛋白酶、热激蛋白、其他与代谢平衡有关的基因和及生物分子的修复与清除相关的编码基因大幅度上调。曲酸是部分曲霉产生的次级代谢产物,具有易氧化特性,成为缓解细胞内活性氧压力的一种抗氧化物,所以msn2基因对于米曲霉产生曲酸可能有一定的调节功能。
本文以产曲酸的米曲霉3.042为出发菌株,利用基因工程手段敲除其msn2基因探讨该基因对米曲霉生长及合成曲酸的影响,挖掘该基因对米曲霉在不同渗透压和过氧化物存在下的调节功能,为进一步提高米曲霉曲酸的产量提供有意义的借鉴。
1 材料与方法
1.1 材料
本实验所用米曲霉A. oryzae3.042(CGMCC No.3.00951)菌株、米曲霉pyrG缺陷型菌株g-1和根癌农杆菌AGL1均由天津科技大学生物工程学院生化过程与技术研究室保藏。斜面培养基:CM培养基添加0.12%尿苷和0.12%尿嘧啶来传代营养缺陷型[17];初筛培养基:CM培养基添加100 μg/mL 氨苄、200 μmol/L头孢噻肟钠;复筛培养基:CM添加25 mmol/L过氧化氢。
1.2 方法
1.2.1msn2敲除质粒pk1的构建 以p40为出发质粒,米曲霉3.042基因组为模板,以各自引物扩增得到:msn2左侧上游同源臂msn2L,pyrG和msn2右侧下游同源臂msn2R。然后将p40和片段msn2L利用EcoR I和BamH I双酶切连接得到p40-msn2L,p40-msn2L和片段msn2R利用XbaI和Hind Ⅲ双酶切连接得到p40-msn2L-msn2R,将p40-msn2L-msn2R和片段pyrG通过KpnI和XbaI双酶切连接得到质粒pk1。并化转至大肠杆菌。以大肠杆菌菌液为模板验证pk1质粒敲除框全长。提取质粒送至华大公司进行基因测序比对。
1.2.2 根癌农杆菌侵染营养缺陷型菌株 将pk1质粒电转进农杆菌AGL1感受态细胞,按照文献所述方法孵育农杆菌[18],之后将农杆菌与米曲霉g-1新鲜孢子置于IM固体培养基上覆盖的硝酸纤维膜上,25℃避光共培养48 h。待共培养过后用无菌生理盐水将米曲霉孢子从膜上洗到初筛培养基上30℃培养60 h,再挑单菌落至复筛培养基30℃培养48 h,最后挑选转化子进行提取基因组验证。
1.2.3 敲除msn2基因的阳性转化子的筛选 待共培养过后用无菌生理盐水将米曲霉孢子从膜上洗到初筛培养基上30℃培养60 h,再挑单菌落至复筛培养基30℃培养48 h,最后挑选转化子进行提取基因组验证,分别以Yz-F1和Yz-R1验证敲除框(msn2LpyrG-msn2R)的全长,以Yz-F2和Yz-R2验证msn2L上游到pyrG中间部分。
1.2.4 孢子计数 分别将不同的新鲜米曲霉菌落,用同一打孔器取3个相同面积的菌落培养物,装入带有玻璃珠的无菌三角瓶内,加入一定量0.9%生理盐水,充分振荡30 min,经漏斗过滤后获得孢子悬液。稀释10倍后通过血球计数板计算孢子浓度。
孢子浓度(个/mL)=5个中格中孢子数之和/80×400×104×10
式中4×4小格为一中格;80为计数小格总数;400为计数室所有方格总数;104为大方格的体积个0.1 mm3=0.1 μL;10为稀释倍数。
1.2.5 转化子耐受性试验 将稀释至2×107个/mL的新鲜米曲霉孢子悬液取1 μL点种到CM培养基及CM培养基添加15、25、30 mmol/L过氧化氢,30℃培养60 h。同时点种到CM培养基及CM培养基其中葡萄糖浓度分别为10%、15%,上放置在30℃培养48 h。观察菌株对过氧化氢和高糖的耐受性。
1.2.6 转化子摇瓶曲酸发酵 将正确米曲霉转化子接种于CM斜面30℃培养6 d得到新鲜孢子,摇瓶发酵接种量为3.3×105个/mL,33℃,转速250 r/min,发酵7 d。曲酸测定利用硫酸铁显色法[4]。
1.2.7 实时荧光定量PCR
1.2.7.1 总RNA的提取 分别取发酵3 d、6 d的米曲霉3.042、g-5菌丝,无菌水离心洗涤3遍后用滤纸将水分挤干,液氮研磨直至菌丝成白色细粉末状,将研磨好的粉末分装于1.5 mL无菌EP管中,后续步骤见OMEGA生物技术公司Fungal RNA Kit试剂盒(目录号:R6840)说明书。
1.2.7.2 逆转录合成cDNA 加样体系见百迈客生物技术公司1st Strand cDNA Synthesis Kit试剂盒。
1.2.7.3 实时荧光定量PCR 将上述cDNA稀释2倍作为模板,加样体系见诺唯赞生物技术公司SYBR qPCR Master Mix试剂盒。根据引物设计原则和要求设计实验所需的引物见表1,引物合成均由金唯智公司完成。

表1 RT-qPCR 的引物Table 1 RT-qPCR primers
2 结果
2.1 msn2基因敲除质粒pk1的构建及msn2敲除转化子的筛选
构建pk1质粒的目的是敲除米曲霉中的msn2基因。以米曲霉3.042的基因组DNA为模板,PCR分别扩增msn2基因的上下游序列msn2L(1 032 bp)和msn2R(1 024 bp)以及pyrG基因片段(1 650 bp),通过相应的酶切连接方法构建pk1质粒。pk1质粒并通过PCR及测序验证确定成功构建,质粒模式图如图1-A所示。
如图1-B所示,pk1质粒上的msn2同源重组臂替换米曲霉的msn2基因,即获△msn2菌株,其中pk1质粒上敲除msn2的左右臂msn2L-arm和msn2Rarm之间的pyrG可以替换米曲霉3.042基因组上909 bp的msn2片段。通过转化子在平板上的菌落形态观察及PCR验证,筛选msn2敲除的阳性转化子。
如图1-C所示,其中红色圈中的5号转化子(即g-5)菌落形态发生很明显的变化,选择其与另外两个转化子3号和4号进行PCR验证。如图1-D所示,在复筛培养基上正常生长的转化子进行基因组验证。以Yz-F1和Yz-R1验证敲除框(msn2L-pyrG-msn2R)的全长3 706 bp,电泳图显示5号转化子正好有与理论大小一致的单一条带,3号转化子除目的条带外还有原始msn2的条带,说明3号转化子为随机插入,4号转化子未扩增出目的条带。为了进一步验证5号转化子的正确性,以Yz-F2和Yz-R2验证msn2L上游到pyrG中间部分,电泳图6泳道显示2.6 kb的条带即为目的条带,说明5号(g-5)转化子为msn2被敲除的阳性转化子。g-5转化子传10代确定其遗传稳定性。

图1 质粒pk1的构建及△msn2菌株的筛选Fig.1 Construction of plasmid pk1 and screening of △msn2 strain
2.2 g-5菌株生长形态观察
将3.042与g-5菌株孢子悬液稀释至2×107个孢子/mL,各点种孢子悬液1 μL到CM培养基平板,放置在30℃培养箱,在24、36、48 h观察其生长形态,结果如表2所示。总体来看,两株菌在24 h开始萌发产生白色菌丝,36 h从菌落中央到边缘白色菌丝越来越致密,菌落中心产黄绿色孢子,48 h孢子成熟颜色深绿;3.042菌丝向外发散菌落呈圆形,气生菌丝较多,边缘白色菌丝致密,48 h菌落直径为2.8 cm孢子量(9.0±0.4)×107个/mL(计算方法见1.2.4);g-5菌落整体呈聚缩状,边缘白色菌丝明显较短,在36 h产孢相较于野生型来说颜色明显更深且占总面积比例更高,48 h菌落直径为1.1 cm孢子量(3.6±0.35)×107个/mL。通过在CM培养基不同时间生长观察明显发现,g-5转化子菌丝生长弱,菌落直径减小,呈现菌落聚缩的状态,孢子发育提前,而且孢子老化速度快,最终孢子产量较3.042下降60%。

表2 米曲霉3.042和g-5菌株生长形态观察Table 2 Growth morphology of Aspergillus oryzae 3.042 and g-5 strain
2.3 转化子耐受性分析
2.3.1 过氧化氢耐受性 将3.042与g-5菌株孢子悬液稀释至2×107个孢子/mL,各点种悬液1 μL到含15、25、30 mmol/L的H2O2CM培养基平板,30℃培养48 h,结果如表3所示,g-5菌株在含15 mmol/L到30 mmol/L的H2O2CM培养基中都能正常萌发,且在48 h生长出黄绿色孢子。但对照菌株3.042在24 h仅于15 mmol/L的H2O2CM培养基中萌发,在30 mmol/L的H2O2CM培养基中不能萌发生长,在25 mmol/L的H2O2CM培养基中48 h才刚刚萌发,白色气生菌丝由发散状向外呈圆形生长,48 h仍未产孢,延长培养时间到72 h也不生孢子。

表3 米曲霉3.042和g-5菌株的H2O2耐受性Table 3 H2O2 tolerance of A. oryzae 3.042 and g-5 strain
△msn2菌株g-5在过氧化氢平板呈聚缩状生长,白色菌丝致密,在48 h产孢成熟颜色深绿,在30 mmol/L的H2O2下仍然可以萌发生长,但菌落直径较无H2O2平板减小57%,说明g-5号菌株虽然可以具有较好的H2O2耐受性,但其生长依然会受到较大的影响,生长速度和形态受到H2O2的抑制。
2.3.2 高糖耐受性 将稀释至2×107个/mL的米曲霉孢子各点重1 μL到CM(10%、15%葡萄糖浓终度)培养基平板,放置于30℃培养48 h,实验结果如表4所示,在高浓度糖情况下菌株均能正常萌发。10%和15%葡萄糖浓度对3.042菌株孢子萌发和菌丝生长及其产孢均无明显影响,都于36 h开始产孢,菌落直径没差别,呈现出中心深绿色孢子伴有少量气生菌丝,外围白色和透明菌丝呈圆形生长。g-5号于10%和15%葡萄糖浓度孢子萌发速度、菌丝生长菌落直径等也无明显差异,但与其自身在2%葡萄糖及3.042在同浓度葡萄糖培养基相同时间生长情况存在较大差异,总体菌落呈聚缩状,产生大量白色气生菌丝却无孢子产生,g-5菌株较3.042对高浓度糖耐受性降低。

表4 米曲霉3.042和g-5菌株高糖耐受性Table 4 High sugar tolerance of A. oryzae 3.042 and g-5 strains
2.4 g-5转化子摇瓶发酵曲酸
将米曲霉3.042和g-5号菌株按照方法1.2.6进行曲酸发酵。结果如图2所示,g-5菌株曲酸产量为21.55 g/L,较3.042菌株产量11.86 g/L提高了81%。显微镜下观察与3.042相比,g-5的菌丝球较小且菌丝较短,在摇瓶发酵过程中g-5菌株抗剪切力强,溶氧好,曲酸产量越高。

图2 米曲霉3.042和g-5号菌株发酵产曲酸分析及菌丝球形态观察Fig. 2 Fermentation results of A. oryzae 3.042 and strain g-5 and observation of mycelial pellet morphology
2.5 菌株抗逆性及产酸相关基因RT-qPCR分析
2.5.1 抗逆性相关tps1、brlA及ageB基因RT-qPCR分析 将出发菌株3.042与g-5分别培养,取3 d、6 d菌丝提取总RNA,检测显示完整性好且质量符合要求后进行反转录获得cDNA,用于RT-qPCR检测。由于Δmsn2菌株g-5与3.042相比菌丝生长和孢子形成都有较大的差异,因此需要对影响曲霉分生孢子梗分化,促进孢子的brlA基因、影响细胞内海藻糖合成的基因tps1和曲霉菌落生长发育及产孢子相关的主要基因ageB[19-20]通过RT-qPCR检测其转录水平,以his2A基因作为内参,结果如图3所示。随着时间推移两株菌tps1和brlA表达量均呈显著上升趋势(图3-A,3-B),在6 d时3.042中两基因表达量较3 d时分别上调了150倍和70倍,g-5菌株分别上调24倍和7倍,但在6 d时g-5菌株较同期3.042tps1和brlA表达量大幅下调128倍和63倍。说明敲除了msn2基因对于米曲霉brlA和tps1基因表达产生抑制,由于msn2是转录因子,随着msn2基因转录缺失导致brlA和tps1基因表达大幅下降,说明msn2转录因子对这两个基因具有正向调节功能。同时在2.3节中也观察到g-5菌株较3042菌株孢子生成量减少60%而且菌落聚缩。此外3.042菌株ageB表达量非常低,而g-5菌株随着时间变化表达量显著上调,在6 d达到3 d表达量的59倍(图3-C)。
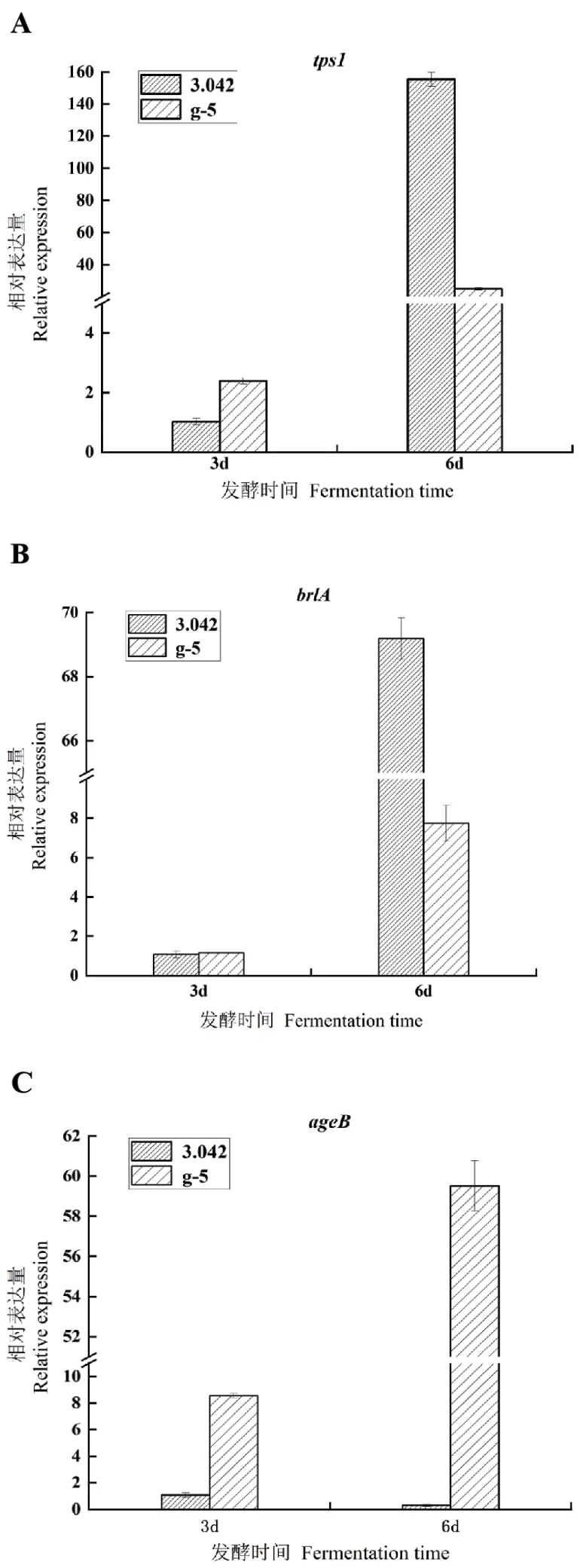
图3 米曲霉3.042和g-5菌株brlA、tps1和ageB相对表达量Fig. 3 Relative expressions of A. oryzae 3.042 and g-5 strain brlA,tps1 and ageB
2.5.2msn2及产酸相关基因LaeA和kojRRT-qPCR分析 在g-5菌株中未检测到msn2基因的表达,而在3.042菌株中msn2呈现上升的趋势(图4-A)。在3.042和g-5菌株中与曲酸产量相关的全局调控转录因子LaeA基因随时间表达量呈增加趋势,而且在曲酸发酵后期6 d,g-5转化子LaeA基因表达量急剧增加,是3.042表达量的21.02倍(图4-B)。直接影响曲酸合成的kojR基因,在3.042和g-5菌株表达量也随时间呈增加趋势,在3 d时g-5菌株kojR基因表达量是3.042表达量的3.19倍,而到6 d时g-5菌株kojR基因表达量依然比3.042高,但差距明显缩小(图4-C)。
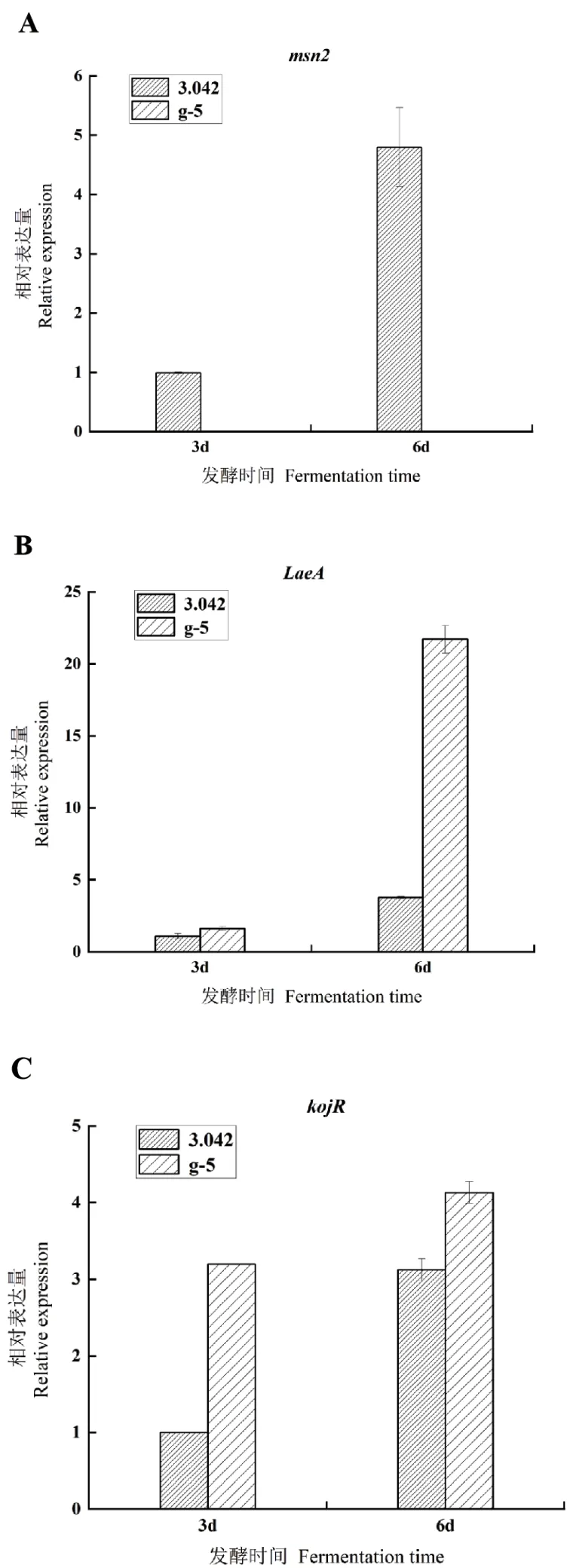
图4 米曲霉3.042和g-5菌株kojR、msn2和LaeA相对表达量Fig. 4 Relative expressions of A. oryzae 3.042 and g-5 strain kojR,msn2 and LaeA
3 讨论
Msn2是真菌重要的转录因子,但其在米曲霉中的功能研究比较少。本文对Δmsn2菌株g-5生长、其耐受过氧化氢和高浓度糖等与米曲霉3.042进行观察比较,同时进行相关基因表达量检测。g-5菌株较3.042菌株孢子生成量显著降低60%,菌丝生长受到抑制导致菌落聚缩,通过相关基因表达检测发现,g-5菌株msn2基因几乎没有表达,说明该基因在米曲霉中可能仅有一个拷贝没有同工酶,同时发现与同期3.042相比g-5菌株brlA和tps1基因表达显著下调63倍和128倍,ageB基因表达量上调59倍,因此导致g-5菌株生长受到影响,说明敲除msn2对ageB基因的表达有显著促进作用,而3.042菌株由于msn2基因的正常表达抑制了ageB基因的表达。ageB编码高尔基体定位的ArfA GTPase活性蛋白G蛋白调控因子,影响蛋白分泌和菌丝球形成[21],推测这可能是g-5菌株菌丝球更小菌丝更短的一个原因。与球孢白僵菌和罗伯兹绿僵菌msn2突变体分生孢子产量降低40%结果相近[22]。
过氧化氢耐受性分析,g-5较3.042抗H2O2能力显著增强,H2O2的添加使得菌丝胞内ROS增加受到氧化胁迫,由于msn2基因缺失导致LaeA基因补偿性转录增加,可增加抗氧化酶含量平衡过多活性氧带来的毒害,提高氧化应激防御能力。实验人员发现H2O2的添加使得野生株胞内ROS增加,抗氧化酶含量也相应增加,而相同条件下LaeA缺失株的抗氧化酶含量较对照降低,说明LaeA的缺失可能会影响抗氧化酶的活性使其在受到氧化胁迫时无法平衡过多活性氧带来的毒害,造成对胁迫环境敏感性的增加[23],同时增加次生代谢产物曲酸含量,曲酸作为一种抗氧化物可以直接缓解真菌活性氧压力,这也是△msn2菌株产曲酸高于出发菌株的原因之一。高糖耐受性结果表明,高浓度糖导致ROS的增加,而Msn2作为应激反应调节转录因子的缺失使得△msn2菌株对于高糖利用率下降,甚至影响了菌丝生长和产孢调控相关基因的表达,这与吕润玲[16]在玉米大斑病△Stmsn2菌株生长速度增快、不产生分生孢子结果相似。Msn2转录因子作为压力响应调节基因,其编码蛋白可以特异识别并结合STRE序列,响应多重压力的诱导来调控不同类型的基因,也是部分信号通路中的关键激活因子,在参与调控真菌生长形态和环境胁迫方面等起到重要作用。研究表明球孢白僵菌和罗伯兹绿僵菌msn2突变体对多种高渗胁迫的耐受性大大降低[22]。本研究发现△msn2菌株g-5对高糖的耐受性降低,可能由于g-5菌株受到msn2不表达影响导致tps1基因表达量下降,海藻糖合成受阻影响细胞内渗透压调节,同时高浓度糖类导致ROS的增加,而Msn2作为应激反应调节转录因子的缺失使得△msn2菌株对于高糖利用率下降。
g-5菌株在高浓度过氧化氢存在下,表现出较好的耐受性和生长特性,而且摇瓶发酵产曲酸达到21.55 g/L,较3.042发酵曲酸11.86 g/L提升至81%。通过基因表达量检测发现,对比各时间3.042和g-5菌株msn2基因、LaeA基因和kojR基因表达量,发现g-5菌株msn2基因没有表达,而其LaeA基因表达量急剧增加,表明LaeA对于msn2转录因子有补偿作用,并且可能由于msn2基因的缺失促进了LaeA基因转录,以实现米曲霉生长和对环境适应的需要。g-5菌株LaeA和kojR较3.042具有较大的提高,LaeA作为丝状真菌全局转录因子在调控次级代谢产物具有重要作用,Oda等[24]发现在米曲霉中LaeA能调节曲酸合成基因表达水平,敲除LaeA基因后,米曲霉不再产生曲酸,且曲酸合成相关的koj基因簇表达量均大幅度降低。Bok等[25]发现米曲霉koj基因簇直接参与曲酸的产生。kojA和kojT基因的主要功能分别是FAD依赖的氧化还原酶和主要的促进剂超家族转运体。而kojR基因编码一个转录因子,参与曲酸生物合成基因kojA和kojT转录的激活[26]。并且KojR作为转录调控因子可正向调节过表达LaeA来提高真菌多种次级代谢产物如曲酸。而Msn2涉及另一部分与生成曲酸间接的途径,与次级代谢不直接相关。根据本研究的实时荧光定量PCR结果显示菌株g-5号msn2表达量始终为零,而LaeA和kojR基因随时间变化表达量显著增加,这表明msn2基因对于米曲霉中LaeA和kojR基因表达有抑制作用,间接对曲酸的合成呈效应影响。
总之,通过RT-qPCR实验显示出msn2基因敲除菌株g-5其调节曲酸合成相关基因LaeA和kojR表达量显著高于3.042,与其摇瓶发酵曲酸结果一致,表明LaeA基因和kojR基因对于米曲霉合成曲酸具有正相关性,这两个基因的高表达可实现提高米曲霉曲酸产量。
4 结论
以米曲霉3.042为出发菌株,利用同源重组和农杆菌介导的转化法,以回补pyrG为筛选标记最终获得△msn2菌株g-5号,该菌株呈聚缩状生长,孢子量降低且菌丝较短,耐受高浓度过氧化氢且对高糖利用率降低,摇瓶发酵产曲酸达到21.55 g/L,较3.042曲酸产量11.86 g/L提升81%。