光与茉莉酸信号介导的萜类化合物合成分子机制
张婵 吴友根 于靖 杨东梅 姚广龙 杨华庚 张军锋 陈萍
(海南大学园艺学院,海口 570228)
萜类化合物(terpenoids)是以异戊二烯为基本单位构成的一类重要次生代谢产物,可分为半萜、单萜、倍半萜、二萜、三萜以及多萜等。对植物而言,萜类化合物可帮助其应对环境胁迫、防御天敌、引虫授粉和完成信息交流;而对人类来说,萜类化合物则是天然药物活性成分的主要来源之一。近年来,药用植物萜类化合物在医药、工业和农业上应用广泛,经济效益显著。但药用植物中萜类化合物的天然含量普遍较低,难以满足日益增长的需求。光信号和茉莉酸信号对植物次生代谢产物的合成十分重要,是萜类化合物生物合成调控研究中常用的诱导子。本文以青蒿素、丹参酮、芳樟醇等为例,综述近年来光和茉莉酸信号调控药用植物萜类化合物合成的研究进展。
1 萜类化合物的生物合成途径
植物萜类化合物的合成主要涉及2条途径,甲羟戊酸途径(mevalonate,MVA)和甲基赤藓醇-4-磷 酸 途 径(2-C-methyl-D-erythritol 4-phosphate,MEP),前者主要在动植物中存在,后者则主要在古生菌与原核生物中被发现[1]。整个过程可分为4个阶段(图1)[2]:一是,乙酰辅酶A和丙酮酸等化合物经MVA途径(7步催化反应)和MEP途径(8步催化反应)合成萜类化合物的两种共同前体物质,异戊烯焦磷酸(isopentenyl diphosphate,IPP)和二甲基烯丙基焦磷酸酯(dimethylallyl diphosphate,DMAPP);二是,IPP和DMAPP被相应酶催化合成法呢基二磷酸(farnesyl diphosphate,FPP)、牻牛儿基二磷酸(geranyl diphosphate,GPP)、牻牛儿基牻牛儿基二磷酸(geranylgeranyl diphosphate,GGPP);三是,FPP、GPP、GGPP可分别被不同萜类合酶催化形成萜类骨架;四是,细胞色素P450(cytochrome P450,CYP)、糖 基 转 移 酶(glycosyl transferase,GT)、酰基转移酶(acyl transferase)和萜类氧化酶(terpene oxidase)等对萜类骨架进行多种修饰;后两个阶段是植物中丰富复杂萜类化合物形成的重要原因[3-4]。
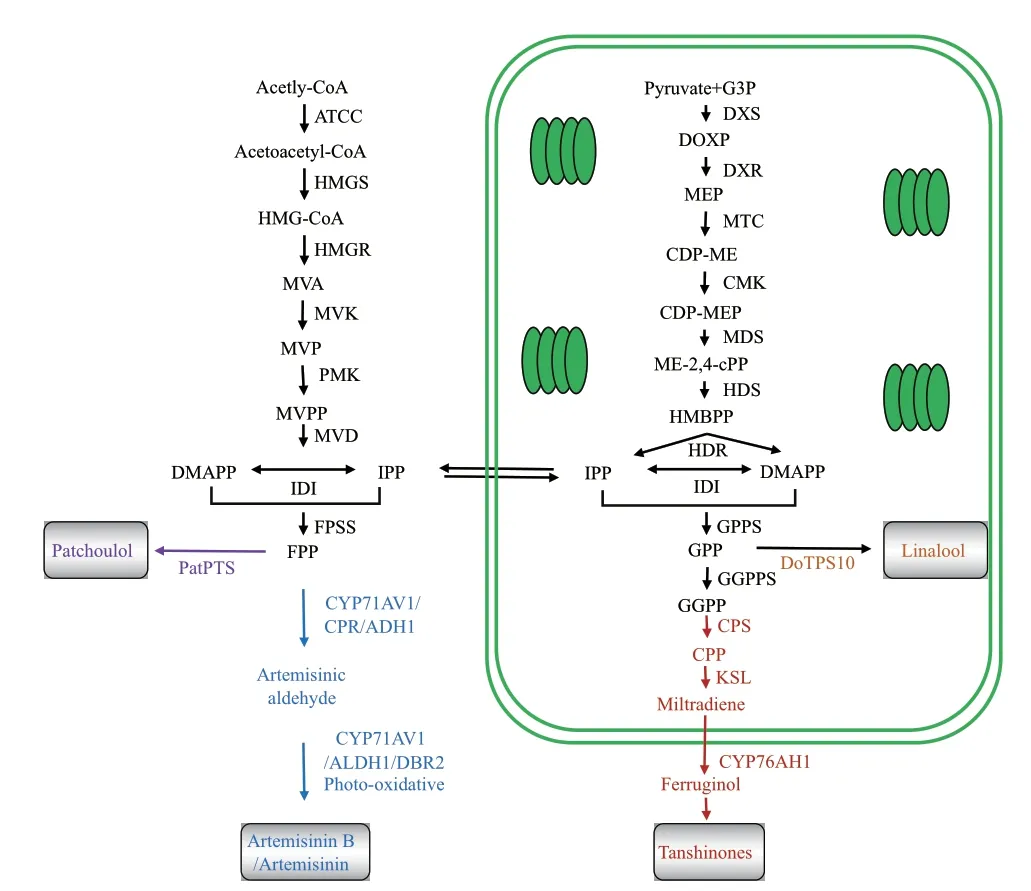
图1 萜类化合物合成途径示意图Fig. 1 Schematic diagram of terpenoids synthesis pathways
不同药用植物中存在特定萜类合酶和修饰酶类,可以FPP、GPP和GGPP为直接前体物质合成多样的萜类化合物(图1)。在黄花蒿中,FPP可在紫穗槐二烯合成酶(amorphadiene synthase,ADS)、细 胞色素P450单 氧化酶(cytochrome P450),如AaCPR/CYP71AV1、青蒿醛A11还原酶(artemisinic aldehyde A11 reductase,DBR2)和醛脱氢酶1(aldehyde dehydrogenase 1,ALDH1)等一系列酶的催化下形成二氢青蒿酸,再经氧化后合成青蒿素[5]。在丹参中,GGPP可被共聚二磷酸合成酶(copalyl diphosphate synthase,CPS)、类合成酶(kaurene synthase-like,KSL)和SmCYP76AH1催化形成铁锈醇,后被SmCYP76AH3、SmCYP76AK1催 化 合 成11,20-二羟基铁杉醇和11,20-二羟基柳杉酚,最后经其他CYP450酶催化产生丹参酮类化合物[6]。广藿香的百秋李醇合酶(patchoulol synthase,PatPTS)[7]和铁皮石斛的芳樟醇合酶(linalool synthase,DoTPS)[8]则可分别以FPP和GPP为前体物质合成百秋李醇和芳樟醇。
2 光和茉莉酸(jasmonates,JAs)信号调控萜类化合物合成的分子机制
光和JAs信号是促进药用植物萜类化合物合成的重要诱导子,已发现光和JAs信号可提高黄花蒿[9]、人参[10]、丹参[11]、胡黄连[12]和阳春砂[13]等多种药用植物中萜类化合物的含量(表1)。本部分将以青蒿素、丹参酮等萜类化合物为例,介绍光与JAs信号调控的药用植物萜类化合物生物合成的分子机制。
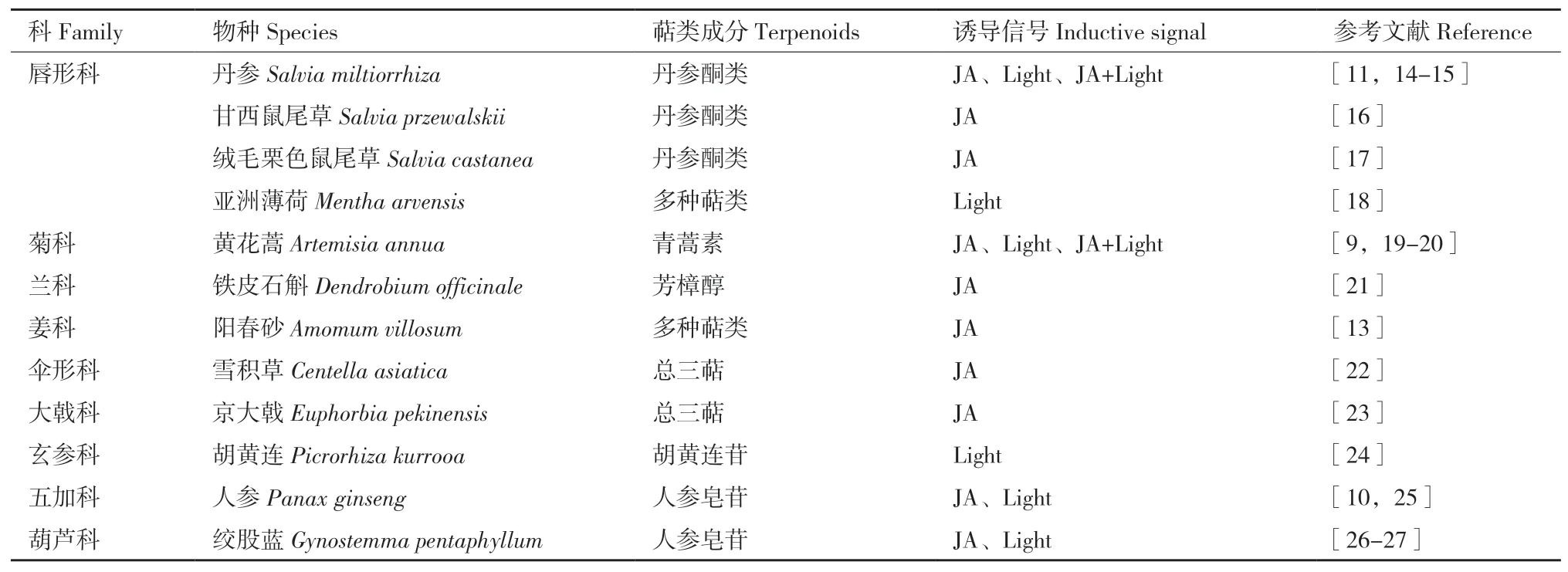
表1 光和JAs信号调控的药用植物萜类化合物Table 1 Terpenoids in medicinal plants regulated by light and JA signals
2.1 青蒿素
2.1.1 青蒿素生物合成相关转录因子 青蒿素(artemisinin)是黄花蒿中的一种倍半萜内酯类化合物,具有抗病毒、抗癌、抗血吸虫和抗疟疾等多 种 作 用。已 证 明AaERF1[28]、AaERF2[28]、Aa-ORA[29]、AaTAR[30]、AaMYC2[31]、AabHLH1[32]、AabZIP1[33]、AaHY5[34]、AaHD1[35]、AaGSW1[36]、AaWRKY9[9]、AaNAC1[37]、AaTCP14[38]、AaTCP15[20]、AaMYB15[39]等7大家 族 的15个转录因子可调控相关酶基因表达以影响青蒿素的合成;其中仅AaMYB15是负调控子,这些调控因子的确定对提高青蒿素产量具有重要意义。
2.1.2 JAs信号调控青蒿素的生物合成 植物激素茉莉酸类物质(jasmonates,JAs)是一种可感知环境或自身内部变化的一种重要信号分子。JAs可通过影响转录因子和其靶标基因的表达水平,平衡植物生长发育和外界胁迫等多种过程。茉莉酸通路抑制因子(jasmonate ZIM-domain,JAZ)是一类常与转录因子结合,连接JAs信号和下游调控网络的重要中介。黄花蒿中共鉴定9个JAZ蛋白(AaJAZ1/2/3/4/5/6/7/8/9),所 有 的AaJAZs均 可 与AabHLH1结 合[40],而AaJAZ1/2/3/4可 与AaMYC2结合[31];AaJAZ8结合AaTCP14-AaORA,抑制AaTCP14-AaORA复合物激活AaDBR2表达的能力[38];AaJAZs对AaMYC2、AabHLH1、AaORA和AaTCP14的负调控作用是JAs信号调控青蒿素生物合成的关键,该抑制作用可被MeJA解除[20,29,31,40]。
JAs信 号 可 影 响AaHD1,AabHLH,AaORA,AaMYC2,AaMYB15,AaGSW1,AaWRKY9,AaERF1和AaERF2等转录因子与相关酶基因的表达,以调控青蒿素的合成(图2-a)。如AaMYC2可结合AaCYP71AV1和AaDBR2,上调二者的表达 水 平[31];AabHLH1、AaERF1/2和AaTAR1三者均可结合并激活青蒿素的生物合成相关酶基因AaADS和AaCYP71AV1的表达[28,30];AaORA[29]和AaGSW1[36]都是腺状毛状体特异性转录因子,前者可结合并促进AaADS、AaCYP71AV1、AaDBR2和AaALDH1四种基因的表达,后者仅正向调控AaCYP71AV1,AaADS和AaDBR2的表达;AaTCP14和AaTCP15可结合并激活AaDBR2和AaALDH1的表达[20]。
转录因子还可与其他转录因子结合,形成转录级联模块,协同调控青蒿素的合成。Chen等[36]发现AaGSW1可 与AaMYC2、AabZIP1、AaORA互 相作用,形成AaMYC2/AabZIP1-AaGSW1-AaORA转录级联调控模块,调控青蒿素的合成。Ma等[38]证明AaTCP14可与AaORA互作,形成AaTCP-ORA调控模块,从而激活AaDBR2和AaALDH1的表达,促进青蒿素合成;AaTCP15则与AaORA和AaGSW1相互作用,形成AaGSW1-AaTCP15/AaORA多层转录级联的调控模块,协同激活AaDBR2的表达[20]。目前,对于其它调控青蒿素合成转录因子之间的互作效应有待进一步解析。
2.1.3 光信号调控青蒿素的生物合成 光信号在青蒿素的生物合成中具有重要作用。多项研究证明,白光、UV-B、蓝光和红光等均可促进青蒿素的合成,其中红光和蓝光诱导效果较为显著[41-43]。深入研究发现UV-B[42]、蓝光和红光[41]均可促进AaADS和AaCYP71AV1酶基因的表达,或是其提高青蒿素含量的原因。光受体在光信号介导的青蒿素生物合成中也具有重要作用。AaCRY1是蓝光促进青蒿素合成中的关键受体,其可结合并上调AaADS和AaCYP71AV1的表达水平,提高青蒿素的含量[19],然而对于其他光质调控青蒿素合成中的光受体仍未知。
光信号可通过影响AaMYB15、AaHY5和AaWRKY9的表达,调控青蒿素的合成(图2-a)。AaMYB15是青蒿素合成中的负调控子,可被光照抑制,而受黑暗诱导,其可抑制AaORA的表达,下调AaADS、AaCYP、AaDBR2和AaALDH1的表达水平,降低黄花蒿中青蒿素的含量[39]。AaHY5则可与AaCOP1和AaGSW1互作,间接控制青蒿素的合成,以应对不断变化的光照条件[34];AaCOP1是一种介导AaHY5泛素化降解的E3泛素化酶,光照下AaCOP1的表达被抑制,导致AaHY5的积累;AaHY5又可正调控AaGSW1的表达,上调AaORA和AaADS、AaCYP71AV1、AaDBR2的表达水平,以增加青蒿素的含量[34]。AaWRKY9则结合并激活AaDBR2和AaGSW1的表达,正向调控青蒿素的生物合成;研究发现AaHY5还可与AaWRKY9结合促进青蒿素的生物合成[9]。值得注意的是,AaMYC2和AabZIP1也通过AaGSW1来控制青蒿素的生物合成(图2-a),暗示AaGSW1或是青蒿素生物合成调控网络中的核心转录因子。
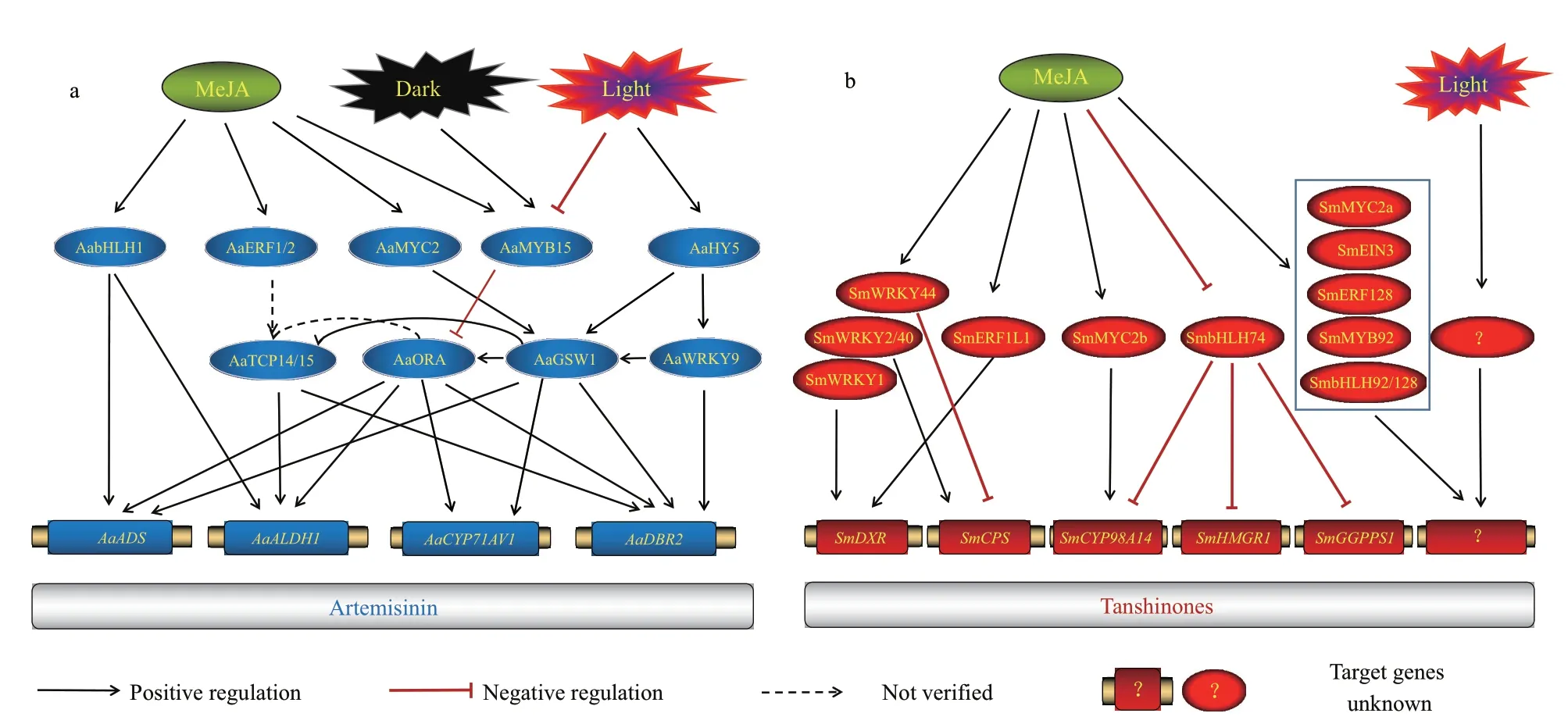
图2 光与JAs信号介导的药用植物萜类化合物转录调控机制模式图Fig. 2 Terpenoids transcription regulatory mechanisms of medicinal plants mediated by light and JAs signals
2.1.4 光与JAs信号协同调控青蒿素的生物合成 多个研究证明,光和JAs信号可联合调控青蒿素的生物合成。Hao等[44]发现光照中以茉莉酸甲酯处理可显著上调AaADS、AaCYP71AV1、AaDBR2和AaALDH1的表达水平,而黑暗下茉莉酸甲酯处理失去诱导效果,这表明JAs信号是以光依赖的方式促进青蒿素的生物合成。近期研究发现AaMYB15和AaWRKY9可同时响应光信号和JAs信号,调控青蒿素的生物合成。AaWRKY9可直接与AaDBR2和AaGSW1的启动子结合,正向调控青蒿素的生物合成[9];光信号通路中的关键调控因子AaHY5可结合并激活AaWRKY9表达;而JAs信号中的AaJAZ9也可与AaWRKY9结合,但抑制其表达[9]。AaMYB15是青蒿素生物合成的负调控因子,AaMYB15抑制AaADS、AaCYP、AaDBR2和AaALDH1的 表 达,使青蒿素的含量显著降低[39]。暗处理和MeJA均可诱导AaMYB15的表达,暗示其在光和JAs信号联合调控青蒿素合成中具有重要作用[39]。以上研究表明,在黄花蒿中茉莉酸信号调控青蒿素的生物合成具有光依赖性。
2.2 丹参酮
2.2.1 丹参酮生物合成相关转录因子 丹参酮(tanshinones)是丹参中的一类二萜化合物,主要包括丹参酮IIA(tanshinone IIA,TSIIA)、丹参酮IIB(tanshinone B,TSB)、丹参酮I(tanshinone I,T-I)、隐丹参酮(ryptotanshinone,CT)和二氢丹参酮I(dihydrotanshinone I,DT-I)等多种成分[45]。已确定参与丹参酮合成的转录因子有6大家族的17个转录因子,主要包括SmEIN3[46]、SmAP2/ERF82[47]、SmERF1L1[48]、SmERF128[14]、SmbHLH10[49]、SmbHLH74[50]、SmbHLH92[51]、SmbHLH148[52]、SmMYC2a/b[45]、SmMYB9b[53]、SmMYB36[54]、SmMYB98[55]、SmWRKY1[56]、SmWRKY2[6]、SmWRKY40[57]、SmWRKY44[58]等, 其 中 仅SmWRKY40、SmbHLH92和SmbHLH174为 丹 参 酮合成的负调控子。
2.2.2 JAs信号调控丹参酮的生物合成 JAs可影响丹参毛状根中丹参酮类化合物的含量。Wang等[11]以MeJA处理3 d后,丹参毛状根中的总丹参酮含量提高了3.7倍。Kai等[59]以MeJA处理9 d后,使CT和TA-IIA的含量均提高5.8倍。Xing等[60]发现MeJA处理6 d后,总丹参酮含量几乎不受影响,但丹参毛状根中的T-I和TA-IIA含量下降,CT和DT-I含量上升。以上研究表明,JAs对丹参酮类化合物的作用受处理时间影响,且对不同丹参酮类化合物产生的效果有所差异[11,59-60]。
JAs信号可通过调控SmWRKY1、SmWRKY2、SmWRKY44、SmWRKY40、SmEIN3、SmbHLH74、S m b H H L H 1 4 8、S m M Y B 9 b、S m E R F 1 L 1、SmERF128、SmMYC2a/b等转录因子的表达,以影 响 丹 参 酮 的 合 成(图2-b)。如SmWRKY1[56]、SmWRKY2[6]和SmWRKY40[57]可分别与SmDXR、SmCPS和SmCPS1/5结合,以促进丹参酮合成;而SmWRKY44[58]直接负调控SmCPS1/5,抑制丹参酮的合成,但其抑制作用可被MeJA解除。MeJA还可诱 导SmERF1L1[48]、SmERF128[14]、SmMYB9b[53]表达以增加丹参酮的含量;其中SmERF1L1可与SmDXR结 合,而SmERF128、SmMYB9b的 靶标基因仍不清楚。Zhou等[45]发现SmMYC2a/b受MeJA的诱导,两者均可调控SmHMGR、SmGGPS、SmCYP98A14、SmCPS和SmKSL的 表 达 水 平,促进丹参酮的合成;其中SmMYC2b的靶标基因是SmCYP98A14。SmMYC2b转录因子属于bHLH家族成员,该家族中的SmbHLH74和SmbHHLH148也介导JAs诱导的丹参酮合成,前者的表达受MeJA抑制,后者则被MeJA诱导表达;SmbHLH74可负调控SmHMGR1、SmGGPPS1和SmCYP76AH1的表达,阻碍丹参酮的合成[50];SmbHLH148则通过促进丹参合成途径中多个相关酶基因的表达,显著增加DT-I、CT、T-I等3种丹参酮类物质的含量[52]。值得注意的是,SmbHLH74也受SmMYC2的负调控[50],暗示着调控丹参酮生物合成的转录因子之间也存在转录级联模块。
丹参中鉴定了9个JAZ蛋白(SmJAZ1/2/3/4/5/7/8/9/10),均可在MeJA的诱导下表达,但在JAs信号调控丹参酮的合成中承担不同作用[61]。裴天林[61]发现分别过表达SmJAZ1/2/4/6/9可显著提高丹参酮的含量;而分别过表达SmJAZ3/4/8则均抑制丹参酮的合成;除SmJAZ5外,其它的SmJAZs均可与SmMYC2a、SmMYB39互作。SmEIN3是调控丹参酮合成的正调控子,王宇[46]发现SmJAZ1、SmJAZ2可与SmEIN3结合,抑制其表达。SmJAZ8在MeJA诱导的丹参酮生物合成中起负调控作用,其可结合并抑制SmMYC2a的表达,降低丹参酮的含量;SmJAZ8还可结合SmbHLH128,但其对丹参酮的影响仍不清楚[61]。值得注意的是,JAZ蛋白(SmJAZ3、SmJAZ8和SmJAZ9)作为抑制子或可通过不依赖JA信号通路的途径调控丹参酮合成[62]。
2.2.3 光信号调控丹参酮的生物合成 不同光质均可调控丹参酮的生物合成。Wang等[11]发现UV-B(40 μW/cm2)处理3 d,可使总丹参酮产量提高1.5倍。冯思念等[63]发现不同强度的白光、红光和蓝光处理丹参,可影响丹参毛状根中丹参酮化合物的含量;白光处理下,随着光强的增加,丹参酮I含量先上升后下降;相比蓝光和红光,二氢丹参酮的含量在白光(200 μmol·m-2·s-1)处理下被显著提高。在蓝光和红光处理下,隐丹参酮的含量随着光强增加而下降。Chen等[15]以蓝光(110 μmol·m-2·s-1)处理3周,发现丹参酮生物合成途径的SmHMGR、SmDXS2、SmDXR、SmGGPPS、SmCPS和SmCYP76AH1基因的表达水平降低,TSIIA的含量也降低;而红光(110 μmol·m-2·s-1)处理3周可抑制SmDXS1、SmKSL、SmHMGR和SmCYP76AH1的表达,但TSIIA的含量几乎不受影响。这些研究表明光质对不同丹参酮类化合物产生的影响有差异,且光质对丹参酮的调控受光强影响[11,63]。
2.2.4 光和JAs信号协同调控丹参酮的生物合成 联合光与JAs信号的诱导方式,是一种可显著提高丹参毛状根中丹参酮含量的有效策略。Wang等[11]发现UV-B、MeJA和UV-B+MeJA处理可分别使丹参酮产量提高1.5倍、3.7倍和4.9倍,联合处理的效果明显高于单独处理;分析发现UV-B和MeJA可通过促进MVA途径中丹参酮合成相关酶的表达,从而促进丹参酮的合成。该研究首次联合UV-B和MeJA两种诱导剂促进丹参酮的合成,但未能解析介导两种信号调控丹参酮合成的相关转录因子。目前,丹参酮合成中响应光信号以及同时响应两种信号的转录因子仍然未知;对响应JAs信号的SmMYC2、SmEIN3、SmERF128、SmMYB92和SmbHLH92/128等转录因子的靶标基因、互作的JAZ蛋白均不清楚;丹参中拥有共同靶标基因的转录因子是否也可互作形成转录级联调控模块,这些都有待深入研究。
2.3 光和JAs信号调控其它萜类化合物的生物合成
芳樟醇(linalool)是铁皮石斛中的单萜类化合物,具有抗大肠杆菌弯曲杆菌和空肠弯曲杆菌的效用[21]。芳樟醇是以GPP为直接前体化合物,经DoTPS10的催化形成的。Yu等[21]证实铁皮石斛 中DobHLH4和3个JAZs(DoJAZ1、DoJAZ1和DoJAZ3)均受MeJA的诱导表达;过表达DobHLH4可 上 调DoHMDS、DoPMK、DoIDI、DoDXS、DoMCT、DoHDS和DoTPS10的表达水平,提高铁皮石斛中芳樟醇的含量;且DobHLH4可与DoTPS10结合,并激活其表达;但DobHLH4基因转录受DoJAZ1的抑制,而MeJA可逆转DoJAZ1的负调控效果。
百秋李醇(patchoulol)是广藿香中的一种倍半萜类化合物。百秋李醇是以FPP为前体,在百秋李醇合酶(PatPTS)催化下产生[64]。参与调控百秋李醇生物合成的转录因子主要有MYB家族 中 的PatMYB46、bHLH家 族 中 的PatMYC2b1、PatMYC2b2、TH家 族 中 的PatGT-1和SPL家 族SPL10,其中前4个均受MeJA诱导,参与JAs信号调控的百秋李醇合成。PatMYC2b1/2可与PatJAZ6结合,负调控PatPTS的表达[64];PatMYB46可结合PatJAZ4[65],抑制PatPTS的表达;MeJA可诱导PatJAZ6和PatJAZ4泛素化降解,解除其对转录因子的负调控作用。目前,尚未见光信号对百秋李醇和芳樟醇生物合成调控的相关报道。
3 展望
光和JAs信号作为诱导子,是提高药用植物中萜类化合物含量一种有效、经济的方法。解析光和JAs信号在药用植物萜类化合物生物合成调控中的作用,对提高药材质量和开展萜类化合物合成生物学工程意义重大。
3.1 光和JAs信号调控萜类化合物合成分子机制的解析
光具有成本低廉、灵活度高、通用性广等特点,具有作为调控萜类化合物生物合成总开关的潜力。解析光信号介导药用植物萜类化合物合成中的光受体和转录因子,可帮助寻找增加药用植物中萜类化合物含量但不影响其生长的合适光照条件。JAs信号对萜类化合物调控可推广性高,但JAs也参与植物生长发育、抵御逆境胁迫、防御病虫害等过程,因而有必要了解田间大规模使用JAs对药用植物生长的影响。另外,药用植物中JAs和光信号介导的萜类化合物生物合成分子机制,仅在青蒿素和丹参酮上研究较为深入,需加强其他药用植物中相关机制的解析。了解光和JA信号调控药用植物萜类化合物生物合成的转录调控机制,可为未来开发高灵活性、高推广性且成本低廉的异源表达体系奠定基础。
3.2 药用植物萜类化合物负调控子和转录级联反应的揭密
外界信号刺激药用植物萜类化合物合成与积累的过程,涉及众多正向调控和负向调控的转录因子。目前对调控药用植物萜类化合物转录因子的了解,多集中在正调控子,缺少对负调控子的解析;减少负调控子的影响而加强正调控子作用,这两者联合带来的效果仍未知。植物萜类化合物生物合成的调控网络极其复杂,多个转录因子往往可响应同一信号,形成转录级联模块,协同调控萜类化合物的生物合成,今后需加强对调控同一萜类化合物转录因子间互作效应的研究。
——青蒿素