microRNA-96与脓毒症新生儿炎症反应的关系研究
张春磊,李秀婷,刘 娜,张成元
潍坊市妇幼保健院儿科,山东潍坊 261011
脓毒症是指由感染、烧伤等因素导致宿主免疫反应失调而诱发的全身炎症反应综合征(SIRS),也是严重感染、外科手术、休克、创伤等患者的并发症,具有病死率高、发病率高、预后差等特点[1-2]。近年来,脓毒症在儿童中的发病率呈逐年增长趋势,在病情进展过程中可能造成多器官功能障碍综合征、脓毒症休克,严重威胁患儿生命健康[3-4]。目前,临床认为新生儿脓毒症(NS)的发病机制与凝血功能异常、组织损伤、全身炎症反应、免疫功能障碍等有关,但临床工作者对NS的病理生理学认知上仍存在一定不足,深入分析本病具体病因及发病机制,尤其是借助测序技术、分子生物学等手段探索新型标志物及靶点,在NS的早期诊断、治疗中尤为重要[5]。作为一类新型的基因调控分子,微小核糖核酸(miRNA)可通过调节部分蛋白及基因的mRNA表达,而参与多种感染/炎症性疾病的发生、发展过程[6]。miR-96是miR-183家族重要成员之一,已有诸多研究证实,其在食管癌、乳腺癌等多种恶性肿瘤中表达异常,但目前关于miR-96在NS中表达情况的研究较少,且相关机制尚不清楚[7]。鉴于此,本研究就miR-96表达与NS及炎症反应的关系进行分析,旨在进一步阐述NS的机制,掌握miR-96表达与炎症反应的相关性,为临床诊治NS提供可靠的理论依据。现报道如下。
1 资料与方法
1.1一般资料 将2018年6月至2020年4月在本院住院治疗的65例NS患儿作为NS组,将同期65例非感染性SIRS患儿作为非感染性SIRS组,另选50例健康体检儿童作为健康组。纳入标准:NS组、非感染性SIRS组患儿符合美国重症医学会(ACCM)与欧洲重症医学会(ESICM)联合发布的NS、非感染性SIRS相关诊断标准[8];家属自愿签署知情同意书。排除标准:伴有心、肝、肾等重大脏器病变;伴有结缔组织疾病、先天性畸形、染色体疾病、先天性遗传代谢病;中途转院或因其他原因而未完成相关指标;入院24 h内即出院;出生后不足7 d。本研究符合医学伦理委员会制定标准。
1.2方法
1.2.1miR-96检测 采集所有受检者外周血2 mL[健康组于体检当日采集,NS组、非感染性SIRS组于入院后(治疗前)采集],置于EDTA抗凝试管,3 000 r/min离心10 min,取上层血浆于1.5 mL EP管。参考Trizol试剂盒、总RNA提取试剂盒(武汉纯度生物科技有限公司)说明书提取血浆中总RNA,使用反转录试剂盒将总RNA反转录为cDNA(miR-96引物序列:上游为5′-TCT GGG TAC CGC ACT GGT AGA ATT CAC TG-3′,下游为5′-CCT TTC TAG ACC ACG GCA CCA TTC AGG A-3′),按厂家说明书进行操作。以反转录的cDNA为模板,用荧光定量PCR技术(PRISM 7000型定量PCR仪)检测miR-96的表达水平。反应条件:94 ℃ 10 min,94 ℃ 30 s,60 ℃ 30 s,72 ℃ 40 s,重复40循环,72 ℃ 10 min,采集荧光,以U6作为内参,用2-ΔΔCt法计算miR-96的相对表达量。U6引物序列:上游引物为5′-CTC GCT TCG GCA GCA CA-3′,下游引物为5′-AAC GCT TCA CGA ATT TGC GT-3′。
1.2.2炎性因子检测 采集所有受检者外周血2 mL[健康组于体检当日采集,NS组、非感染性SIRS组于入院后(治疗前)采集],离心10 min(3 000 r/min,离心半径为6 cm),取血清放于低温冰箱中待测。使用酶联免疫吸附试验(ELISA)测定血清IL-1β、IL-6、TNF-α水平,试剂盒购自北京亿鸣复兴生物科技有限公司。
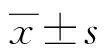
2 结 果
2.13组一般资料比较 3组性别、孕周、年龄、体质量、5 min Apgar评分比较,差异无统计学意义(P>0.05);NS组、非感染性SIRS组原发疾病比较,差异均无统计学意义(P>0.05);NS组序贯器官衰竭评估(SOFA评分)、急性生理学和慢性健康评价Ⅱ(APACHEⅡ评分)比非感染性SIRS组高,差异均有统计学意义(P<0.05)。见表1。

表1 3组一般资料比较(n/n或
2.2miR-96、炎性因子水平比较 NS组miR-96 表达水平比非感染性SIRS组、健康组低,IL-1β、IL-6、TNF-α水平比非感染性SIRS组、健康组高,差异均有统计学意义(P<0.05)。见表2。
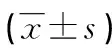
表2 3组血清miR-96、炎性因子水平比较
2.3miR-96表达水平与炎性因子水平相关性 Pearson相关分析结果显示,miR-96表达水平与IL-1β、IL-6、TNF-α水平均呈负相关(r<0,P<0.05)。见表3。

表3 miR-96表达与炎性因子水平相关性
2.4NS组不同预后患儿血清各指标差异 根据入院28 d内存活情况分为两组。死亡组miR-96表达水平比存活组低,IL-1β、IL-6、TNF-α水平比存活组高,差异均有统计学意义(P<0.05)。见表4。
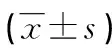
表4 NS组不同预后患儿血清各指标差异对比
2.5miR-96对NS患儿预后的预测价值 将miR-96作为检验变量,将NS患儿预后作为状态变量(0=存活,1=死亡),绘制ROC曲线,结果显示,miR-96预测NS患儿病死的AUC为0.903(95%CI:0.846~0.978),以0.75为临界值,其灵敏度、特异度分别为0.894、0.855,约登指数为0.749。见图1。
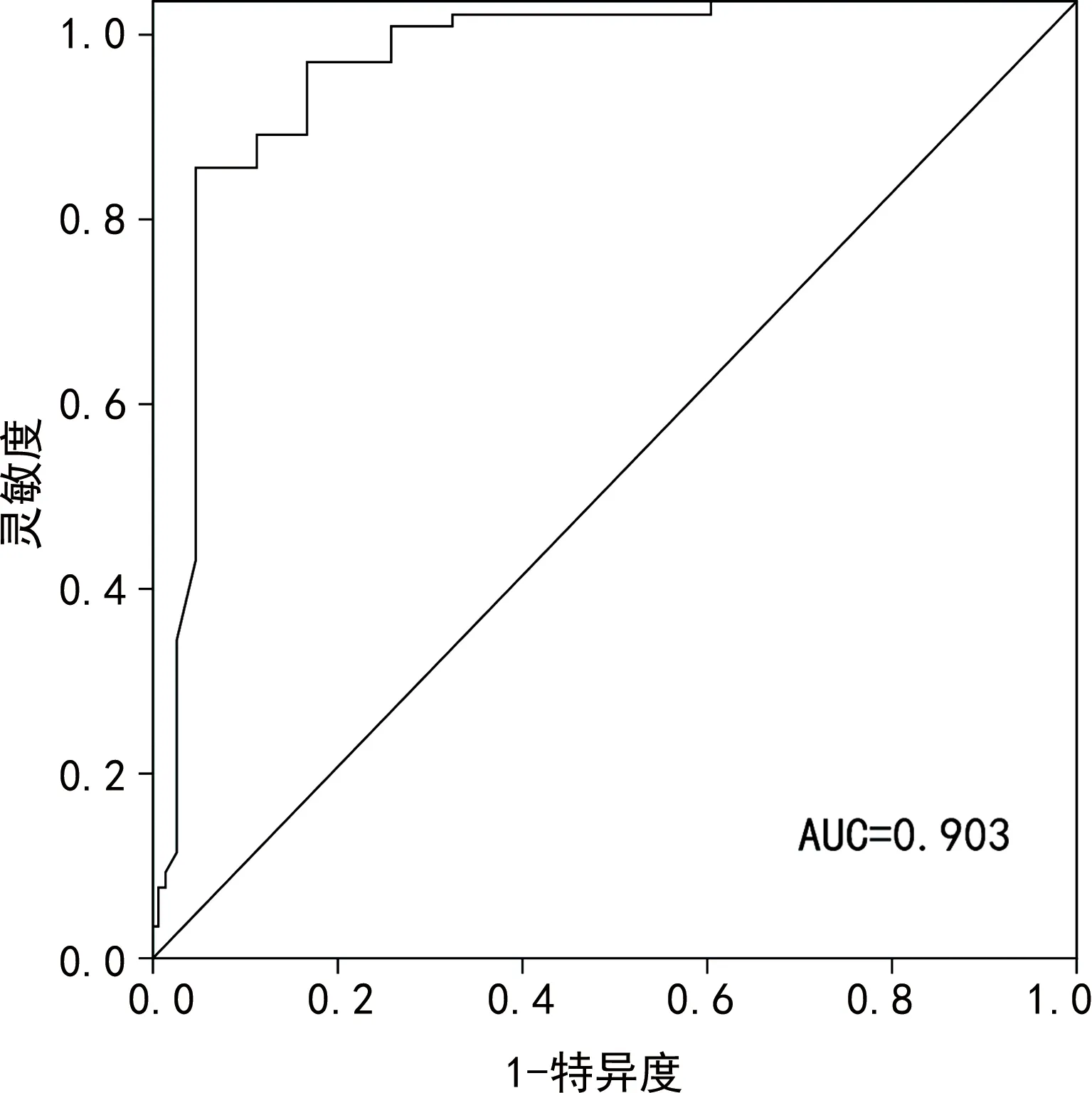
图1 miR-96预测NS患儿预后的ROC曲线图
3 讨 论
由于新生儿各免疫器官、脏器不成熟,皮肤黏膜屏障功能差,获得性免疫及固有免疫共同缺陷,加之受中心静脉置管等有创操作影响,易发生感染,进展为NS[9]。研究发现,炎症信号通路的级联放大及激活,造成炎症细胞因子过度释放是诱发NS的主要机制之一[10]。因此,防治NS疾病及提升预后的关键在于维持机体内抗炎因子、促炎因子间平衡、抑制促炎因子表达。已有研究发现,miR-16、miR-21、miR-150、mR-146等多种miRNA通过作用于炎症通路的重要基因而参与炎症发展过程中[11-12]。
miRNA属于一种易感基因,通过与目标mRNA的3′-UTR区相结合,诱导目标mRNA降解,调节靶基因蛋白和mRNA表达,进而参与细胞血管生成、分化、凋亡等生物学过程中[13]。WANG等[14]研究发现,miRNA参与调节炎性细胞及介质的表达过程中,通过靶控相关信号通路及免疫功能而影响脓毒症的发生、发展。miR-96为miR-183家族成员,定位于人类染色体7q32,在多种肿瘤中异常表达。SINGH等[15]研究报道,miR-96高表达可抑制相关靶基因转录后蛋白表达,降低炎症反应,干扰相关免疫通路。LU等[16]研究发现,miR-96在脓毒症致肾损伤患者中呈异常表达,且其调节的靶基因主要参与Wnt信号通路及Ⅰ组代谢型谷氨酸受体通路、白细胞介素信号通路的调控中。本研究结果发现,相比非感染性SIRS组、健康组,NS组血清miR-96 mRNA表达较低,证实NS患儿血清miR-96水平下调,这可能与炎症因子表达和炎症细胞的浸润通过TLR/IL-1β或NF-κB信号通路而调节miR-96表达有关。陈建德t[17]研究发现,miR-96在NS患儿血清中呈低表达,预测免疫相关基因为IL-16、CD4、IL-17B、TNFRSF13B等,在NS炎症反应、免疫调节及宿主免疫应答中发挥重要作用,与本研究结论基本一致。
NS从本质上来说是机体对感染性因素的反应,疾病发生时会大量释放细胞因子、血管活性物质、氧自由基、急性期反应物质、趋化因子等,破坏抗炎因子、促炎因子之间平衡,进而导致机体免疫功能受损[18-19]。本研究结果发现,NS组血清IL-1β、IL-6、TNF-α水平比非感染性SIRS组、健康组高,提示NS患儿血清炎性因子水平上调,机体处于感染状态,体内抗炎及促炎反应系统紊乱。黄林枫等[20]研究结果显示,脓毒症组IL-6、IL-10、TNF-α表达明显高于非感染性SIRS组和对照组,与本研究结果基本一致。Pearson相关分析结果显示,miR-96表达水平与IL-1β、IL-6、TNF-α水平均呈负相关,由此可以推测miR-96可通过调节炎症反应而参与NS发生中。原因可能在于miR-96作用于IL-16、PTGS2、CD4、IL-17B等多个靶点,并调控NF-κB信号通路,触发多种级联反应,影响免疫细胞的分化、调节过程,进而负反馈调节免疫炎症反应,从而控制炎症反应。miR-96通过不同的作用机制影响NS患儿的炎症反应,从而在不同预后转归的患儿中得到体现,本研究中,死亡组血清miR-96表达水平比存活组低,miR-96预测NS患儿病死率的AUC为0.903,灵敏度、特异度、约登指数分别为0.894、0.855、0.749,故早期监测血清miR-96表达水平变化可有效预测患儿近期预后,对NS预后评估具有重要意义,且利于指导临床对应治疗。
综上所述,NS患儿血清miR-96水平下调,炎性因子水平上调,二者呈负相关;且miR-96水平对NS预后有一定的预测价值,有望成为基因转录水平早期诊断NS及评估预后的新型生物标志物。但由于病例数相对较少,产生的统计学结果可能存在一定偏倚,故后期还需扩大样本量及延长随访时间,进一步验证血清miR-96表达水平与NS炎性因子及预后的关系;此外,还需从分子生物学角度深入分析miR-96是通过何种信号通路而影响炎症反应,以进一步明确miR-96在NS患儿致病过程中的作用机制。

