基于外泌体中基因序列构建miRNA-mRNA预测复治肺结核特异的关键基因
徐振华,李奇凤,王 泉
1.北京儿童医院新疆医院/新疆维吾尔自治区儿童医院/新疆儿科研究所,新疆乌鲁木齐 830054;2.新疆医科大学第八附属医院检验科,新疆乌鲁木齐 830049
外泌体是从体内细胞释放的直径为40~160 nm源于内吞体的囊泡,包括蛋白质、脂质、mRNA及非编码RNA和DNA等。外泌体可以将其内含物(尤其是miRNA)释放到邻近和远端细胞中,参与体内很多生物反应,如细胞与细胞之间信号通信,基因转录和翻译的调控,免疫反应平衡和中枢、外周免疫调节,受体配体信号,细胞分化和肿瘤,宿主-微生物群的相互作用和病毒免疫等。然而,本文通过对初治肺结核(ATB)和复治肺结核(RTB)外泌体进行富集提取、建库测序和生物信息分析来预测相关靶向调控,借助生物信息学构建miRNA-mRNA的关系,在分子水平上把控复治肺结核特异表达的关键基因,为新的药物研发提供思路和理论支撑。
1 资料与方法
1.1一般资料 收集ATB和RTB患者和健康对照者(HC)的新鲜外周血,离心后取血浆,行血浆外泌体检测、建库、测序,每份标本形成相应的数据库。根据所建外周血外泌体数据库获取相应的差异表达miRNA和mRNA。使用R语言“edgeR”包对所建肺结核外泌体数据进行差异表达分析,以|log2FC|≥2,FDR<0.05为条件筛选差异miRNA,调用enhancedvolcano R包绘图,使用DESeq2进行差异表达分析。
1.2外泌体RTB特异性差异表达miRNA和mRNA筛选 miRNA差异表达的数据输入为miRNA表达水平分析中得到的readcount数据。对于有生物学重复的样品,采用基于负二项分布的DESeq2进行分析;对于无生物学重复的样品,DEGseq会采用TMM算法对readcount数据进行标准化处理,然后进行差异分析,筛选RTB特异性差异表达miRNA和mRNA,用韦恩图来表示。
1.3差异表达 miRNA下游靶基因的预测 通过miRNet数据库预测差异表达miRNA在RTB特异性下游靶基因。
1.4功能富集分析和蛋白-蛋白相互作用(PPI) 网络 使用可视化软件Cytoscape绘制miRNA-mRNA调控网络图。利用在线网站 STRING 11.0(https:// string-db.org/)构建靶基因之间相互作用,并使用Cytoscape核心插件cytohubba筛选Degree数最高的前20个靶基因进行后续分析。
2 结 果
2.1从外泌体所建数据库中筛选出ATB和RTB差异表达miRNA共1 408个基因(如图1A)。
2.2ATB和RTB差异表达 miRNA的韦恩图 ATB和RTB差异表达miRNA的以log10值进行聚类,ATB的差异表达miRNA和RTB的差异表达miRNA取交集得到19个共表达差异表达miRNA,ATB中有92个独立差异表达miRNA,RTB中有11个独立差异表达miRNA(图1B)。
2.3RTB特异的差异表达miRNA下游靶基因预测 通过miTarbare和miRanda数据库共筛选出RTB特异的差异表达miRNA下游靶基因预测为375个(图1C)。
2.4RTB特异的差异表达miRNA下游靶基因进行功能富集分析(GO)和信号通路富集分析(KEGG) 为了明确筛选出RTB特异的差异表达miRNA下游靶基因的生物学作用,使用GOSeq、topGO、hmmscan软件对 375个RTB特异的差异表达miRNA下游靶基因进行GO和KEGG途径富集分析。在 GO 功能注释中,由于基因较多对GO中前10位基因进行功能注释,生物过程分析揭示目标基因在三酰甘油生物合成和代谢过程中的正调控、肠道胆固醇吸收、膜组织等较多富集;分子功能分析目标基因在RNA聚合酶Ⅲ复合物、U2型催化步骤1剪接体、PRC1复合物、在线粒体外层的整体膜蛋白等富集;细胞成分分析表明目标基因明显富集于双链端粒DNA结合蛋白、蛋白酶结合、小GTP酶结合蛋白、端粒DNA结合蛋白等富集(图1D)。KEGG 途径富集分析结果显示:目标基因在mRNA监测通路、单纯疱疹病毒1型感染、非同源端连接、色氨酸代谢、脂肪消化和吸收等富集(图1E)。
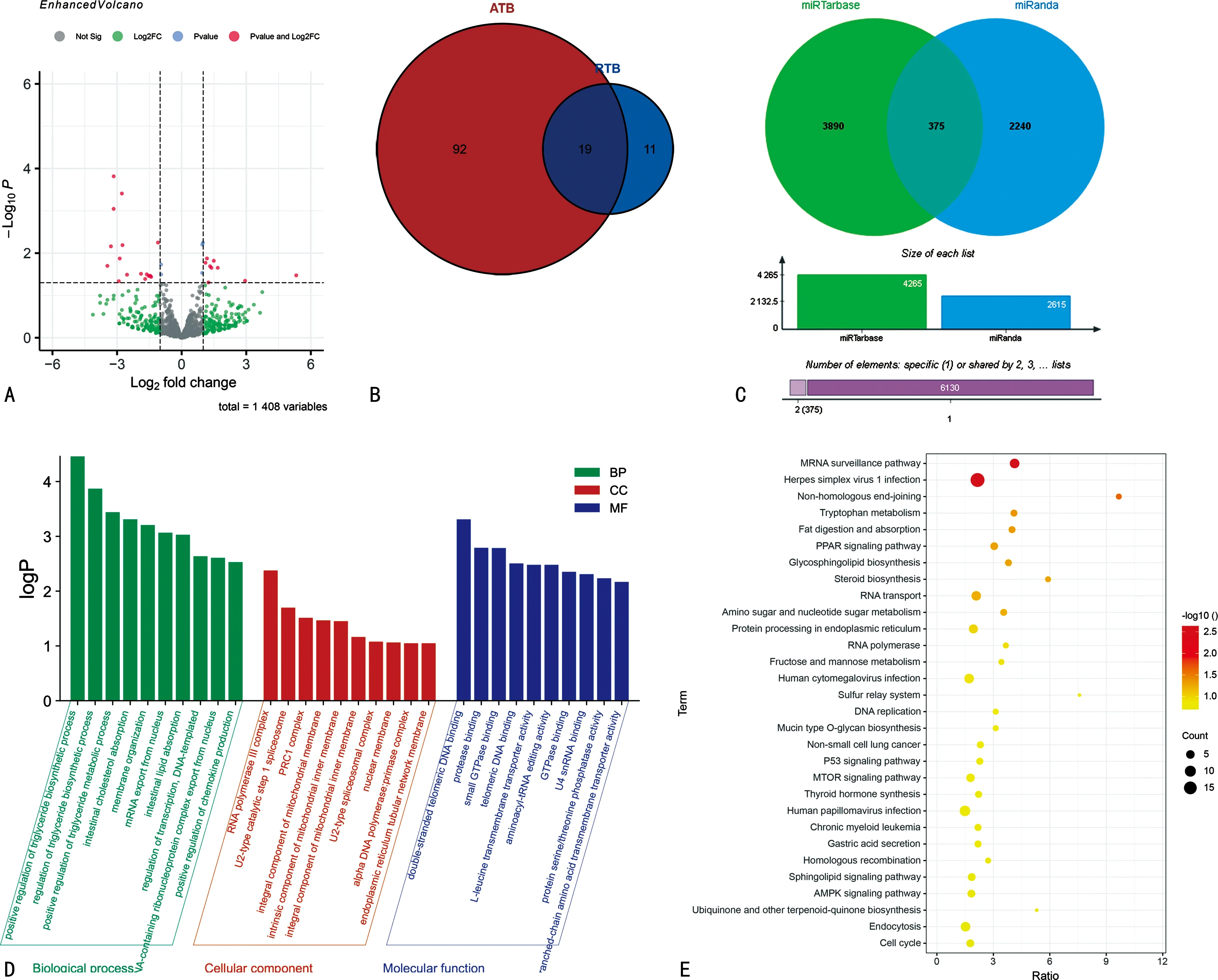
图1 RTB特异的差异表达miRNA获得及下游靶基因的富集过程注:A为ATB和RTB所筛选差异表达miRNA的火山图;B为ATB和RTB差异表达miRNA的韦恩图;C为RTB特异的差异表达miRNA下游靶基因预测;D为RTB特异的差异表达miRNA下游靶基因GO富集柱状图;E为RTB特异的差异表达miRNA下游靶基因KEGG富集散点图。
2.5从外泌体所建数据库中筛选出ATB和RTB差异表达mRNA共4 432个基因(图 2A)。
2.6ATB和RTB差异表达mRNA的韦恩图 ATB和RTB差异表达mRNA的以log10值进行聚类;ATB的差异表达miRNA和RTB的差异表达mRNA取交集得到94个共表达差异表达mRNA,ATB中有201个独立差异表达mRNA,RTB中有308个独立差异表达mRNA(图2B)。
2.7RTB特异的差异基因mRNA的功能富集分析和信号通路富集分析 为了明确筛选出目标基因的生物学作用,使用GOSeq、topGO、hmmscan软件对 308个RTB特异的差异表达mRNA靶基因进行 GO功能注释和 KEGG 途径富集分析。在 GO 功能注释中,由于基因较多对GO中前10位基因进行功能注释,生物过程分析揭示目标基因在蛋白质去磷酸化的负调控、对线粒体上蛋白质定位建立的正调控、中性粒细胞脱颗粒、中性粒细胞的激活涉及免疫应答等富集;分子功能分析目标基因在细胞核、细胞内膜结合细胞器、细胞-底物连接、肌动蛋白细胞骨架等富集;细胞成分分析表明目标基因明显富集于RNA结合蛋白、单链端粒DNA结合蛋白、核苷—三磷酸酶活性、激酶结合等(图2C)。KEGG 途径富集分析结果显示:目标基因在人类T细胞白血病病毒1型感染、细胞衰老、血小板活化、神经变性通路肌萎缩性侧索硬化症等富集(图2D)。
2.8RTB特异的差异表达miRNA的靶基因韦恩图 对RTB特异的差异表达mRNA与RTB特异的差异表达 miRNA 预测的靶基因进行综合分析后取交集,共有8个靶向目标基因(图2E)。
2.9PPI网络的建立与分析 将所有目标基因导入 String 数据库中,构建目标基因的PPI网络,再将数据输入到BLAST软件建立一个更直观的 PPI 网络,并根据网络拓扑分析得出前20个关键基因,包括高表达RTB特异的差异表达基因 miRNA 的靶基因:PABPC1、EEF1A1、VCP、HNRNPA1;低表达RTB特异的差异表达基因 miRNA 的靶基因:DDX17、MAPK14、FLNA、TPT1、POLR2E(图2F)。

图2 RTB特异差异表达mRNA获得及富集和目标基因PPI网络注:A为ATB和RTB差异表达mRNA加强火山图;B为ATB和RTB差异表达mRNA的韦恩图;C为RTB特异的差异蛋白基因mRNA的GO富集图;D为RTB特异的差异基因mRNA的KEGG富集图;E为RTB特异的差异表达imRNA的靶基因韦恩图;F为RTB特异的PPI调控网络。
3 讨 论
RTB指既往不规律抗结核治疗≥1个月以及初治失败和复发的肺结核患者[1],是耐药肺结核传播的重要来源。寻找RTB的病因、发病机制对解决耐药肺结核显得尤为重要,同时也为治疗RTB提供新型的方案。本研究中通过构建外泌体基因序列中miRNA-mRNA的关系揭示RTB在分子水平上调控机制。
在耐药情况、影像学改变和免疫功能检查等方面,RTB和ATB患者有不同程度的区别。有研究报道,与ATB相比,RTB患者对利福平耐药率更高[2]。曹盼等[3]报道,利福平耐药RTB比ATB患者空洞数量多、最大内径大。同时,空洞壁钙化、肺实变、毁损肺等CT表现也比初治患者严重。ATB和RTB患者体内存在不同程度的淋巴细胞亚群改变[4],其中T淋巴细胞亚群、NK细胞比例与肺结核患者所处不同感染阶段有一定的关联性。RTB和ATB不仅在以上情况有不同,而且在基因表达数量上不一样。本研究通过ATB和RTB差异表达miRNA的聚类分析显示RTB中有11个独立差异表达miRNA,ATB中有92个独立差异表达miRNA。进一步预测RTB特异性差异表达miRNA下游靶基因有375个,并对此基因进行GO和KEGG,富集分析揭示目标基因在三酰甘油生物合成、代谢过程中的正调控、肠道胆固醇吸收等脂质代谢改变;RNA聚合酶Ⅲ复合物、U2型催化步骤1剪接体、小GTP酶结合蛋白、端粒DNA结合蛋白、在线粒体外层的整体膜蛋白等参与基因转录和翻译方面调节。有研究结果显示,在Mtb休眠和重新激活期间,参与不同阶段能量代谢的蛋白质相对数量是不同的,例如不同的酸度、渗透压和营养缺乏等微环境[5]。结核分枝杆菌为能够在复治和初治状态之间切换,通过改变其代谢网络的路线,以响应不同的感染阶段。结核分枝杆菌为了其生存和在限制条件下的宿主体内保持持久性必然要表现出代谢功能的多面性。作为异养生物,Mtb能够代谢多种碳源,这些碳源可由细菌合成或从宿主细胞获得[6-8]。
本研究对RTB特异性差异表达miRNA下游靶基因预测并进行富集分析,结果显示在脂质代谢和基因转录和翻译等方面进行调控,说明RTB患者通过在能量代谢和基因表达等方面做出改变迎合所处环境。对目标基因mRNA的富集分析提示目标基因mRNA和差异表达miRNA预测的下游基因的富集分析互相适用、相互补充功能调控RTB发生和发展,这为以后研发治疗RTB新型的抗结核药物提供了靶点。
在本研究构建的miRNA-mRNA调控网络模型中,得到9个显著高低表达靶基因,可能在RTB中发挥重要的生物学作用。PABPC1参与mRNA翻译[9-10],高腺苷酸化[11],无义介导的衰变[12]和替代多腺苷酸化[13]等多种体内调节。有研究报道PABPC1将hnRNPLL招募到RNA的3′末端,并通过mRNA替代多腺苷酸化调节并调节浆细胞中从mIg到sIg的转变,证实浆细胞特异性RBP和普遍表达的RBP(PABPC1)之间的相互作用共同调节B细胞中免疫球蛋白分泌,其高表达可增强RTB中免疫球蛋白对结核分枝杆菌杀伤[14]。真核翻译伸长因子-1α1(eEF1A1)负责核糖体蛋白合成[15],与伴侣介导的自噬[16]和细胞凋亡[17]有关,eEF1A1与PARP1和TXK形成复合物可作为Th1细胞特异性转录因子,结合IFN-γ的启动子以直接调节IFN-γ转录,因此其与Th1细胞因子的产生密切相关[18]。有研究提出eEF1A1与FadD13结合对于巨噬细胞中的Mtb增殖和在Mtb感染期间促炎细胞因子的产生起着关键作用[19],敲低eEF1A1可消除由FadD13诱导的促炎细胞因子。DDX17是一种RNA依赖性ATP酶,与病毒感染和免疫应答密切相关[20-22]。而本研究显示DDX17在RTB低表达,其参与RTB发生、发展的调控。众所周知,MAPK包括MAPK1-MAPK3、JNK和p38 MAPK,均与自噬调节有关。MAPK14直接磷酸化苏氨酸75的ATG5激活导致自噬体-溶酶体融合损伤,从而损害了自噬[23]。这和本研究相符,通过PPI网络分析MAPK14在RTB中低表达,从而有利于自噬参与细胞稳态,发育和免疫等代谢机制,促进RTB的发生、发展。更有研究进一步证实,氧化应激在自噬抑制后介导MAPK14信号传导和DNA损伤标志物方面可能起作用[24]。
综上所述,通过外泌体构建miRNA-mRNA预测RTB特异性关键基因,这为今后探寻RTB分子机制、研发新型基因药物提供靶点和思路,但本研究不足之处在于没有验证关键基因在RTB组织中的表达,进一步证实该基因是否存在组织中,下一步研究完善相关验证。
——外泌体与老年慢性疾病相关性的研究进展

