某三甲医院2017-2021年细菌耐药率监测分析
全 念,唐 朋,黄微微,张立群
陆军军医大学第二附属医院检验科,重庆 400037
抗菌药物的产生成为抗感染治疗史上最伟大的里程碑,但制造新的抗菌药物已远远赶不上细菌耐药的速度,动态监测细菌耐药率的变迁,系统性分析细菌分布,建立定期的耐药监测制度和菌属档案,是减少细菌耐药及合理使用抗菌药物的基础,也是防止耐药菌株暴发流行的必要手段[1],可以让临床医护人员动态了解细菌耐药变化信息,避免细菌进一步耐药的产生[2]。现总结本院2017-2021年细菌耐药监测数据,对检出的菌落数量、分布情况和药敏结果进行分析,为指导临床更精准科学地应用抗菌药物提供参考。
1 材料与方法
1.1细菌来源 来源于本院2017-2021年临床分离的需氧菌(厌氧菌、真菌和分枝杆菌除外)共计24 177株,剔除同一患者检测出的重复菌株。质控菌株为大肠埃希菌ATCC25922,金黄色葡萄球菌ATCC29213,铜绿假单胞菌ATCC27853,粪肠球菌ATCC29212,均购自国家卫生健康委员会临床检验中心。
1.2试剂 麦康凯琼脂平板和嗜血杆菌巧克力琼脂平板购于郑州安图生物工程股份有限公司,哥伦比亚血琼脂平板购于重庆庞通医疗有限公司。药敏纸片为英国OXOID产品,E-test试纸条购于意大利Liofilchem产品。
1.3研究方法
1.3.1细菌鉴定 采用美国BD公司的Phoenix100检测系统和Microflex LT/SH质谱仪进行细菌鉴定。
1.3.2药敏试验 普通细菌药敏分析采用Phoenix100检测系统,链球菌和流感嗜血杆菌等药敏试验采用纸片扩散法,特殊耐药表型采用E-test法复核。药敏试验结果判断标准参照美国临床和实验室标准化研究所(CLSI)M100-S30标准[3]。
1.4统计学处理 使用WHONET5.6软件对菌株情况、抗菌药物耐药率进行筛选、计算和排序,并利用SPSS19.0统计软件,对N≥40且T≥5的资料采用χ2检验进行对比,对N<40或T<5的资料采用Fisher确切概率法进行比较,以P<0.05为差异有统计学意义。
2 结 果
2.1菌群分布 5年共分离出24 177株细菌,其中革兰阴性菌16 223株(67.1%),革兰阳性菌7 954株(32.9%)。大肠埃希菌4 477株、肺炎克雷伯菌2 916株、铜绿假单胞菌2 290株、鲍曼不动杆菌2 018株、流感嗜血杆菌950株,分别位居革兰阴性菌的前5名;金黄色葡萄球菌2 329株、凝固酶阴性葡萄球菌2 133株、肺炎链球菌711株、粪肠球菌548株、屎肠球菌483株,分别位居革兰阳性菌的前5名。2017-2021年各类病原菌分布情况见表1。
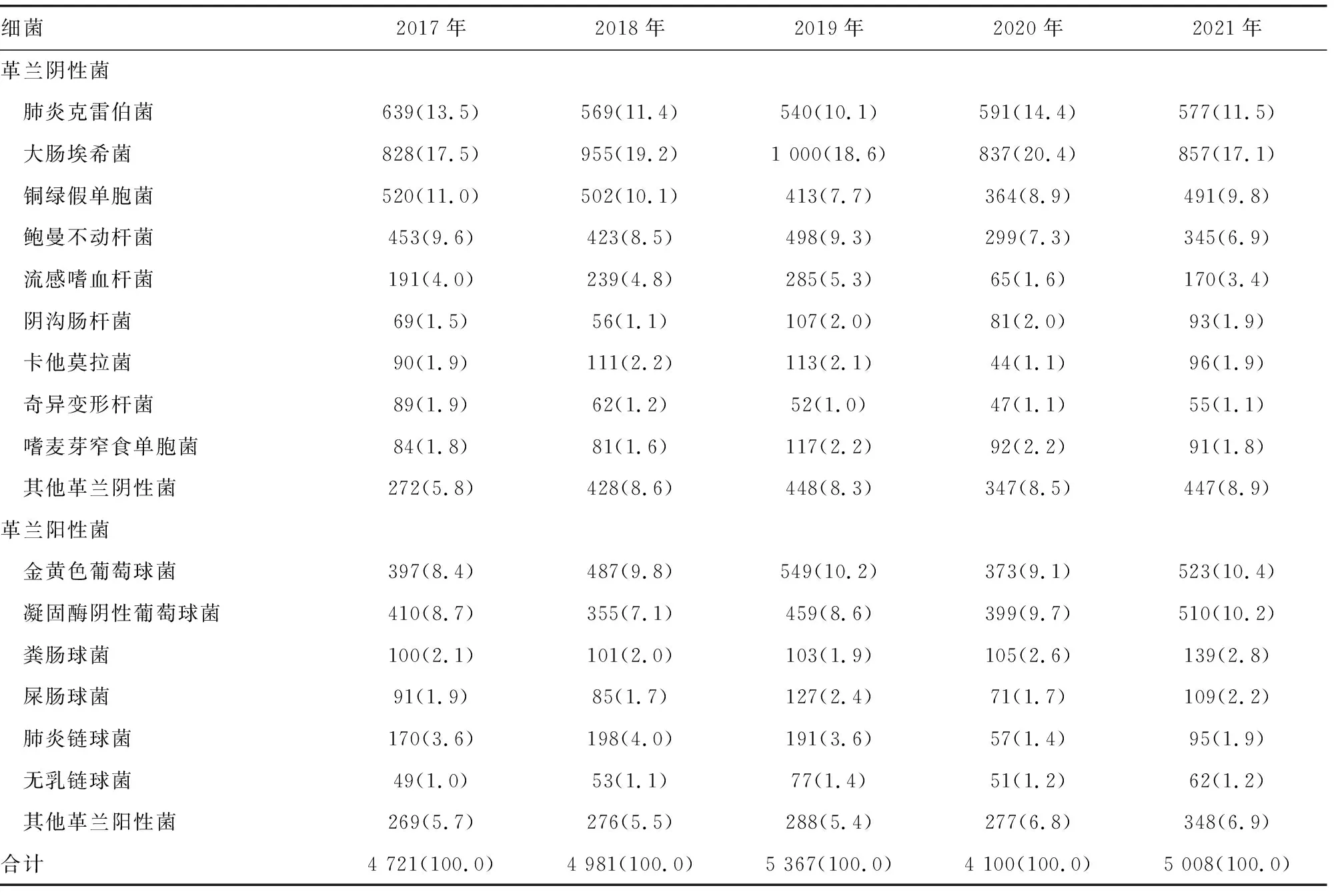
表1 2017-2021年各类病原菌分布情况[n(%)]
2.2标本来源 分析24 177株病原菌来源情况,呼吸道分泌物分离占31.9%;尿液分离占21.7%;血液分离占12.0%;伤口分泌物分离占9.4%;腹腔液分离占2.5%;脓液分离占2.5%等。具体来源分布见表2。
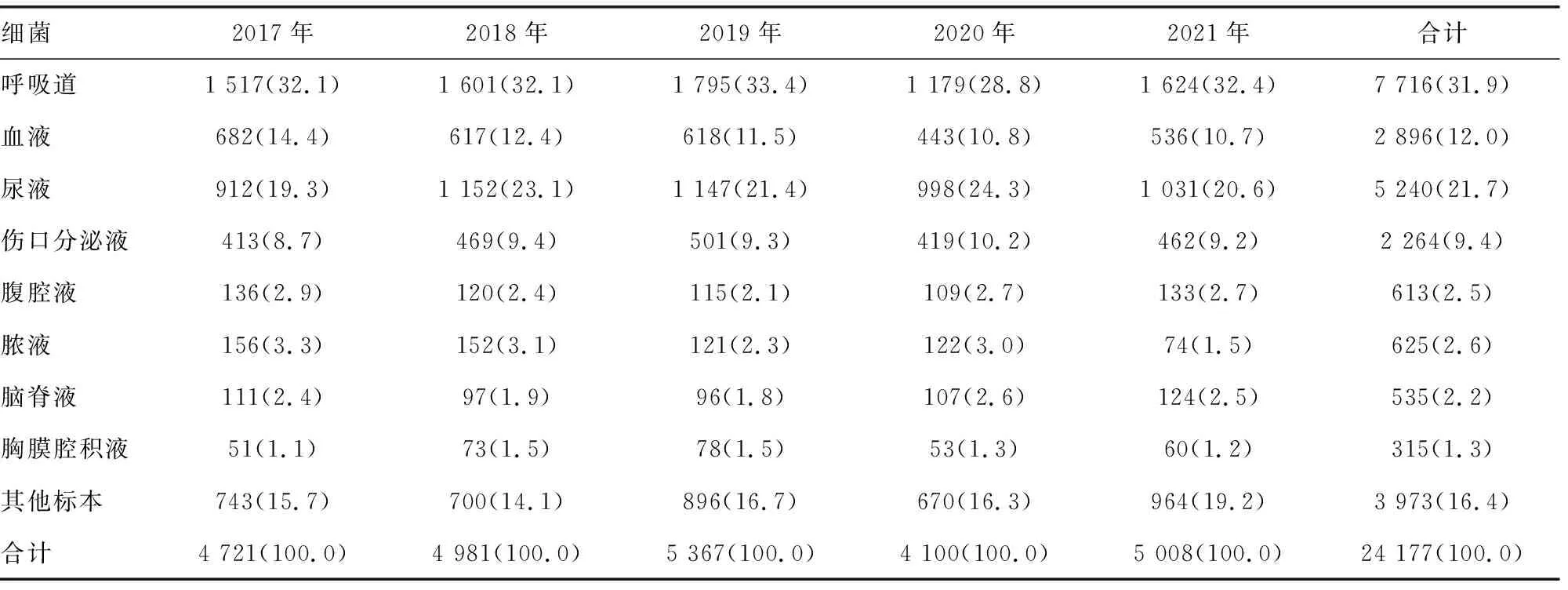
表2 2017-2021年本院分离细菌标本来源[n(%)]
2.3各类病原菌耐药率监测
2.3.1各类耐药菌检出情况 2017-2021年耐甲氧西林金黄色葡萄球菌(MRSA)和甲氧西林耐药的凝固酶阴性葡萄球菌(MRCNS)的检出率分别为24.8%(577/2 329)和64.4%(1 373/2 133)。耐碳青霉烯大肠埃希菌(CR-ECO)检出率逐步升高(P<0.05);MRCNS、耐碳青霉烯肺炎克雷伯菌(CR-KPN)、耐碳青霉烯铜绿假单胞菌(CR-PA)和耐碳青霉烯鲍曼不动杆菌(CR-AB)检出率有下降趋势(P<0.05);耐万古霉素肠球菌连续5年检出率均为0,差异无统计学意义(P>0.05)。见表3。
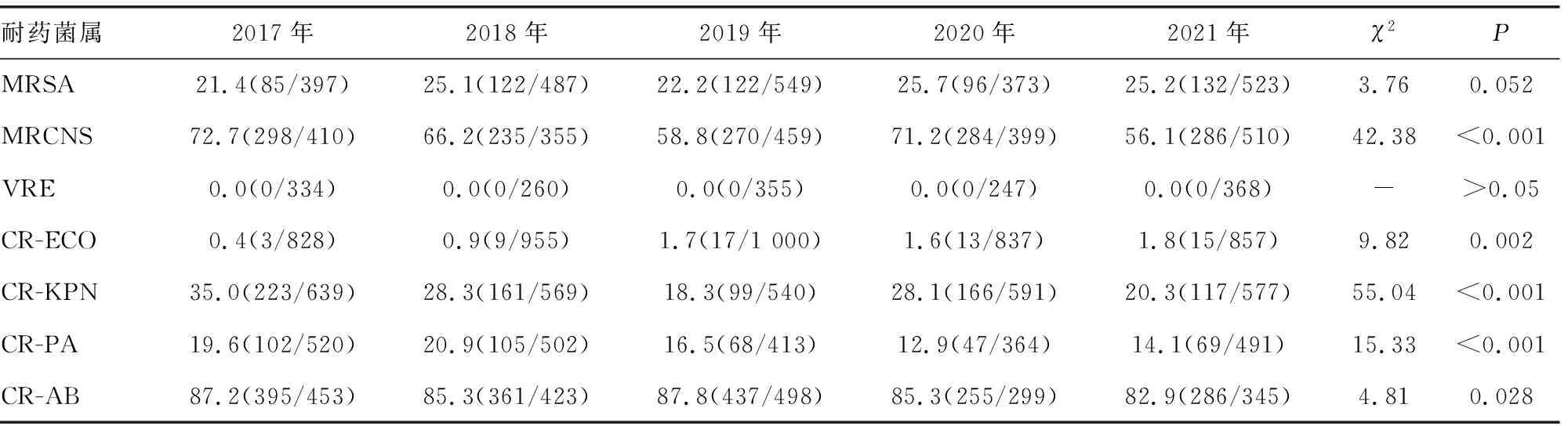
表3 各类耐药菌检出情况[%(n/n)]
2.3.2革兰阳性菌检测 MRSA对青霉素G、氨苄西林、苯唑西林、庆大霉素、利福平、环丙沙星、复方磺胺甲噁唑、克林霉素、红霉素和奎奴普丁/达福普汀的耐药率分别高于甲氧西林敏感的金黄色葡萄球菌(MSSA); MRCNS对上述抗菌药物耐药率,除奎奴普丁/达福普汀外,也显著高于甲氧西林敏感的凝固酶阴性的葡萄球菌(MSCNS),差异有统计学意义(P<0.05),见表4和表5。近5年以来,MRSA对庆大霉素、利福平、克林霉素的耐药率在逐年降低,MRCNS对庆大霉素、利福平、复方磺胺甲噁唑、克林霉素、红霉素的耐药率也在逐年降低,差异均有统计学意义(P<0.05);同期屎肠球菌对氨苄西林、红霉素、呋喃妥因、氟喹诺酮类的耐药率均显著高于粪肠球菌,但其对四环素耐药率较低,差异均有统计学意义(P<0.05),见表6。

表4 2017-2021年本院金黄色葡萄球菌耐药率分析(%)

表5 2017-2021年本院凝固酶阴性葡萄球菌耐药率分析(%)

表6 2017-2021年本院粪肠球菌和屎肠球菌耐药率分析(%)
2.3.3革兰阴性菌检测 5年间大肠埃希菌产超广谱β-内酰胺酶(ESBL)菌株和肺炎克雷伯菌产ESBL菌株的检出率逐年下降。大肠埃希菌对哌拉西林、四环素的耐药率均较高(>66.0%),对哌拉西林/他唑巴坦、头孢哌酮/舒巴坦、阿米卡星、亚胺培南、美洛培南、替加环素的耐药率较低(<6.0%)。肺炎克雷伯菌对头孢呋辛的耐药率较高(>39.0%),对米诺环素的耐药率正在不断上升,由2017年的12.6%上升到2021年的23.7%;肺炎克雷伯菌对哌拉西林、四环素、复方磺胺甲噁唑、头孢呋辛、头孢哌酮、头孢噻肟、环丙沙星、左旋氧氟沙星、庆大霉素的耐药率低于大肠埃希菌,但对氨曲南、氨苄西林/舒巴坦、氯霉素、头孢他啶、米诺环素、阿莫西林/克拉维酸、头孢哌酮/舒巴坦、阿米卡星、亚胺培南、美洛培南的耐药率明显更高(P<0.05)。铜绿假单胞菌对抗菌药物的耐药率相对较低。鲍曼不动杆菌对多黏菌素B的耐药率低于1.0%,对其他抗菌药物的耐药率均较高,对头孢哌酮/舒巴坦的耐药率有升高趋势,近两年达到55.0%以上。见表7、8。
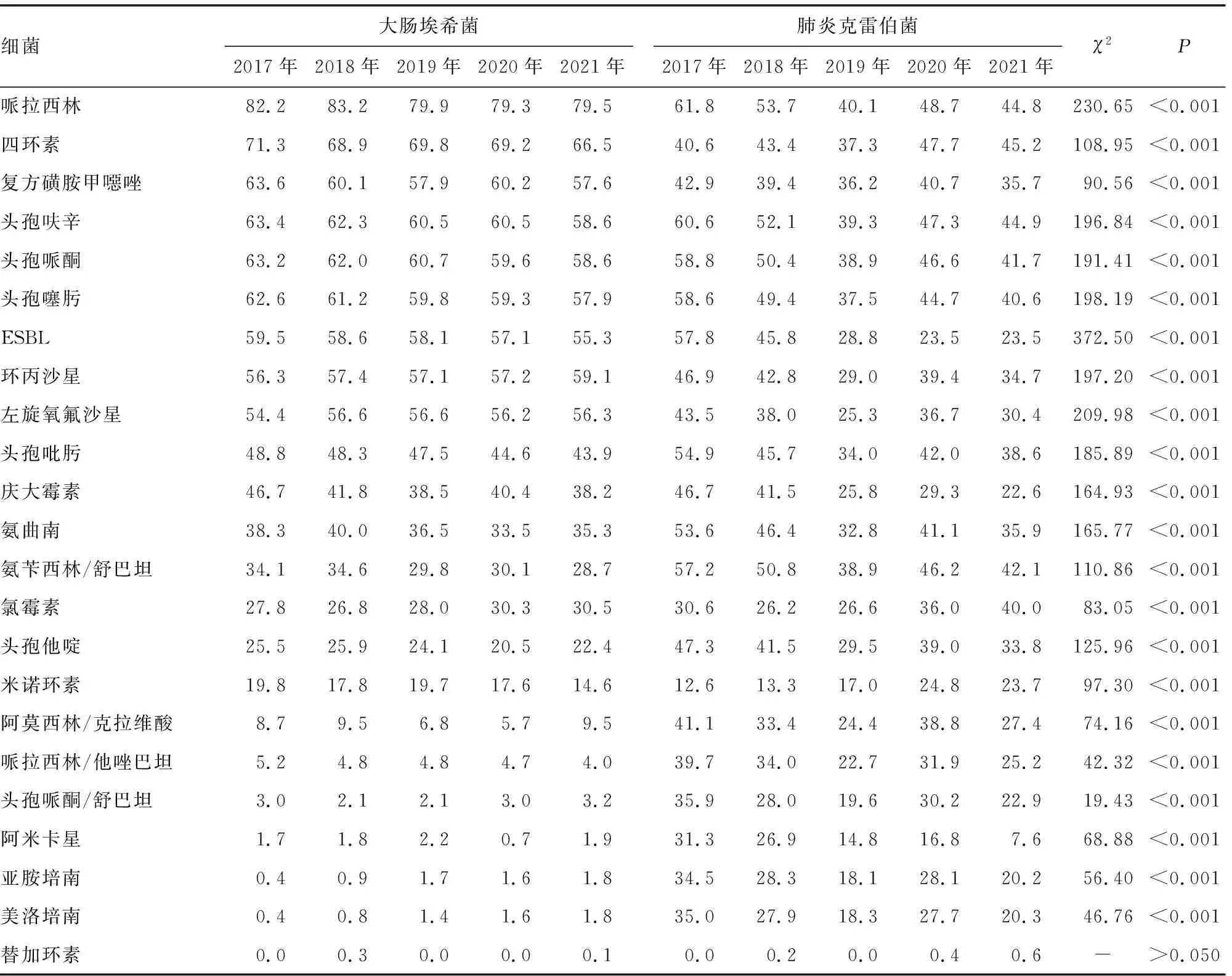
表7 2017-2021年本院大肠埃希菌和肺炎克雷伯菌耐药率分析(%)

表8 2017-2021年本院鲍曼不动杆菌和铜绿假单胞菌耐药率分析(%)

续表8 2017-2021年本院鲍曼不动杆菌和铜绿假单胞菌耐药率分析(%)
3 讨 论
本组资料显示,大肠埃希菌占本院2017-2021年临床分离病原菌首位,其次为肺炎克雷伯菌、金黄色葡萄球菌、铜绿假单胞菌、凝固酶阴性葡萄球菌、鲍曼不动杆菌等。临床分离菌标本来源以呼吸道分泌物、血液和尿液标本为主,其次为伤口分泌物、无菌体液等。CR-ECO和MRSA检出率由2017年的0.4%和21.4%上升至2021年的1.8%和25.2%,CRECO近5年变化趋势与CHINET监测数据[4]一致,而MRSA的变化趋势与CHINET监测数据[4]不同,但两者都应给予足够重视。
在对革兰阳性菌耐药率分析中发现,MRSA对环丙沙星、复方磺胺甲噁唑的耐药率均较低,分别低于17.2%和17.6%,但MRCNS对环丙沙星和复方磺胺甲噁唑的耐药率却高达62.2%和77.2%,所以需要根据不同的药敏情况对于MRSA针对性用药。连续5年的监测,未发现MRSA对利奈唑胺、万古霉素和替考拉宁的耐药菌株,证实上述3种药物是重症患者的首选。屎肠球菌对红霉素、环丙沙星、氨苄西林、呋喃妥因的耐药率明显高于粪肠球菌,而对四环素的耐药率低于粪肠球菌,与国内其他报道结果一致[5],提示对于肠球菌感染的病例,要鉴定至菌种,根据药敏试验结果选用抗菌药物才能起到预期效果。
在对革兰阴性菌耐药率分析中发现大肠埃希菌和肺炎克雷伯菌分别排在分离菌的第一、二位,通常认为大肠埃希菌、肺炎克雷伯菌是医院感染和社区感染的常见致病菌之一[6]。产ESBLs的大肠埃希菌基本稳定在55.0%~60.0%,耐药机制主要为产ESBLs、产β-内酰胺酶、药物外排等[7-8],故本次研究中大肠埃希菌对哌拉西林、头孢噻肟的耐药率比较高,耐药数据与国内报道一致[9]。产ESBLs的肺炎克雷伯菌有逐年下降的趋势。近5年两种细菌的碳青霉烯耐药菌株检出率分别为CR-ECO 0.4%~1.7%,CR-KPN 20.3%~35.0%。CR-ECO虽然检出率均不高,但致病性极强。据报道,在大肠埃希菌中,CR-ECO菌株是血流感染的常见致死病原菌,患者病死率约为50.0%[10],其产生的KPC-2型丝氨酸酶和NDM-1型金属酶等[11]是严重干扰碳青霉烯类抗菌药物作用的主因。肺炎克雷伯菌其产生的KPC和NDM-1型金属酶更是CR-KPN耐受抗菌药物的主要原因[12],而入住ICU,碳青霉烯类、喹诺酮类、糖肽类、β-内酰胺类/β-内酰胺酶抑制剂复合剂等抗菌药物暴露,免疫抑制、手术、机械通气等则是CR-KPN感染的诱因[13]。这就要求临床应积极开展对高危患者的主动筛查,同时加强医务人员手卫生,降低院内感染的可能,并对CR-KPN感染患者进行单间隔离、集中安置或分组护理[14]。
临床常用的抗铜绿假单胞菌药物中,敏感率最高的是阿米卡星,与本研究结果相符。可能与氨基糖苷类修饰酶介导的耐药存在底物特异性和临床较少应用有关。铜绿假单胞菌的耐药机制复杂,易发生诱导耐药,临床应早期根据药敏试验,选用喹诺酮类或含酶抑制剂复方制剂,联合使用氨基糖苷类、碳青霉烯类,为避免过快产生耐药应采取定期及时轮替的原则[15]。同时鉴于鲍曼不动杆菌的高耐药率,临床上建议根据药敏试验结果选择联合用药,以改善预后、减少耐药,国内通常以替加环素或舒巴坦制剂为核心,联合碳青霉烯类、氨基糖苷类、氟喹诺酮类和利福平等药物[16]。
综上所述,纵观本院5年间分离菌株的统计分析及对7种目标监测细菌的耐药数据,总体耐药率呈下降趋势,但MRSA和CR-ECO检出率有上升趋势,总体耐药形势仍不容乐观。临床抗感染治疗时医师、检验师和药师应密切配合,根据药敏试验综合考虑细菌耐药率变迁以及抗菌药物特点,严格控制抗菌药物使用指征,规范临床抗菌药物的使用,减少抗菌药物使用的强度和广度,有效延缓细菌耐药率的产生和发展。

