胎盘生长因子修复大鼠颅骨缺损的效果及对新骨形成的影响
滕伟 范龙坤 庞超 韩海莉
颅骨缺损是神经外科常见疾病之一,发病部位位于头颅骨,一般小于3 cm 的颅骨缺损或位于枕肌、颞肌下的颅骨缺损临床均无明显表现,较大的颅骨缺损患者一般表现为头疼、头晕、恶心、肢体肌力减退等症状,多由开放性外伤、穿通伤、粉碎性扩创术等手术减压、颅骨切除病损等原因造成[1]。随着颅骨缺损患者数量的逐年增加,对于缺损颅骨修复的需求也在不断提高。现阶段治疗颅骨缺损多通过替代材料修复缺损位置[2],Ⅰ型胶原蛋白有机/羟基磷灰石无机复合物是临床常用的修复材料,虽然具有取材方便、骨传导性和骨诱导性较好的优点,但也存在一定的免疫排斥等隐患[3],因此,仍需寻求具有良好生物相容性、降解性、可塑性的理想颅骨缺损修复材料。胎盘生长因子(placental growth factor,PLGF)最早是在1991 年由胎盘cDNA 文库中分离纯化得到[4],可结合血管内皮细胞、滋养层细胞中的酪氨酸酶受体,参与调节血管生长和滋养层细胞自分泌过程[5]。研究发现,PLGF 不仅与胎盘功能有关,表达于胎盘组织、心脏、肝脏、肺等组织中,还参与调节了软骨成骨形成及骨折修复过程[6]。然而,目前尚不清楚PLGF 是否对于颅骨缺损修复也存在较好地促进作用。基于此,本次研究以含PLGF 胶原/羟基磷灰石支架作为颅骨缺损修复材料,观察其修复效果及对新骨形成的影响,现将具体内容报道如下。
1 材料与方法
1.1 材料与试剂 清洁级SD 大鼠15 只,购自武汉大学动物实验中心,3 月龄,体重为(450±50)g;4%水合氯醛购自上海信裕生物科技有限公司;胶原/羟基磷灰石复合材料购自北京奥精医药科技有限公司;PLGF 重组蛋白购自上海泽叶生物科技有限公司;4%多聚甲醛购自天津坤华化工有限公司;苏木精、伊红染液购自美国sigma 公司;乙醇、氨水购自广州化学试剂厂;Trizol 试剂购自日本TaKaRa公司。
1.2 仪器与设备 微型CT 扫描仪购自荷兰皇家飞利浦公司,型号:Brilliance 64;微机控制电子万能试验机购自美国MTS-SANS 公司,型号:CTM4000,位移分辨率0.03 μm;倒置相差显微镜及配套照相系统购自日本Olympus 公司,型号:CKX53;台式高速冷冻离心机购自德国Eraeus 公司,型号:Allegra 64R;RNA 逆转录试剂盒购自日本TaKaRa公司,型号:10T;实时荧光定量聚合酶链式反应(quantitative real-time polymerase chain reaction,qRT-PCR)SYBR®Premix Ex Taq™试剂盒购自日本TaKaRa 公司,型号:11141ES10。
1.3 动物分组及模型构建 采用4%水合氯醛按照0.8 mL/100 g 腹腔注射麻醉大鼠,待麻醉生效后,将大鼠以俯卧位固定于超净操作台上,常规消毒备皮后,沿颅骨中线做2 mm 切口,纵向切开皮肤,分离皮肤、软组织、骨膜,采用骨膜剥离器暴露顶骨,生理盐水冲洗后以矢状缝作为中线,环钻在矢状缝处做直径为 7 mm 全层颅骨临界性缺损,左右两侧间隔3~4 mm,整个操作过程中应避免损伤硬脑膜。显微镜下观察到大鼠颅骨缺损处硬脑膜完整,呈较为规则的圆形,可见血管,无明显骨片残留,术后2 h 大鼠苏醒且活动逐渐恢复,伤口无明显出血及感染则视为造模成功[7]。15 只大鼠随机分为A 组(空白对照组)、B 组(胶原/羟基磷灰石组)、C 组(含PLGF 的胶原/羟基磷灰石组),每组5 只。A 组大鼠颅骨缺损处不做任何处理,B 组大鼠颅骨缺损区植入8 mm×1.5 mm 的胶原/羟基磷灰石支架,C 组大鼠颅骨缺损处植入8 mm×1.5 mm 含有PLGF 的胶原/羟基磷灰石支架(由5 μg/mL PLGF 的微粒掺入胶原/羟基磷灰石支架后冷冻干燥所制成)。
1.4 观察指标及评价标准
1.4.1 Micro CT 扫描 造模后8 周对各组大鼠实施颈椎脱臼处死,取大鼠颅骨损伤部位,4%多聚甲醛固定24 h,采用Micro CT 扫描仪进行扫描,设置参数为:电压50 kV,电流145 mA,层厚为20 μm,扫描时间3.4 s。对扫描获得的图像输入工作站进行标准化重建,获得骨体积(bone volume,BV)、骨矿物质密度(bone mineral density,BMD)和骨体积/组织体积(bone volume/ tissue volume,BV/TV)等骨组织形态计量指标结果。
1.4.2 生物力学测试 取经多聚甲醛固定后的各组大鼠颅骨损伤部位,采用微机控制电子万能试验机对骨组织进行生物力学测试,首先将各组颅骨损伤标本固定于底托上,将压杆垂直对准骨损伤部位,按照0.5 mm/min 加载速度对其进行逐渐加压,记录最大负载力值。
1.4.3 苏木素-伊红染色 取经多聚甲醛固定后的各组大鼠颅骨损伤部位经石蜡包埋后制成组织切片,将组织切片与二甲苯共同孵育后,以100%乙醇溶液清洗10 min,90%乙醇溶液洗10 min,75%乙醇溶液洗10 min 脱蜡,水化10 min 后将切片置于苏木精染色液中浸泡10 min,吸取浮色后以0.1%盐酸分化3 s,氨水返蓝10 min 后浸入伊红染液中处理10 s,洗去浮色后梯度乙醇、二甲苯脱水透明,中性树胶封片,倒置相差显微镜下观察病理损伤情况。
1.4.4 qRT-PCR 检测成骨相关基因的mRNA 相对表达水平 参照文献[8]采用qRT-PCR 法检测各组大鼠成骨相关基因Ⅰ型胶原(type Ⅰ collagen,COLⅠ)、骨桥蛋白(osteopontin,OP)、骨钙素(osteocalcin,OC)、Runt相关转录因子2(Runt related transcription factor 2,Runx2)的mRNA 相对表达水平。具体操作如下:取各组大鼠缺损周围颅骨,去除周围结缔组织在液氮中以研钵研磨成粉,转移至含有1 mL Trizol 试剂的离心管中,轻摇离心管使其充分裂解,4 ℃下高速离心15 min 后留取上清液提取骨组织内的总RNA。使用反转录试剂盒将mRNA 逆转录成cDNA,利用C(t)值相对定量法以GAPDH 作为标准化内参对照,得到目的基因的相对表达量,目的基因引物上下游见表1,设置反应条件:95 ℃ 30 s(变性),60 ℃ 30 s(退火),72 ℃15 s(延伸),扩增循环40 次;95 ℃ 30 s,58 ℃ 30 s,95 ℃ 30 s(溶解曲线)。

表1 目的基因引物上下游
1.5 统计学处理 数据采用SPSS 22.0 软件行统计学分析,计量资料以()表示,两组间比较用t检验,多组间比较采用单因素方差分析,P<0.05 为差异有统计学意义。
2 结果
2.1 各组大鼠影像学观察 造模后8 周A 组大鼠颅骨缺损区域仍呈圆形,边缘清晰,且未见明显新骨形成;B 组大鼠颅骨缺损区域小于A 组,边缘较为模糊,可观察到少量新骨形成;C 组大鼠颅骨缺损程度明显小于A、B 组,缺损基本愈合,可观察到大量新骨形成,见图1。

图1 各组大鼠影像学观察
2.2 各组大鼠病理损伤情况观察 A 组仅有少量成骨细胞活跃,骨缺损区域与宿主骨间的连接由纤维结缔组织完成;B 组较A 组有少量新生骨样组织形成,与骨缺损区域与宿主骨间的连接较为紧密;C组新生骨组织较A、B 两组显著增多,新生骨组织与宿主骨融合程度极高。C 组大鼠组织病理损伤程度显著轻于A、B 两组。
2.3 各组大鼠骨组织形态对比 B 组BV、BMD、BV/TV 等骨组织形态计量指标均优于A 组,C 组BV、BMD、BV/TV 等骨组织形态计量指标均优于A组、B 组,差异均有统计学意义(P<0.05),见表2。
表2 各组大鼠骨组织形态对比()

表2 各组大鼠骨组织形态对比()
*与A 组比较,P<0.05;#与B 组比较,P<0.05。
2.4 各组大鼠生物力学指标对比 A 组、B 组、C组新生骨组织最大负载力值分别为(25.62±3.72)、(54.31±4.68)、(80.27±2.93)N,C 组新生骨组织最大负载力值较A 组、B 组明显偏高,差异有统计学意义(P<0.05)。
2.5 各组大鼠成骨相关基因mRNA 相对表达水平比较 B 组大鼠COLⅠ、OP、OC、Runx2 等成骨相关基因的mRNA 相对表达水平均显著高于A 组,C 组大鼠COLⅠ、OP、OC、Runx2 等成骨相关基因的mRNA 相对表达水平均显著高于A 组、B 组,差异均有统计学意义(P<0.05),见表3。
表3 各组大鼠成骨相关基因mRNA相对表达水平比较[/GAPDH,()]
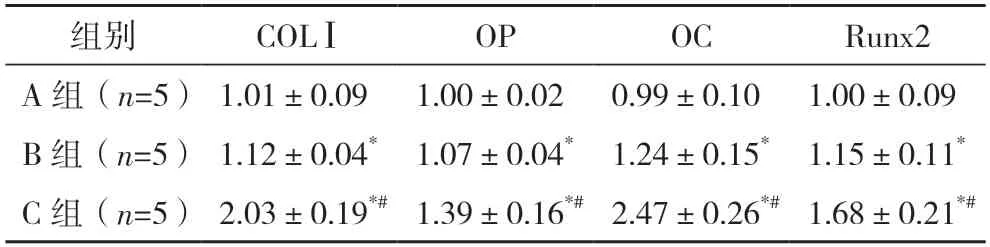
表3 各组大鼠成骨相关基因mRNA相对表达水平比较[/GAPDH,()]
*与A 组比较,P<0.05;#与B 组比较,P<0.05。
3 讨论
颅骨缺损是骨科临床常见多发疾病之一,多由炎症、外伤、肿瘤切除和先天性畸形等因素造成,临床治愈难度较大,治疗方案复杂且周期较长,对于患者日常生活产生极大影响[9]。现价段常用的颅骨缺损修复材料有自体骨和异体骨,两者各有优劣,带有血供的自体骨植入虽然是目前修复颅骨缺损的“金标准”,但也存在供骨量有限,易对患者造成供区损伤或继发畸形等不良后果[10]。而异体骨虽然取材较为便利,不受患者自身局限,但因存在排异反应及传播疾病等安全隐患导致其广泛应用受到制约[11]。随着近些年来医学技术的不断发展和分子生物学、骨组织工程学等学科的飞速进步,人工骨组织再生替代材料支架有望取代传统移植方案,改善颅骨缺损修复,促进骨愈合。
过去几十年里,具有永久性、可降解性、合成性的生物材料被认为具有促进骨缺损修复作用,这些生物材料因具有较好的骨诱导性、传导性、整合性及生物相容性,现已成为骨组织工程的理想材料[12]。胶原是骨组织关键组成成分,因抗原性较小而对于干细胞黏附、增殖和分化有较好的促进作用[13],羟基磷灰石作为天然骨矿物质的一种,具有良好的骨传导性[14]。胶原/羟基磷灰石支架结合了胶原和羟基磷灰石的优良特性,不仅有利于干细胞的生长发育,还提高了支架的骨传导性和生物力学性能[15]。本次研究采用胶原/羟基磷灰石作为基础支架,将PLGF 的微粒掺入其中制备含PLGF 的胶原/羟基磷灰石支架,探究该支架作用于颅骨缺损大鼠模型的作用及其对新骨形成的影响。
PLGF 作为血管内皮生长因子(vascular endothelial growth factor,VEGF)家族的重要成员,位于14q24q31 染色体中,碱基序列与VEGF 具有高度同源性,可通过特异性结合受体VEGFR1 并诱导其磷酸化,激活酪氨酸酶途径将信号传递至胞浆中,进而发挥其独特的生物学特性[16]。PLGF 除了可作为妊娠相关疾病的特异性标志物,还被发现在病理状态下特异性表达于新生血管中,发挥优良的促血管生成作用[17]。本次研究发现,含PLGF 的胶原/羟基磷灰石支架可加速颅骨缺损大鼠骨愈合,减轻模型大鼠的病理损伤,改善BV、BMD、BV/TV等骨组织形态计量指标,提高新生骨组织最大负载力值,上调COLⅠ、OP、OC、Runx2 等成骨相关基因的mRNA 相对表达,促进新骨形成,表明含有PLGF 的胶原/羟基磷灰石支架可改善颅骨缺损模型大鼠的病理损伤,加速骨组织修复和新生。考虑原因有以下几点:(1)PLGF 可诱导血管内皮细胞增殖、分化和迁移,促进单核、内皮细胞的游走,增加血管内皮通透性,进而促进植入支架的血管化和骨化等骨损伤修复的基本环节的进展[18],发挥加速骨愈合和骨形成的作用;(2)外源性PLGF 可通过抑制炎性血管增生发挥抗炎的作用,趋化炎症细胞,清除坏死组织[19],帮助维持植入支架形态结合,为新骨形成提供有利帮助;(3)PLGF 可恢复局部缺血组织的缺血重建,诱导小鼠缺损骨周围组织产生持续存在的血管,从而为支架提供充足的供血、供氧及营养物质[20],进而加速骨愈合和骨形成过程。
综上所述,本次研究通过制备含PLGF 的胶原/羟基磷灰石支架并将其作用于颅骨缺损大鼠模型,证实了其对于模型大鼠颅骨缺损有较好的修复作用,且可诱导新骨形成,表明PLGF 的胶原/羟基磷灰石支架在活体中拥有较好的骨缺损再生能力,在颅骨缺损修复的临床应用中拥有广阔前景。然而,本次研究也存在一定的不足之处,如未进一步了解含PLGF 的胶原/羟基磷灰石支架促进骨缺损再生的具体调控机制,下一步将会进行详细深入地探索。

