地西他滨联合依托泊苷为主方案与单独地西他滨治疗老年骨髓增生异常综合征疗效分析
梁有道,马洁娴,5,吴敏,谢咪雪,陈萍萍,花京剩,沈琳,王小华,杨如玉,张洪娣,邹昭玲,王小钦,叶秀锦,谢彦晖
1.复旦大学附属华东医院血液科,上海 200040;2.浙江大学医学院附属第一医院血液科,浙江杭州 310003;3.复旦大学附属华山医院血液科,上海 200040;4.台州市立医院血液科,浙江台州 317700;5.复旦大学附属华东医院上海市老年医学临床重点实验室,上海 200040;6.南阳市中心医院,河南南阳 473000;7.芜湖市第二人民医院,安徽芜湖 241000
骨髓增生异常综合征(MDS)的特点是髓系细胞发育异常,表现为无效造血、难治性血细胞减少,高风险向急性髓系白血病(tAML)转化[1]。虽然造血干细胞移植是中高危MDS 患者的首选治疗方法,但对于不符合移植条件的患者,化疗仍然是一种重要的手段[2,3,4]。然而高强度化疗又会导致MDS 患者早期高死亡率(约5%~20%)和短生存期(6 ~12 个月)[2⁃4]。近些年来,去甲基化药物与化疗联合治疗MDS 的研究不断涌现。临床工作中发现,由依托泊苷(Etoposide)+阿糖胞苷(Cytarabine)+粒细胞集落刺激因子(G⁃CSF)组成的的CEG 方案联合地西他滨(D +CEG)在治疗老年中高危MDS 时展现出令人满意的效果。目前国内外尚未有关于D +CEG 方案治疗MDS 有效性和安全性的报道。本研究回顾性探索了老年中高危MDS 及MDS 转化AML 患者接受D +CEG 方案和地西他滨单药方案(DECI)治疗的生存获益和安全性。
1 资料和方法
1.1 一般资料
纳入2016年1月至2021年10月个医疗中心(复旦大学附属华东医院,复旦大学附属华山医院,台州市立医院,浙江大学第一附属医院,南阳市中心医院以及芜湖市人民医院)的老年中高危MDS 患者(年龄≥60 岁),分别接受单独地西他滨方案或D +CEG方案治疗。复旦大学附属华东医院伦理委员会批准了本研究(编号:2016K038)。
1.2 患者接受化疗的标准
(1)根据IPSS⁃R 评分诊断为中高危MDS[5];(2)患者符合化疗标准(IPSS⁃R 得分>5);(3)无其他系统难以控制的疾病; (4)按美国东部肿瘤协作组(ECOG)标准评定功能状态0 至2 分; (5)可耐受化疗的肝功能水平(TSB <2 ×正常高限)和肾功能水平(Scr <2 ×正常高限); (6)排除其他进行性恶性疾病、难以控制的精神性疾病和妊娠等。
1.3 治疗方案
D +CEG 方案中,使用地西他滨前12 h 使用G⁃CSF,如血象WBC 计数<4.0×109/L,则给予5 μg/(kg·d)G⁃CSF,如WBC 计数约为4.0 ~10 ×109/L,则给予3 μg/(kg·d)G⁃CSF,如WBC 计数>10 ×109/L,则不使用G⁃CSF。第1 ~3 天静脉给予低剂量地西他滨(15 mg/m2,第1~3 天),从第4 天起每2 天以30 mg/m2的剂量静脉施用依托泊苷。每12 h 皮下注射1 次低剂量阿糖胞苷,剂量为10 mg/m2,在第13 天停止化疗。地西他滨方案为静脉注射地西他滨(15 mg/m2,第1 ~5 天),该方案至少连续4 个疗程后进行评估。
1.4 疗效评估
在治疗开始前进行骨髓涂片、流式细胞学、染色体和基因分析检测,治疗完成后2~3 周行骨髓涂片复查。患者化疗后每3 d 行一次血常规检测。根据MDS 国际工作组(IWG)制定的反应标准,疗效包含完全缓解(CR),血细胞计数未完全恢复的完全缓解(CRi),部分缓解(PR),血液学改善(HI)和无改善(NR)[6]。
1.5 后续治疗和随访
如果在2~4 疗程的化疗后患者达到CR、CRi、PR或HI,则按照原方案完成余下4 个化疗周期,此后第1年每3 个月门诊随访1 次,第2年每半年随访1 次。如果在2 个疗程后无反应或出现疾病进展则更换治疗方案。
1.6 药物毒性、治疗相关死亡评价
患者接受体格检查、血常规(每3 天)、血液生化(每周)、尿常规(每周)和心电图或超声心动图检测(每月)等评估。如在治疗过程中出现白细胞减少或血小板减少高于NCI Ⅱ级水平,则记录为与治疗相关的白细胞或血小板减少。毒性作用及不良反应参照不良反应时间评价标准(NCI⁃CTCAE 4.0)[7]。
1.7 统计学分析
使用SPSS 20.0 软件进行统计分析,如数据符合正态分布则采用t检验。计量资料用均数± 标准差(Mean±SD)来表示,运用秩和检验对患者年龄、血细胞计数等偏态分布的计量资料及危险分层、疗效水平、不良事件等分级资料进行比较,运用卡方检验对患者性别、诊断亚型、染色体核型、突变基因情况等临床特征分类资料进行比较;患者总生存时间(OS)及无症状生存时间(PFS)通过Kaplan⁃Meier 生存分析评估;Log⁃Rank 检验用于比较2 组生存率差异;采用cox回归进行多因素分析。所有检验中P<0.05 代表差异有统计学意义。
2 结果
2.1 患者临床特点
回顾分析了2016年1月至2021年10月共64 例年龄≥60 岁的中高危MDS/tAML 患者,22 例接受地西他滨单药治疗,2 例失访退出,平均年龄(68.5 ±6.4)岁;42 例接受了D +CEG 治疗,1 例中途更换治疗药物退出,平均年龄(67.3 ±6.4)岁。2 组患者的性别、年龄、诊断类型、预后危险度分层、染色体核型、突变基因均无统计学差异(见表1)。
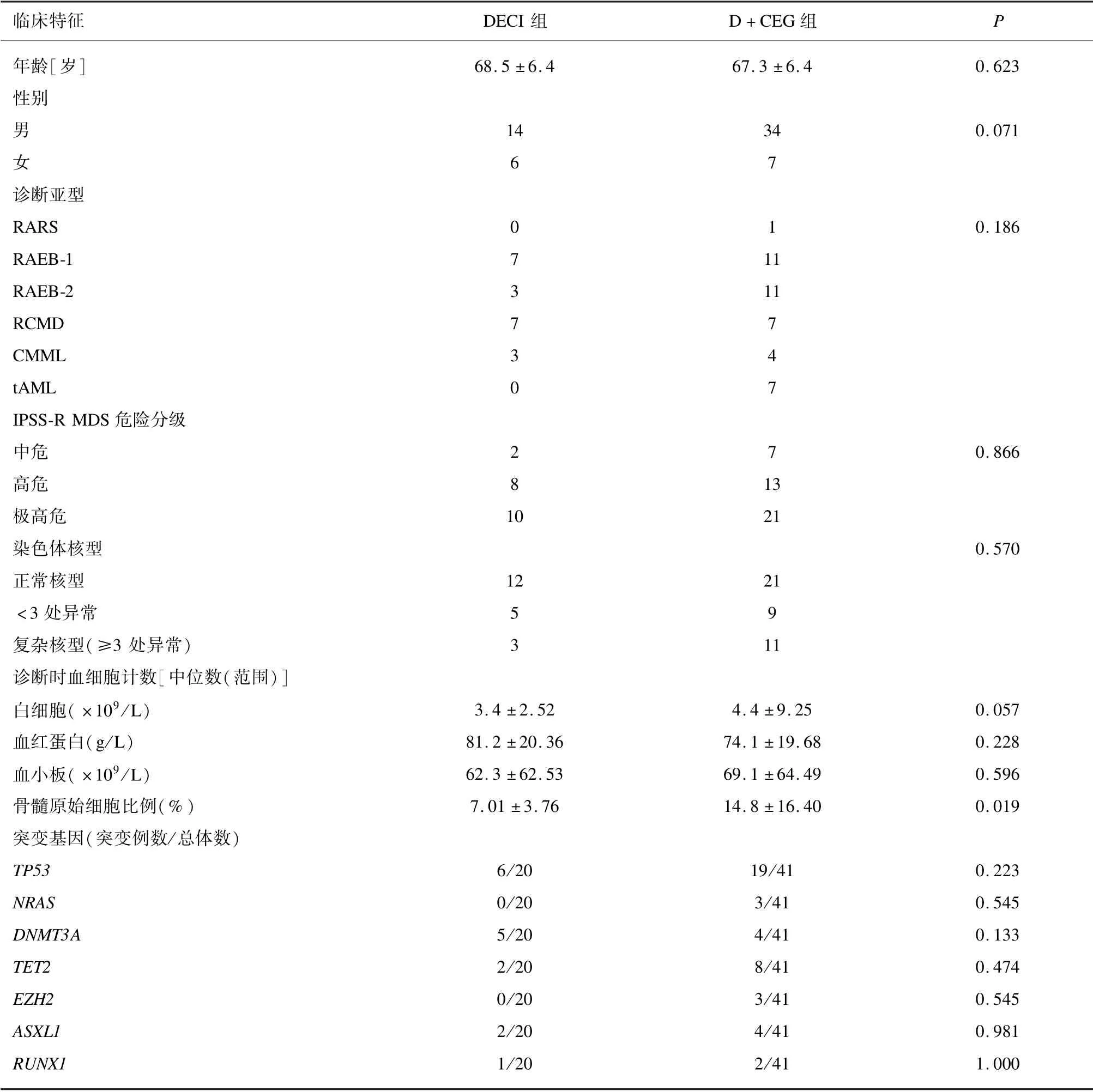
表1 61 例患者临床特征
2.2 疗效
接受地西他滨单药治疗患者有4 例达到CR,占到总体的20.0%,5 例达到CRi,4 例达到HI,总体缓解率(ORR)为45.0%;接受D +CEG 治疗的患者中,21例达到CR,占到总体的51.2%,5 例达到CRi,2 例达到PR,1 例达到HI,总体缓解率(ORR)为68.3%。2 组CR 率(P=0.027)和1年内转化为白血病率(P=0.006)差异均有统计学意义(见表2)。
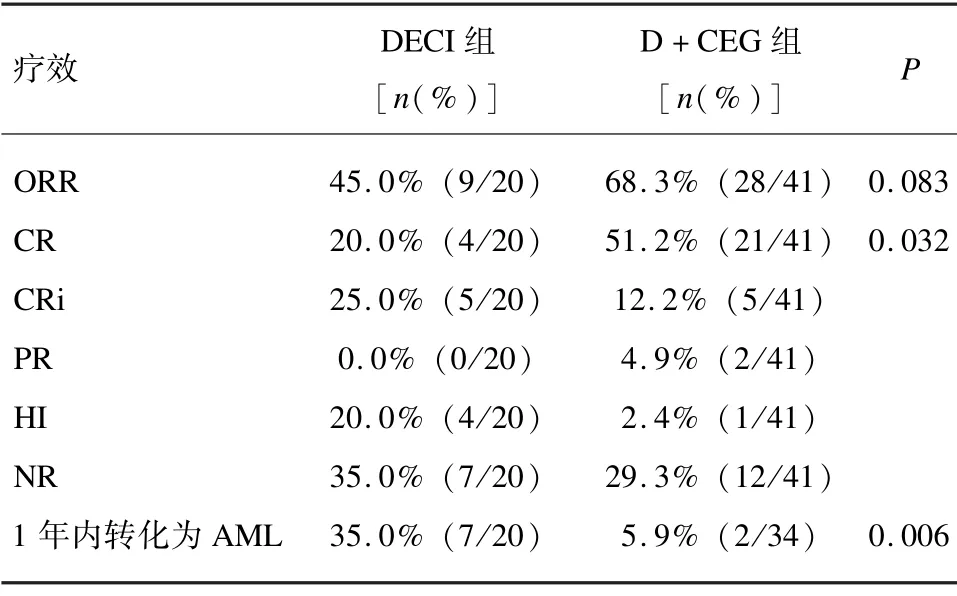
表2 总体患者疗效
2.3 生存时间比较
2 组患者随访截至2021年10月1日,中位随访时间26 个月(3 ~94 个月)。地西他滨单药组中,3例(15.0%)在随访终点存活,4 例(25.0%)出现疾病进展,中位OS 为18.0月;中位PFS 为10.0月。D +CEG 治疗组中,13 例(31.0%)在随访终点存活,10 例(23.8%)出现了疾病进展,中位OS 为18.0月,中位PFS 为15.0月。2 组患者中位OS(P=0.577)和中位PFS(P=0.501)无统计学差异(见表3)。生存曲线如图1a、b 所示(OS,P=0.493;PFS,P=0.422)。

表3 总体患者中位OS 及中位PFS 比较
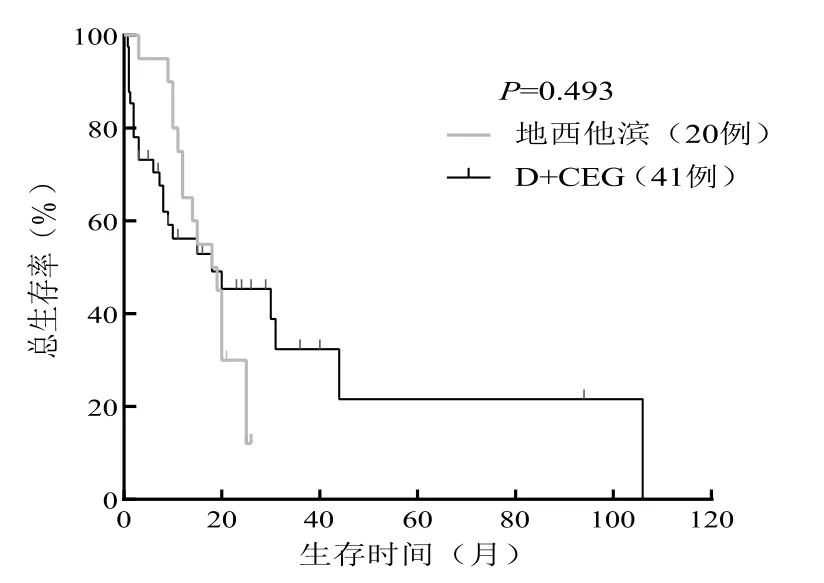
图1 a 总体患者OS 生存曲线
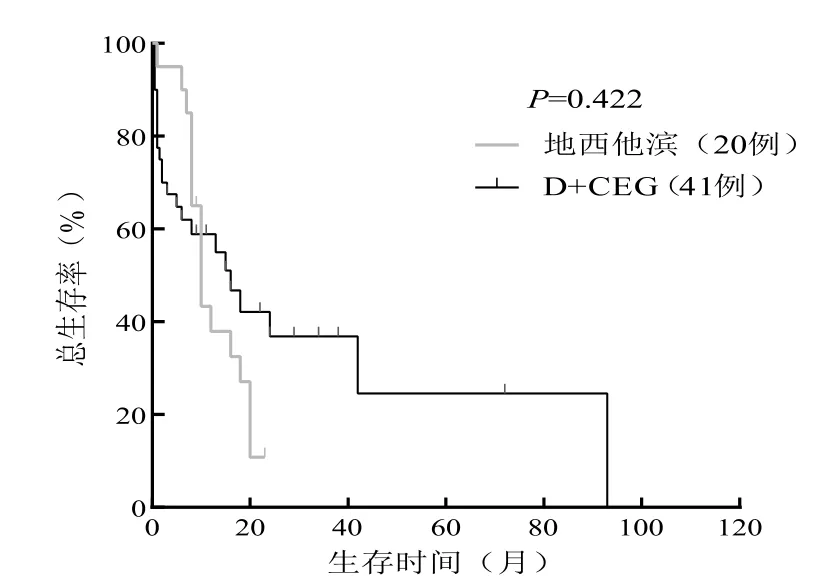
图1 b 总体患者PFS 生存曲线
2.4 亚组疗效及生存分析
分比较2 组中存在TP53基因突变的患者的疗效及预后。地西他滨组20 例患者中6 例TP53基因突变,3 例治疗后达到CR,1年内有2 例转白;D +CEG组41 例患者中19 例存在突变,12 例达到CR,5 例达到CRi,1年内1 人转白。D +CEG 组在总体缓解率(94.7%vs50.0%,P=0.000)上较地西他滨单药更显出优势(见表4)。
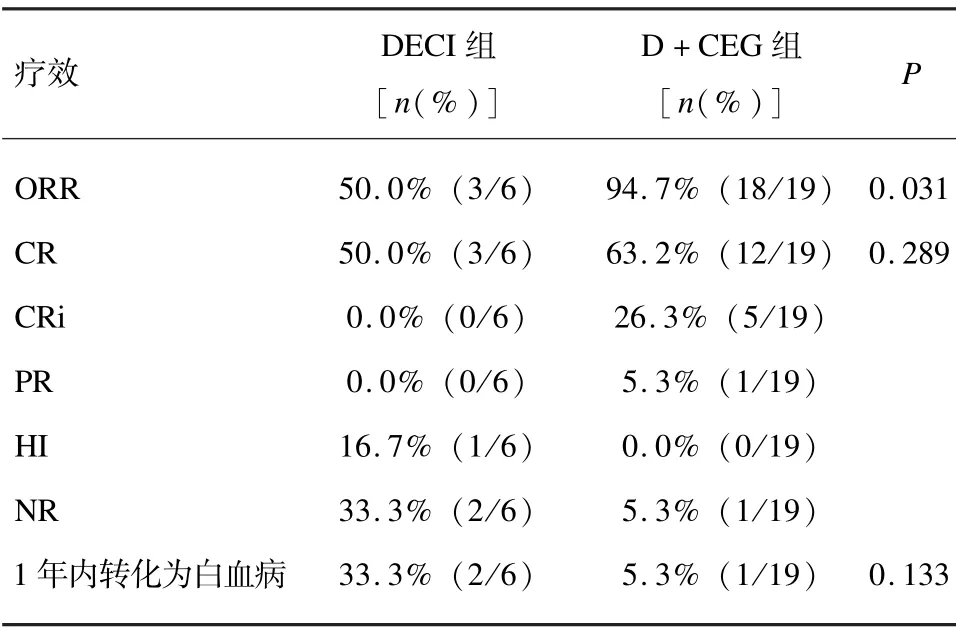
表4 TP53 突变患者疗效
预后方面,接受地西他滨单药治疗的TP53突变患者中位OS 为12.0 个月,中位PFS 为8.0 个月,无人在随访终点存活。接受D +CEG 治疗的患者中位OS 为31.0 个月,中位PFS 为24.0 个月,19 例中有10例在随访终点存活。2 组患者OS 及PFS 生存曲线如图2a、2b 所示,OS (P=0.004)和PFS (P=0.008)差异均有统计学意义,D +CEG 治疗患者在生存时间上优于地西他滨单药组(见表5)。
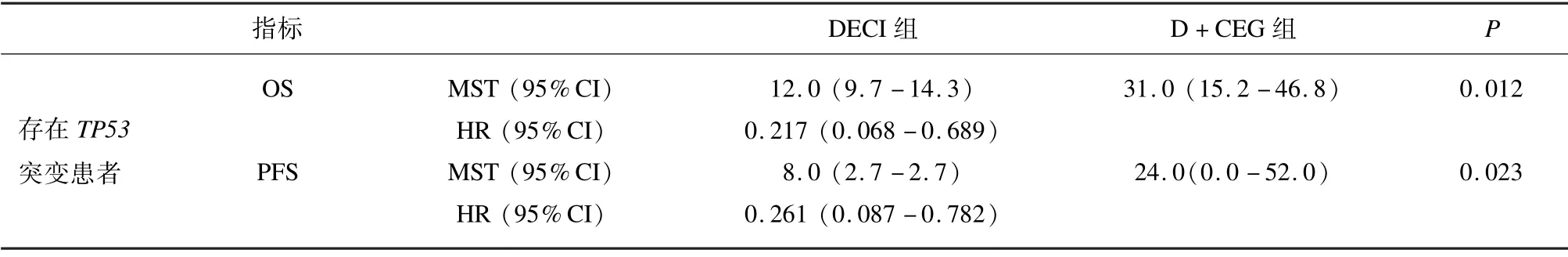
表5 TP53 突变患者中位OS 及中位PFS 比较
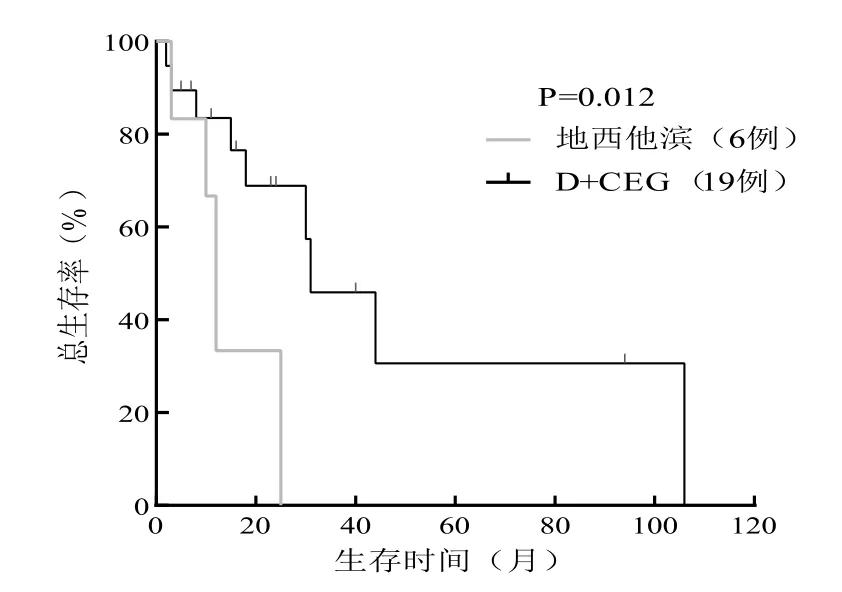
图2 a TP53 突变患者OS 生存曲线

图2 b TP53 突变患者PFS 生存曲线
2.5 影响患者生存的单因素及多因素分析
本研究组相继纳入性别、年龄、病理分型、IPSS⁃R评分、初治血液学指标、染色体核型及多个髓系基因突变情况等变量进行影响OS 和PFS 的单因素分析。年龄≥70 岁(OS,P=0.026;PFS,P=0.046)、TP53基因突变(OS,P=0.003; PFS,P=0.007)和达到PR及以上缓解(OS,P=0.000; PFS,P=0.000)对患者生存时间有改善作用。在多因素分析中,取得PR 及以上缓解对生存时间延长的影响有统计学意义(见表6)。
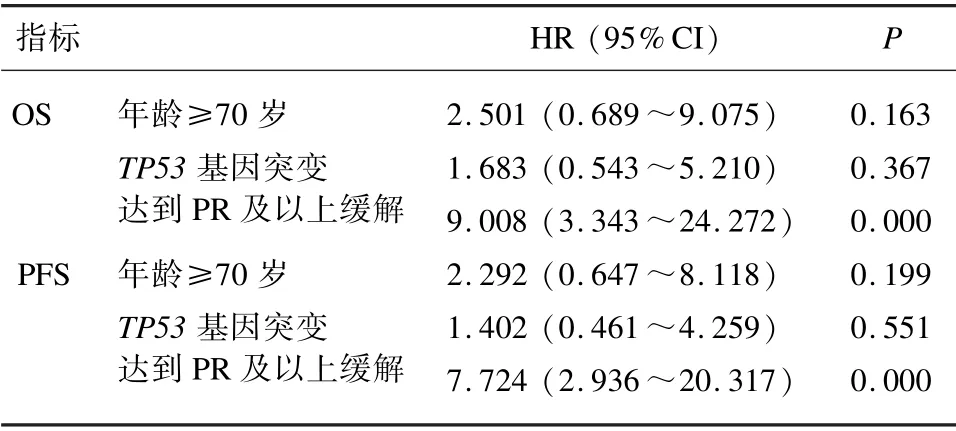
表6 D +CEG 组内多因素分析
2.6 不良反应和治疗相关死亡评价
地西他滨单药组中65%的患者用药后发生Ⅲ级以上骨髓抑制,40%患者抑制期间出现了感染。这两项数据在联合用药组中均为85.4%,两组患者的骨髓抑制期间感染发生率有统计学差异(P=0.000)。两组患者均接受了不同程度的输血支持和抗生素抗感染治疗。化疗期间患者出现皮疹、静脉血栓、腹痛、腹胀等不良反应,在治疗结束后一定时间内均得到缓解,两组无统计学差异(P=0.301)。地西他滨单药与联合治疗的治疗相关死亡率分别为35.0% 和22.0%,主要为死因为严重感染及颅内出血(见表7)。
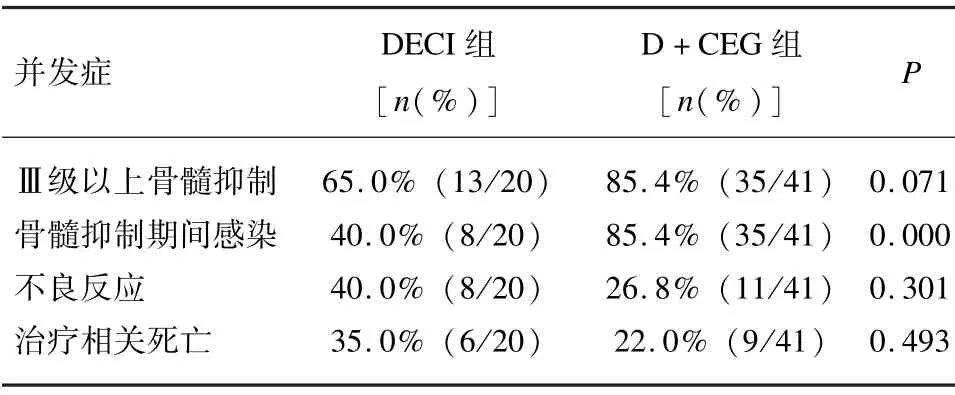
表7 患者不良事件及治疗相关死亡
3 讨论
老年患者因为身体原因,对高强度化疗耐受性差,治疗过程中易发生感染和疾病进展[8]。地西他滨能够抑制肿瘤细胞DNA 甲基化,使异常沉默基因重新激活和表达[9],被广泛用于治疗/MDS/和tAML。在一项欧洲多中心开展的临床三期试验中,不适合强化化疗的患者分别接受低剂量地西他滨和最佳支持治疗(BSC),前者PFS 较后者延长(6.6月vs3.0月,P=0.004)[10]。在另1 篇研究中,地西他滨治疗MDS转化为AML 患者的PFS 也要优于BSC 组(6.2月vs2.8月,P<0.001)[11]。
先前有研究表明低剂量依托泊苷应用于MDS 及tAML 患者均取得了不同程度缓解,且具有患者耐受性好,毒副作用小等优点[12]。在本研究中,D +CEG化疗方案在疗效上取得优势,经D +CEG 方案治疗患者总体缓解率达68.3%,大多数患者在两个疗程后异常造血得到控制。虽然和单用地西他滨相比,感染发生率更高,但经过抗生素和对症治疗后,大部分患者都平稳度过了骨髓抑制期。
在60 岁及以上人群中TP53基因突变更加常见[13],TP53突变的MDS 患者在接受干细胞移植后,与未突变患者相比,生存期和复发时间更短(P<0.001)[14]。针对TP53突变MDS/AML 患者,目前较为常用的疗法是BCL⁃2 抑制剂维奈克拉+去甲基化药物诱导缓解。DiNardo 等人[15]的研究中,维奈克拉联合阿扎胞苷治疗TP53突变且年龄≥65 岁的老年初治AML 患者CR/CRi 率为47%,中位CR/CRi 持续时间5.6 个月,中位OS 为7.2 个月[16]。本研究中,经D +CEG 治疗的TP53基因突变患者CR +CRi 率达到89.5%,中位OS 达到31 个月(P=0.004),中位PFS达24 个月(P=0.008),D +CEG 方案在TP53基因突变患者中有明显的优势。低浓度依托泊苷已被报道在体外对白血病细胞具有分化诱导作用[13],并且相较于靶向药物,地西他滨和依托泊苷也具有易于获得、经济实惠的特点。据此本组研究结果有望为今后治疗TP53突变的老年髓系血液肿瘤患者提供新思路。
本研究仍然存在一定的不足。作为回顾性研究,实验分组及干预手段无法像前瞻性研究做到随机和严格对照。在两组患者总体生存及无症状生存的比较上,没有体现出明显的差异。并且存在亚组分析纳入样本数较少等问题。本研究理论结果仍需更大样本量的前瞻性研究来进一步验证。
综上所述,与地西他滨单药相比,D +CEG 治疗高龄MDS 及tAML 在诱导患者完全缓解上均取得优势,且具有更低的白血病转化风险。地西他滨联合CEG方案治疗TP53突变患者较地西他滨单药具有更好的疗效和预后。

