海博刀和dual刀在早期食管癌内镜黏膜下剥离术中的安全性和有效性比较
张 妍,何池义,袁鹤鸣,黄 宁
(皖南医学院第一附属医院 弋矶山医院 消化内科,安徽 芜湖 241001)
食管癌是我国常见消化道恶性肿瘤之一,病死率高且发病隐匿,多数患者确诊时已处于中晚期,5年生存率较低[1]。随着我国上消化道内镜检查的普及,病变局限于黏膜层和黏膜下层,不伴淋巴结转移的早期食管癌诊出率逐年升高,合理治疗后5年生存率可达95%[2]。内镜黏膜下剥离术(endoscopic submucosal dissection,ESD)是早期食管癌的有效微创治疗手段,可切除病变范围超过2 cm的肿块[2]。目前用于ESD的刀具包括IT刀、dual刀和海博刀(hybrid knife),它们各自具有不同优缺点,各中心评价不一[3-4]。本研究回顾性分析近年来弋矶山医院应用ESD方法治疗的早期食管癌患者,对比分析应用海博刀和dual刀进行手术的患者相关资料及并发症发生率,为ESD刀具选用提供一定参考。
1 资料和方法
1.1 研究对象 选择2018年1月~2021年10月于我院消化内科住院行ESD治疗的早期食管癌患者。患者的诊断参照《中国早期食管癌筛查及内镜诊治专家共识意见》[5]进行。采用回顾性队列研究,根据ESD术时所用剥离刀具不同,将早期食管癌患者分为海博刀组(n=37)和dual刀组(n=28)。所有患者术前胃镜和活检以及术后病理检查确诊患有早期食管癌,符合ESD手术指征。收集患者年龄、性别、病变部位、病变形态和病灶大小等基本资料。
1.2 研究方法
1.2.1 操作器械 Olympus CV-290内镜系统、GIF-H290Z放大内镜、GIF-260J治疗内镜、Olympus KD-650Q/L dual刀、德国ERBE海博刀系统[包括高频发生器(VIO200D)、水刀(ERBEJET2)和Ⅰ型海博刀]。
1.2.2 术前准备及病灶切除方法 两组患者均经科室讨论后行ESD手术。所有患者均于术前告之并发症及风险,签署手术知情同意书。患者术前禁食8 h,禁饮4 h,手术均在气管插管全麻下进行。术中注意观察血压、二氧化碳饱和度、心电图、脉搏等基本监测。入组手术由我科4名年均ESD手术>100例,操作熟练、技术成熟的高级职称医师完成。
海博刀组:食管病变处通过白光、NBI、卢格氏碘液等多种方式精细检查,确认病灶具体部位及大小,再进行ESD操作。①标记。以海博刀距病变外缘5 mm自肛侧至口侧行强力电凝标记,沿病变全周每间隔2 mm进行,口侧缘行双点位标记以辨识口/肛侧。②黏膜下注射及切开。将500 mL生理盐水和10 mL靛胭脂混合液,于标记点口侧缘进行黏膜下注射,以重力低位始,自口侧至肛侧行海博刀注射结合C型浅切开,注射与切开同步进行,待低位充分切开后再行高位切开。③剥离。环周切开后自高位至低位行病变剥离,剥离过程中及时同步补充黏膜下注射,遇到小血管出血可使用海博刀电凝止血,必要时更换热活检钳,直至病变完整剥离,见图1。

A.海博刀强力电凝标记病灶范围;B.病灶口侧双标记;C.黏膜注射及切开;D.注射及剥离;E.小血管出血时海博刀电凝止血;F.剥离完成后的创面。
dual刀组:术前准备与海博刀组相同,确认病灶部位。操作过程如下。①标记。以dual刀距病变外缘5 mm自肛侧至口侧行强力电凝标记,沿病变全周每间隔2 mm进行,口侧缘行双点位标记以辨识口/肛侧。②黏膜下注射。将250 mL甘油果糖和5 mL靛胭脂混合液,以注射针于标记点肛侧至口侧进行黏膜下注射,先行低位注射,再行高位。③切开。以重力低位始,自口侧至肛侧行dual刀浅切开,待低位充分切开后再行高位切开。④剥离。病变环周切开后自高位至低位行病变剥离,剥离过程中及时以注射针行黏膜下注射以补充水垫,遇到小血管出血可使用dual刀电凝止血,必要时更换热活检钳,直至病变完整剥离。
1.2.3 观察指标 比较两组病例手术操作时间(即从标记病变至病灶完整切除时间)、病灶剥离面积、病变剥离速度、病灶切除效果(整块切除率和完整切除率)和并发症(食管狭窄、肌层损伤、穿孔、术中及术后出血)发生情况。
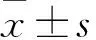
2 结果
2.1 两组患者基本资料比较 两组患者性别、年龄差异均无统计学意义(P>0.05)。两组患者早期食管癌大多位于食管中1/3,以平坦型和凹陷型为多见;两组患者早期食管癌在病变部位、形态和病灶大小上差异均无统计学意义(P>0.05),见表1。

表1 两组患者基本资料比较
2.2 两组患者临床疗效及并发症发生情况比较 两组患者在剥离病变大小、整块切除率及完整切除率方面差异均无统计学意义(P>0.05)。海博刀组患者手术时间较dual刀组缩短(P<0.05),剥离速度加快(P<0.05),见表2。
两组患者总体并发症发生率差异无统计学意义(P>0.05)。海博刀组患者发生2例食管狭窄;dual刀组发生2例食管狭窄,1例肌层损伤和1例术中出血。两组患者均未发生穿孔和术后出血。

表2 海博刀和dual刀组患者临床疗效及并发症发生情况比较
3 讨论
随着生活水平的提高以及国人健康意识的增强,常规胃镜检查率逐年增加,使得早期食管癌的检出成为可能,为临床早期根治提供了基础条件。早期食管癌患者病变局限于黏膜层和黏膜下层,及时进行ESD微创手术可获得良好的治疗效果。ESD可将患者病灶完整切除且不改变解剖结构,具有手术创伤和并发症少、恢复速度快以及医疗费用较低等优点[2]。因此,作为标准微创疗法的ESD用于包括早期食管癌在内的消化道早癌治疗已被临床日益接受并在国内广泛开展。
与内镜下黏膜切除术等内镜治疗方式相比,ESD操作步骤多、难度大,对技术要求更高,临床上需要不断改进手术技巧及手术配合附件从而降低手术难度并获得满意疗效[6]。日本学者Takekoshi等在1994年发明了新型带有陶瓷绝缘头的IT刀,使得ESD操作技术得到突破且应用更加安全,标志着ESD时代的来临[2]。但IT刀前端绝缘帽体积较大,无法深入微小的孔隙,所以刀具的自由度受限。在此基础上开发的dual刀,其刀丝可伸缩,并可在伸出和拉回状态下固定,实现稳固的切开。dual刀微小,可在狭小的空间中进行切割,易于精准控制,但切割负担较小,操作较耗时。海博刀是新型的ESD刀具,具备标记、注射、切割和凝血功能。黏膜切开前,可以通过黏膜下注射生理盐水建构出足够的安全空间,切开时可补充注射减少对肌层的损害。海博刀还能同步进行注射、切开、剥离,其刀头较其他刀头直径更大,有效电凝止血,减少术中器械交换次数[3]。我们科室近年来应用海博刀和dual刀进行了早期食管癌ESD,本文对比分析分别应用两种刀具进行手术的食管早癌患者的相关临床资料及并发症发生率,以期为ESD刀具选用提供参考。
本研究结果表明分别应用海博刀和dual刀的两组患者在剥离病变大小、整块切除率、完整切除率以及总体并发症发生率方面无显著差异,但海博刀组患者病变剥离速度加快,手术时间显著缩短。海博刀和dual刀组均发生2例食管狭窄。出现狭窄的患者其病变范围较大,超过3/4食管环周,与文献报道相一致[7]。仅dual刀组发生1例肌层损伤和1例术中出血,海博刀组患者未发生肌层损伤、术中和术后出血,提示海博刀安全性良好。
综上所述,海博刀和dual刀对早期食管癌患者均有较好的疗效,但海博刀病变剥离速度更快且具有更好的安全性,值得临床推广。

