大叶茜草素抑制肺癌A549、H1299细胞增殖和迁移的机制研究
朱欣颖,胡 云,王耀辉,吴志浩,余方流
(皖南医学院 1.微生物学与免疫学教研室;2.临床医学院;3.医学生物学教研室,安徽 芜湖 241002)
2018年全世界因肺癌死亡人数约180万,是全世界癌症相关死亡的主要原因[1],我国肺癌的发病率居于所有癌症首位[2]。相比传统的手术治疗、放射线治疗和化学药物治疗,天然抗肿瘤靶向药物具有定位精准、针对性强、毒副作用小等优势[3],因此,寻找新的天然药物制剂对人类癌症的治疗是非常必要的。大叶茜草素(mollugin)是一种从茜草中分离出的萘醌类化合物,可用于治疗结肠炎、关节炎症和子宫炎等[4-5]。有研究表明大叶茜草素具有多种生物抗肿瘤活性,但是其抗肿瘤机制尚未完全阐明。上皮-间充质转化(epithelial-mesenchymal transition,EMT)是上皮细胞失去顶端-基底极性和细胞-细胞黏附,向侵袭性间充质细胞转变的过程,在癌症进展和转移中起重要作用。本研究对大叶茜草素抑制肺癌A549、H1299细胞的增殖和迁移作用进行了初步探讨,为大叶茜草素的临床抗肿瘤应用提供理论依据。
1 材料与方法
1.1 材料
1.1.1 细胞系 A549、H1299细胞(人非小细胞肺癌细胞系,ATCC)
1.1.2 主要试剂与仪器 大叶茜草素(成都普思生物科技股份有限公司,批号PS000268);pRL-CMV质粒(Promega,美国);糖原合成酶激酶-3β(GSK-3β)抑制剂(MCE,美国);Snail抗体、Fibronectin抗体、E-cadherin抗体、Vimentin抗体、糖原合成酶激酶-3β(GSK-3β)抗体、磷酸化糖原合成酶激酶-3β(pGSK-3β)抗体、β-catenin抗体(CST,美国)。
1.2 方法
1.2.1 细胞培养 从-80℃冰箱中取出冻存的A549、H1299细胞,复苏后置于37℃、5%CO2的细胞培养箱中培养。待细胞进入对数生长期,密度达到80%~90%时进行传代。
1.2.2 大叶茜草素溶液的配制 精确称取大叶茜草素25 mg,溶于880 μL二甲基亚砜(DMSO)中,配置成0.1 mol/L高浓度原液,使用时稀释至20 mmol/L,根据实验浓度加入培养基中。
1.2.3 MTT实验 将细胞均匀接种于48孔板中,细胞贴壁并生长至80%时,使用双无培养基饥饿过夜,对照组仅加入药物溶剂DMSO,大叶茜草素组加入药物浓度分别为10、20、40、80、160 μmol/L,每样本设置4组副孔,培养24 h后每孔加入5 mg/mL的MTT溶液,4 h后每孔加入300 μL的DMSO,室温下避光震荡15 min至结晶沉淀彻底溶解,使用酶标仪在波长为490 nm处测得其吸光度OD值。细胞增殖率计算公式如下:细胞增殖率=(实验组OD值/对照组OD值)×100%。独立实验重复3次,使用Image J软件进行分析。
1.2.4 细胞划痕实验 将细胞均匀接种于6孔板中,细胞生长至80%~90%时,使用双无培养基饥饿过夜,用200 μL枪头在细胞表面划出一条线,大叶茜草素组加入药物浓度为20、40 μmol/L,在大叶茜草素处理0、24、48 h时用倒置显微镜观察细胞划痕并测量划痕的宽度。独立实验重复3次,使用Image J软件进行分析。
1.2.5 蛋白质印迹实验 将细胞均匀接种于6孔板中,当细胞生长至80%时,使用双无培养基饥饿过夜。大叶茜草素组加入药物浓度为20、40、60 μmol/L,24 h后加入的Laemmli sample buffer裂解液收集细胞,进行SDS聚丙烯酰胺凝胶电泳,转膜75 min,剪出相应条带,牛奶封闭1 h,4℃一抗孵育过夜,次日室温下孵育二抗1 h,在AI6000化学发光成像仪中显影。按上述方法提取蛋白样品3次进行独立实验。使用Image J软件进行分析。
1.2.6 过表达GSK-3β质粒实验 将细胞均匀接种于6孔板中,待细胞生长至70%左右开始转染,对照组中加入pcDNA 3.1,过表达组中加入载体和GSK-3β质粒,转染36 h后饥饿细胞过夜,大叶茜草素组药物浓度为20、40 μmol/L,作用24 h后收集蛋白,进行Western blot实验。重复3次独立实验,使用Image J软件进行分析。
1.2.7 GSK-3β抑制剂恢复实验 将细胞均匀接种于6孔板中,当细胞生长至80%时,使用双无培养基饥饿过夜。将细胞分组为对照组、大叶茜草素组(药物浓度为40 μmol/L)、GSK-3β抑制剂组(药物浓度为40 μmol/L,抑制剂浓度为20 μmol/L)。分别加入40 μmol/L大叶茜草素,置于37℃培养箱中培养,培养18 h后在GSK-3β抑制剂组中加入20 μmol/L的GSK-3β抑制剂,处理6 h后收集细胞蛋白,进行Western blot实验。重复3次独立实验,使用Image J软件进行分析。
2 结果
2.1 大叶茜草素对A549、H1299、HBE细胞增殖的影响 用MTT实验测定大叶茜草素对肺癌细胞A549、H1299、人支气管上皮细胞HBE增殖的影响。不同浓度大叶茜草素(10、20、40、80、160 μmol/L)加入细胞24 h后,与对照组相比,40~160 μmol/L的大叶茜草素可以抑制A549细胞增殖(P<0.05),10~160 μmol/L的大叶茜草素能够抑制H1299细胞增殖(P<0.05);而对HBE细胞的增殖无明显影响(P>0.05),见图1。
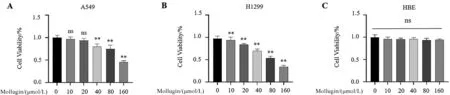
与Mollugin 0 μmol/L相比,*P<0.05,**P<0.01。
2.2 大叶茜草素对A549、H1299细胞迁移的影响 与对照组相比,在A549细胞中,大叶茜草素作用24 h或48 h后,均可明显抑制细胞的迁移能力(P<0.05);在H1299细胞中,药物作用48 h后,细胞的迁移能力受到抑制(P<0.05),见图2。
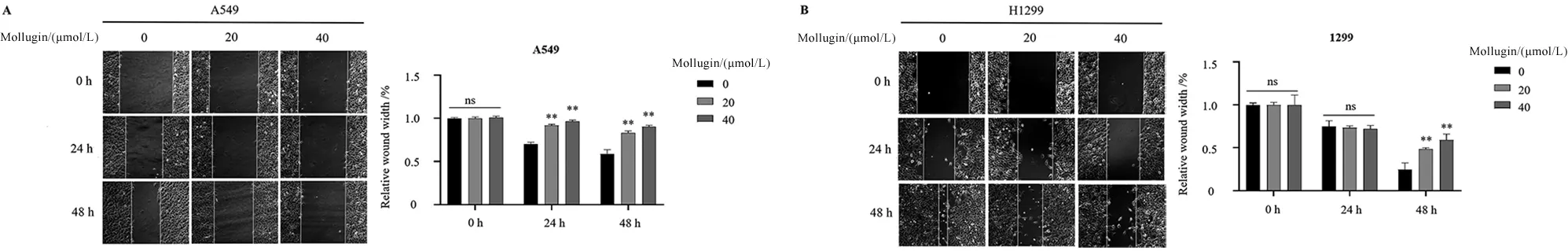
与Mollugin 0 μmol/L相比,*P<0.05,**P<0.01。
2.3 大叶茜草素抑制肺癌A549、H1299细胞EMT相关蛋白的表达 与对照组相比,大叶茜草素组Fibronectin、Vimentin和Snail表达量均下降(P<0.01);而E-cadherin表达量增高(P<0.01),差异均有统计学意义,见图3。

与Mollugin 0 μmol/L相比,*P<0.05,**P<0.01。
2.4 大叶茜草素下调Wnt/β-catenin通路信号蛋白的表达 与对照组相比,大叶茜草素组pGSK-3、β-catenin蛋白表达均下降(P<0.01),差异均有统计学意义,见图4。
2.5 大叶茜草素通过影响Wnt/β-catenin通路抑制肺癌A549、H1299细胞的EMT Western blot结果显示,与对照组相比,过表达质粒后EMT相关蛋白(Fibronectin、Vimentin、Snail)表达下调(P<0.05);E-cadherin表达上调(P<0.05)。为了进一步验证大叶茜草素是否通过GSK-3β影响肺癌细胞的EMT,在GSK-3β抑制剂恢复实验中,将40 μmol/L大叶茜草素和20 μmol/L GSK-3β抑制剂共同作用,Western blot结果显示,加入GSK-3β抑制剂后,pGSK-3β、β-catenin表达均上调(P<0.05),细胞的EMT相关蛋白(Fibronectin、Vimentin、snail)表达上调(P<0.05),E-cadherin表达下调(P<0.05),差异均有统计学意义,见图5。
3 讨论
肺癌是世界上最常见的癌症,每年约有200万例患者,导致近180万人死亡,其发病率和病死率分别占全球总癌症的11.6%和18.4%[1]。肺癌分为小细胞肺癌(small cell lung cancer,SCLC)和非小细胞肺癌(non-small cell lung cancer,NSCLC),所有肺癌患者中约80%~90%是NSCLC。半数以上的肺癌患者在确诊后1年内死亡,5年生存率约为21%[6]。已有研究表明,天然药物衍生的植物化学物质在NSCLC治疗中表现出较小毒副作用,且能有效提高患者的生存率[3],因此寻找新的药物作用靶点和靶向药物成为抗肿瘤药物研发的热点。
大叶茜草素是一种从茜草中分离得到的萘醌类化合物[7],已被证实具有抗炎、抗病毒、抗肿瘤、保护神经等生物活性作用[4-5,8],但其抗肿瘤机制尚未完全阐明。肿瘤转移是晚期癌症的标志,也是治疗上的一大挑战。EMT在伤口愈合、纤维化和癌症进展中起着极为重要的作用[9-11]。EMT的一个标志是上皮标记蛋白E-cadherin的下调,导致细胞黏附的不稳定,E-cadherin在质膜处被裂解后降解,因此β-catenin不能再与E-cadherin相互作用,进而可以进入Wnt/β-catenin信号通路发挥作用[12]。Snail是涉及上皮表型抑制和间充质表型激活的基因表达变化的主要调节因子,Snail结合于E-cadherin启动子上,抑制基因的表达[13],驱动细胞发生EMT。有研究表明,细胞表面Fibronectin可以促进癌症的进展,与增殖、迁移、肿瘤的大小和血管生成等密切相关[14]。发生EMT的肿瘤细胞显示E-cadherin的表达降低,而Fibronectin、N-cadherin、Vimentin和EMT核心转录因子Snail的表达增加,发生EMT期间基因的变化会导致细胞表型发生变化,如细胞形态改变、黏附丧失等[15]。EMT已知与Wnt/β-catenin信号通路相关,Wnt/β-catenin信号通路也被称为典型的Wnt通路,Wnt信号通路激活后,破坏复合物(由GSK-3β、CKIα、Axin和APC构成)被募集到Wnt受体复合物上并失活,促进β-catenin积累并进入细胞核,并作为转录因子激活Snail的转录[16]。β-catenin受到GSK-3β的抑制,其可以被GSK-3β介导的磷酸化灭活进而降解,失去对EMT的调控作用。
本研究结果显示,大叶茜草素可以抑制肺癌A549、H1299细胞的增殖和迁移,并在一定范围内呈剂量依赖性。过表达GSK-3β质粒后加入大叶茜草素,蛋白质免疫印迹结果显示,与对照组相比,纤维粘结蛋白Fibronectin、间充质标记蛋白Vimentin和EMT主要转录因子Snail表达进一步降低,上皮标记蛋白E-cadherin表达进一步增高,这表明A549、H1299细胞的EMT受到了抑制。为了进一步验证大叶茜草素通过Wnt/β-catenin通路参与了EMT进程,在后续实验中,加入了GSK-3β抑制剂,结果显示,Fibronectin、Vimentin、Snail表达上调,E-cadherin表达下调,细胞的EMT得到恢复。
综上所述,本实验探究了大叶茜草素通过抑制Wnt/β-catenin信号通路使肺癌细胞A549、H1299的EMT受阻,从而抑制细胞迁移,为大叶茜草素的临床应用提供理论基础。本实验仍需要动物实验的佐证,有关大叶茜草素的具体分子机制有待后续进一步的探讨,后期将研究大叶茜草素通过何种信号分子从而调控Wnt/β-catenin。

