简易密封盒建立人脐静脉血管内皮细胞缺氧/复氧损伤模型
钟文华,刘 云,温俊威,吴 超,洪 云,王 林,李 曙
(1.皖南医学院 病理生理学教研室,安徽 芜湖 241002;2.皖南医学院第一附属医院 弋矶山医院 超声医学科,安徽 芜湖 241001)
当缺血的组织血液供应恢复,产生大量的自由基等所造成的损伤称为缺血再灌注损伤(ischemical reperfusion injury,IRI)[1-2]。机体中血管内皮细胞是IRI的前沿细胞,体外缺氧/复氧(hypoxia/reoxygenation,H/R)损伤诱导人脐静脉血管内皮细胞(human umbilical rein endothelial cells,HUVECs)损伤模拟体内IRI。本研究拟采用自制的简易密封盒构建缺氧环境,建立HUVECs H/R损伤模型,并探讨该建模方法的可行性与可重复性[3]。
1 材料与方法
1.1 细胞系 HUVECs细胞系,购于上海酶研生物科技有限公司。
1.2 试剂 FPS、DMEM培养基(含1.0、4.5 g/L D-Glucose)购于Gibco公司(美国);蜂蜡购于Solarbio公司(中国);密封盒购于安扣旗舰店(中国);Hoechest 33258试剂、QuickBlockTMWestern封闭液和DCFH-DA试剂盒购于碧云天(中国)。
1.3 仪器 二氧化碳培养箱(THERMO,美国);荧光倒置显微镜(Olympus IX51,日本);全自动酶标仪(瑞士);测氧仪CY-12C(佳长电子科技,中国)。
1.4 H/R模型建立及分组 参照文献[4]HUVECs消化,75%细胞变圆,滴加完全培养基,吹打混匀,种于6孔板内,当细胞长满约80%后,实验组更换低糖无血清培养基,放到自制的密封盒里,再将密封盒放到CO2培养箱里,根据实验要求分别缺氧3、6、9、12 h。缺氧处理结束后,洗净,滴加完全培养基,放于培养箱培养2 h。对照组(Control组)细胞正常培养、换液,不进行其他处理。
本实验缺氧环境使用的是奶粉盒、氧气检测仪共同构建的,奶粉盒本身具有较好的密封性。在盒子的对立侧上下钻孔,用硅胶将输液皮条管道与孔连接紧密,把实验组的6孔板放进奶粉盒内,覆盖一层保鲜膜,扣上盖子,盖子与盒身四周处涂抹蜂蜡,待干。一侧管道充入94%N2、5%CO2、1%O2混合气体,另一侧管道接测氧仪探测自制密封盒内是否达到缺氧,当测氧仪指示<1%,关闭输液管道调节器,再折叠输液管道用镊子夹闭,则自制的密封盒处于无气体对流的状态即缺氧状态。
1.5 观察及测定指标
1.5.1 血管内皮细胞形态学观察 显微镜观察各组的细胞形态及数目改变。
1.5.2 CCK-8法测定细胞活性 HUVECs细胞分组及培养同前,加入CCK-8试剂,放于原培养箱内孵育2 h,酶标仪测定450 nm吸光度(A值)。
1.5.3 Hoechst 33258法观察细胞核形态变化 HUVECs细胞分组及培养同前,加入甲醛和冰醋酸1 mL,固定15 min,洗涤,每孔加Hoechest 33258 1 mL,染色5 min后,荧光显微镜下观察。
1.5.4 DCFH-DA对活性氧(ROS)进行染色 HUVECs细胞分组及培养同前,每个孔加DCFH-DA混合液1 mL,孵育20 min,洗净。荧光显微镜观察。
1.5.5 Western blot检测HIF-1α的表达水平 提取蛋白,电泳、转膜、快速封闭、洗膜,滴加缺氧诱导因子-1α(hypoxia inducible factor-1α,HIF-1α)、β-actin蛋白4℃孵育过夜,滴加二抗溶液常温孵育1 h,曝光。
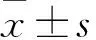
2 结果
2.1 血管内皮细胞形态学变化 Control组细胞贴壁,呈梭形或椭圆形,细胞密度高。而实验组随着缺氧时间的延长,黏附瓶底的细胞减少,细胞密度降低,细胞间隙增大,镜下可见细胞碎片和脱落漂浮的细胞,见图1。

A.Control组;B.3 h/2 h组;C.6 h/2 h组;D.9 h/2 h组;E.12 h/2 h组(白色箭头表示贴壁细胞,黑色箭头表示漂浮细胞);×40;标尺100 μm。
2.2 CCK-8法细胞活性水平检测结果 结果显示,不同H/R时间组细胞活性均低于Control组(P<0.05)。9 h/2 h组和12 h/2 h组细胞活性低于3 h/2 h组和6 h/2 h组(P<0.05),而6 h/2 h组与3 h/2 h组、12 h/2 h组与9 h/2 h组细胞活性比较差异均无统计学意义(P>0.05),见表1。

表1 各组细胞活性
2.3 Hoechst 33258核染色法观察细胞形态变化情况 Control组HUVECs细胞核形态完整,细胞核内染色质均一,各实验组随着缺氧时间的延长,细胞核边集化、碎裂马蹄状逐渐增多,见图2。

A.Control组;B.3 h/2 h组;C.6 h/2 h组;D.9 h/2 h组;E.12 h/2 h组(白色箭头表示损伤细胞核);×40;标尺100 μm。
2.4 ROS含量的变化 A组HUVECs无绿色荧光,B、C、D和E组细胞绿色荧光强度增强。不同H/R时间组ROS均低于Control组(P<0.05)。9 h/2 h组和12 h/2 h组ROS低于3 h/2 h组和6 h/2 h组(P<0.05),而6 h/2 h组与3 h/2 h组、12 h/2 h组与9 h/2 h组ROS比较差异均无统计学意义(P>0.05),见图3、表2。

A.Control组;B.3 h/2 h组;C.6 h/2 h组;D.9 h/2 h组;E.12 h/2 h组;×100;标尺100 μm。
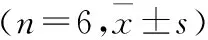
表2 各组血管内皮细胞荧光强度
2.5 HIF-1α蛋白表达水平 不同H/R时间组HIF-1α蛋白表达均高于Control组(P<0.05)。9 h/2 h和12 h/2 h组HIF-1α蛋白表达水平高于3 h/2 h组和6 h/2 h组(P<0.05),而6 h/2 h组与3 h/2 h组、12 h/2 h组与9 h/2 h组HIF-1α蛋白表达比较差异均无统计学意义(P>0.05),见图4、表3。

图4 各组血管内皮细胞HIF-1α蛋白的表达情况

表3 各组血管内皮细胞HIF-1α表达
3 讨论
心梗和脑梗是心脑血管系统疾病中常见且严重的疾病[5],远超于其他疾病而高居榜首[6-7]。临床上最常见的治疗方法是使用药物进行溶栓、抗凝,以尽快恢复血流,但在恢复血流的同时也会带来严重的IRI,有可能导致病情的进一步恶化[8-9],产生不可逆损伤。所以,深入了解和研究IRI机制对心、脑血管疾病患者康复具有重要临床价值。体外诱导细胞H/R可作为探究心、脑血管IRI的模型[10]。
目前国内外H/R模型主要有物理方法和化学方法[11]。最常见的是物理模型三气箱,但是该仪器昂贵、难普及,有的实验室虽然具备该仪器,但后期使用时需要不断充入气体,成本投入很大。化学模型常用的有连二亚硫酸钠[12]、氯化钴[13]、氰化物[14]等,这些药品都是剧毒的,对细胞本身有影响,并且对研究人员身体健康有危害。所以寻求一种简易、低成本、易操作、安全的建模方法是非常有意义和必要的。本研究利用奶粉盒、蜂蜡建立密封盒,然后通入94%N2、5%CO2、1%O2混合气体,测氧仪测的氧浓度<1%,即构建缺氧环境。
现有的模型建立没有统一的标准,主要的衡量水平是引起稳定的细胞损伤,例如细胞结构、细胞凋亡率等[15]。缺氧时间各不同[16-17],本研究中发现缺氧12 h以后,细胞大量变圆,漂浮,易造成较大误差。所以本研究设置缺氧时间组别均在12 h之内。
有研究表明ROS机制是造成H/R损伤的重要标志,DCFH-DA被细胞内产生的ROS氧化生成DCF,呈现绿色荧光。本研究结果表明随着缺氧的延长,绿色的荧光显著增加,说明自制密封盒法创建的缺氧环境可以诱导细胞内释放大量的ROS,模拟体内IRI过程。同时随着缺氧时间的延长,贴壁的细胞减少,CCK-8检测各组细胞活性,实验组细胞活性降低显著。研究表明缺氧环境下,最常见的一种氧敏感的转录因子——HIF-1α就会被激活,能够使细胞适应短暂的缺氧[18]。一定缺氧时间范围内,HIF-1α与缺氧时间呈正比例关系。值得注意的是,组织缺血造成细胞损伤包括氧气的缺乏和营养物质的阻断,所以氧糖剥夺时培养液换成无糖无血清培养基,复氧时换成完全培养基,这样才更贴近临床上IRI状态。
本研究结果证明自制的简易密封盒能够构建有效的细胞H/R模型,为临床研究IRI的机制提供辅助作用。

