DECT 鉴别混合性磨玻璃结节型肺肿瘤亚型的价值
李彩云 袁梅 朱佳佳 王芬 仲艳 俞同福
随着高分辨率薄层CT 在肺癌高危人群筛查中的普及,磨玻璃结节(ground glass nodule,GGN)型肺肿瘤的检出率增高[1]。国际癌症研究机构(International Agency for Research on Cancer,IARC)于2021 年5 月出版了《WHO 胸部肿瘤分类(第5 版)》,将肺肿瘤分为:腺体前驱病变[2]、微浸润腺癌(minimally invasive adenocarcinoma,MIA)及浸润性腺癌(invasive adenocarcinoma,IAC),其中原位腺癌(adenocarcinoma in situ,AIS)被划入腺体前驱病变。依据结节的密度将GGN 划分成了两种类型,若病灶中不存在实性成分为纯磨玻璃结节(pure ground glass nodules,pGGN);病灶中有实性成分为混合性磨玻璃结节(mixed ground glass nodules,mGGN)[3]。
通常,在肺肿瘤中,具有实性成分的磨玻璃结节被认为具有高风险,往往有较高淋巴结转移率和低生存率,但部分实性结节的实性部分除浸润成分外,也有可能代表良性瘢痕或含浸润成分的纤维组织。并且当只有传统的CT 数据可用时,区分混合性磨玻璃结节型肺肿瘤亚型对放射科医生来说始终是一个难题,因为其形态学之间存在较大重叠,若能建立简单易行的定量参数系统判断mGGN 的病理类型,对mGGN 治疗具有指导意义。双能CT(dual energy computed tomography,DECT)是一种新的成像技术,其特点是可通过生成物质分解图像定量分析肺肿瘤的碘/水密度[4],利用碘图准确地对碘含量进行定量检测,从而定量评估病灶血供状况[5]。本研究目的是探寻DECT 生成的碘增强图像定量分析对于区分混合性磨玻璃结节型肺肿瘤亚型是否可提供额外的价值。
资料与方法
1.病例资料
回顾性分析了2021 年2 月~2022 年5 月我院行手术切除的mGGN 型肺肿瘤患者,纳入标准:(1)在术前2 周内行DECT 增强检查;(2)所有病例均经手术病理证实;(3)结节最大径介于6 mm~3 cm。排除标准:(1)临床资料或图像资料不全;(2)病灶图像有伪影或病灶实性成分不明显,测量困难;(3)有化疗或放疗病史。本次研究收纳了134 例患者共获得134 枚GGN,男44 例,女90 例,年龄范围:26~75 岁,中位年龄55 岁;术后病理证实包括AIS 17 枚,MIA 42 枚,IAC 75 枚。依据术后病理差异可分为两组:IAC组(75 例)和AIS/MIA组(59 例)。本系列研究项目为可回顾性的研究,通过医院伦理委员会文件批准,免知情同意书。
2.CT 检查
采用第三代DECT(Siemens Somatom Force CT)Dual-Energy GGO 扫描模式进行DECT 胸部增强扫描。基本扫描数据:探测器准直128×0.6 mm,球管旋转时间0.5 s/r,螺距0.7,矩阵256×256,层厚1 mm,层间距0.8 mm。A、B 球管管电压分别为90 kV、Sn150 kVp,开启自动管电流调制(CARE Dose 4D)技术。选用高压注射器经肘正中静脉团注70~80 ml对比剂碘普罗胺(优维显,370 I mg/ml),流率4 ml/s,跟注50 ml 生理盐水。于对比剂注入后约40 s 后行DECT 动脉期扫描,可得到90 kV、Sn150 kV 及融合能量图像。
3.DECT 定量参数获取
DECT 定量指标的分析测量依然由两名高年资医师在工作站(Syngo.via)上进行,取两者平均值作为最后的结果,CT 图像分析与定量指标测量均依据《胸部CT 肺结节数据标注与质量控制专家共识》的标准[6]。
首先,选用虚拟平扫(virtual non-contrast,VNC)序列得到虚拟平扫图像,在1 mm 层厚肺窗图像(窗宽:1200 HU,窗位:-600 HU)分别记录IAC、AIS、MIA 的实性成分最大径、结节最大径及肿瘤实性比(consolidation-to-tumor ratio,CTR)[7]。CTR被定义为GGN 实性成分最大径与结节最大径的比值[8]。当结节形态不规则时,在三维重组图像上进行分析。因pGGN 不含实性成分,本研究中肿瘤实性比计算实际是计算mGGN 肿瘤实性比。本研究中GGN 与实性成分的阈值限定为-188 HU[9],即若CT 值大于-188 HU 时判定为病灶的实性成分,并且实性成分的最小值要大于1 mm,以便于测量。CT 值大于-188 HU 阈值的判断由两位高年资医师(分别从事胸部影像诊断12 年和20 年)根据虚拟平扫薄层图像上的CT 值及经验判断,实性成分最大径、结节最大径及CTR 的测量取二者的平均值作为最终结果。
选用Lung Analysis 序列,于mGGN 实性部分最大层面上沿病灶边缘手动勾画结节实性部分及结节整体的ROI,并避开病灶内空洞、血管、支气管等,可自动得到mGGN 整体的肿瘤增强强化值、结节碘密度(iodine density,ID)及结节标准化碘密度(normalized iodine density,NID),即结节实性部分碘密度(ID实性)、结节整体的碘密度(ID整体),同时将面积为10 mm2的ROI 放于同侧大动脉管腔中,测量mGGN 实性部分标准化碘密度(NID实性=ID实性/ID主动脉)及结节整体的标准化碘密度(NID整体=ID整体/ID主动脉)。
4.统计学处理
选用SPSS 26.0、MedCalc 15.0 统计软件进行统计学分析。正态分布两组数据的比较采用独立样本t 检验,非正态分布两组数据用Mann-Whitney U 检验,并使用卡方检验或Fisher 确切概率法检验分类变量。用ROC 曲线及AUC 比较不同双能定量指标的诊断效果。选用多变量Logistic 回归计算优势比(odds ratio,OR),建立鉴别IAC组与AIS/MIA组GGN 的预测模型。用Hosmer-Lemeshow 检验评价模型的拟合优度,P>0.05 视为拟合良好。选用ROC 曲线和Z 检验分析比较各定量指标及联合模型的诊断效能。P<0.05 时视为检验诊断指标有统计学意义。
结果
1.一致性检测
为评估观察者间一致性,计算了定量参数的组内相关系数(interclass correlation coefficient,ICC),选用SPSS 26.0 来分析测量结果。两位胸部影像学诊断医师影像参数测量具有良好的观察者间一致性(组内相关系数ICC 为0.743~0.952)。
2.临床表现
在本次研究中IAC组与AIS/MIA组性别(P=0.383)、吸烟史(P=0.499)、结节位置(P=0.058)差异均无统计学意义,IAC组患者年龄均高于AIS/MIA组(P=0.001),IAC组肺结节患者采用肺叶切除术的比例高于AIS/MIA组(P<0.001)(表1)。

表1 IAC组与AIS/MIA组的临床和病理特征
3.结节大小及DECT 定量指标比较
对两组结节的大小及DECT 定量指标进行统计学分析(表2,图1~3)。IAC组mGGN 实性成分最大径、结节最大径及CTR及肿瘤的增强强化值均高于AIS/MIA组(P 值均<0.001),IAC组GGN的ID实性、NID实性均低于AIS/MIA组(P<0.001),ID整体及NID整体在两组之间无显著差异。使用ROC 曲线分析比较mGGN 的实性成分最大径、结节最大径、肿瘤强化值、ID实性、NID实性在鉴别IAC组与AIS/MIA组的诊断效果(表3)。进一步多因素Logistic 回归分析显示,mGGN 的实性成分最大径、结节最大径及肿瘤强化值均是预测mGGN 浸润性的独立危险因子(OR=21.019、35.878、1.132,95%CI:1.957~225.786、5.116~251.596、1.062~1.206,P 值均<0.05)。

表3 AIS/MIA组与IAC组mGGN 存在差异参数的ROC 曲线比较

图1 男,61 岁,浸润性腺癌。a)虚拟CT 平扫轴位示右肺上叶GGN,结节最大直径约1.22 cm,实性成分为0.51 cm,CTR=0.42;b)虚拟CT 平扫冠状位示右肺上叶GGN;c)CT 增强扫描动脉期轴位示结节的增强强化值为8.0 HU,ID实性值为1.1 mg/ml,ID整体值为0.8 mg/ml,ID主动脉值为9.8 mg/ml,NID实性 值为1.1 mg/ml,NID整体值为0.08 mg/ml;d)苏木精和伊红染色(×100 倍)图2 女,32 岁,微浸润腺癌。a)虚拟CT 平扫轴位示右肺上叶GGN,最大直径约1.11 cm,实性成分为0.33 cm,CTR=0.30;b)虚拟CT 平扫冠状位示右肺上叶GGN;c)CT 增强扫描动脉期轴位示结节的增强强化值值为3.9 HU,ID实性值为3.0 mg/ml,ID整体值为1.2 mg/ml,ID主动脉值为13.6 mg/ml,NID实性值为0.22 mg/ml,NID整体值为0.09 mg/ml;d)苏木精和伊红染色(×100 倍)图3 男,42 岁,原位腺癌。a)虚拟CT 平扫轴位示右肺上叶GGN,最大直径约0.79 cm,实性成分为0.25 cm,CTR=0.32;b)虚拟CT 平扫冠状位示右肺上叶GGN;c)CT 增强扫描动脉期轴位示结节的增强强化值为6.1 HU,ID实性值为6.8 mg/ml,ID整体值为1.0 mg/ml,ID主动脉值为12.1 mg/ml,NID实性值为0.56 mg/ml,NID整体值为0.08 mg/ml;d)苏木精和伊红染色(×100 倍)
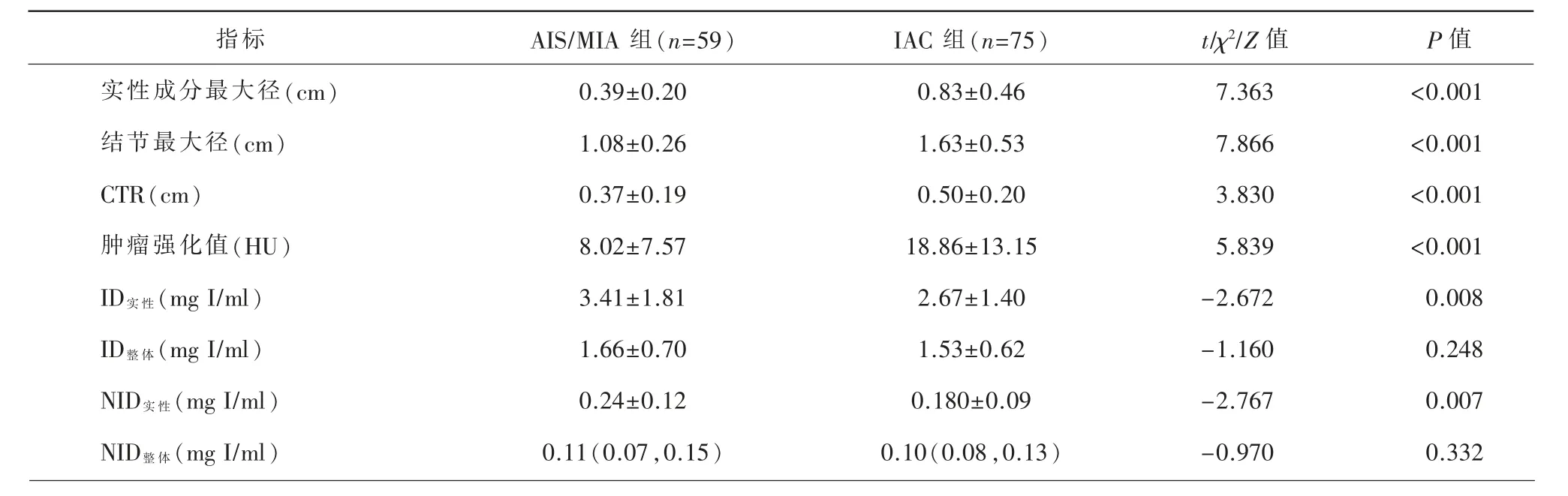
表2 AIS/MIA组与IAC组mGGN 存在差异的定量参数
4.结节大小、双能CT 定量指标及联合模型的诊断效果
依据多因素分析结果得出预测mGGN 浸润性的危险评分:

且Hosmer-Lemeshow 测试表明联合模型拟合良好(P=0.967)。建立mGGN 实性成分最大径、结节最大径及肿瘤的增强强化值联合预测模型的ROC 曲线,该模型具有较高的诊断效能,AUC为0.913(95%CI:0.852~0.955),敏感度和特异度分别为94.9%和77.3%,准确度达81.3%,诊断效能显著高于实性成分最大径、结节最大径和肿瘤增强强化值各定量指标的独立运用(Z=3.195、3.087、3.676,P 值均<0.05)(图4)。

图4 联合预测模型、实性成分最大径、结节最大径及肿瘤的强化值鉴别IAC组和AIS/MIA组的mGGN 浸润性的ROC 曲线比较,联合预测模型的曲线下面积大于后三者
讨 论
AIS 为肺腺癌细胞沿肺泡壁生长,无间质、血管及胸膜浸润,MIA 为肺腺癌内出现小于等于5 mm 浸润灶,IAC 内浸润灶大于5 mm[10]。AIS和MIA 患者完全手术切除的5 年无病生存率几乎达100%,而对于IAC,5 年无病生存率约80%[11],因此将IAC 与AIS/MIA 区分开来非常重要,然而很少有准确可靠的预测模型可以实现。
由于GGN 阶段体积较小,CT 征象较少,传统CT 对其浸润性的评判或鉴别难度很大。双能CT增强利用不同keV 射线的切换扫描方式有助于鉴别不同物质并可定量分析。Wang 等[12]研究表明,CT 征象联合DECT 定量指标建立的预测模型可以提高GGN 型肺腺癌浸润性的预测能力,其研究纳入IAC组肺结节62 枚,浸润前病变-微浸润腺癌组结节25 枚,其中低危结节比例较少,可能存在选择偏倚。Son 等[13]通过双能量CT 结合放射组学鉴别浸润前病变、微浸润腺癌和浸润性腺癌的诊断效能高达0.959,但放射组学复杂,难以普及应用于临床。尽管CT 征象和能谱定量指标各自在鉴别GGN 浸润性有一定的意义,但其敏感度、特异度及准确度普遍不高。本研究初步表明,建立mGGN 结节实性成分、结节最大径及肿瘤的增强强化值联合预测模型可以无创、方便、较为准确地鉴别表现为混合性磨玻璃结节的肺肿瘤,具有良好的临床应用前景和实用价值。
1.基于CT 征象判断GGN 型肺肿瘤亚型的价值
Zhang 等[14]研究表明,结节最大径大于1.61 cm是区分IAC和AIS/MIA组的最佳临界值,其敏感度66.7%,特异度77.5%,准确度为74.5%。本研究显示结节实性成分最大径和结节最大径均为IAC组独立预测因子,OR 值分别为21.019和35.878,敏感度分别为52.0%和56.0%,特异度分别为96.6%和94.9%,准确度分别为70.9%和73.9%。这可能是因为肿瘤细胞早期沿着肺泡壁贴壁生长,随着肿瘤细胞向细胞壁浸润,肿瘤细胞增多、体积增大,组织细胞内的组织增生,CT 上表现为结节实性成分增多,且其二者敏感度有进一步提升的空间,因而需探寻更具价值的预测模型。
2.肿瘤增强程度与微血管生成关系
在CT 上恶性结节增强程度与毛细血管的灌注和通透性增加有关,这是由于微血管密度增加引起的[15]。肿瘤血管新生过程在肿瘤进展和转移中起着至关重要的作用[16]。Yi 等[17]报道,结节的强化程度可反映潜在的微血管密度和肿瘤血管生成。
Li 等[18]研究表明,在同一扫描时期,DECT 增强扫描的碘密度、肿瘤强化值和结节标准化碘密度(NID)都与肺癌的微血管密度呈正相关。且碘密度及肿瘤强化值与肿瘤微血管密度相关性优于NID 与肿瘤的微血管密度的相关性[19]。目前,碘密度、肿瘤强化值和NID 在临床上常用于碘含量的测定。NID 定义为肿瘤中的碘密度与胸主动脉或锁骨下动脉中相同水平的碘密度的比率[20]。Aoki等[21]通过使用Gemstone 光谱成像光谱CT 研究了肺部肿瘤大小与血容量之间的相关性,并表明在较大的肿瘤中碘密度的平均值显着降低。如果肿瘤的血液供应不足,实性部分将变得相对低密度,最终导致肿瘤坏死。
3.双能增强CT 碘定量参数的应用价值
肿瘤细胞早期沿着肺泡壁贴壁生长,不侵犯周围结构,随着肿瘤细胞向细胞壁浸润,肿瘤细胞增多,实性部分含量增加[22]。但混合性磨玻璃结节的实性部分除浸润成分外,仍可能代表良性瘢痕或含有浸润成分的纤维性瘢痕[23],因此放射-病理相关性仍有很大研究空间。Wang 等[12]基于DECT增强扫描60 keV 的单色CT 值大于-434.7 HU 鉴别IAC组和浸润前病变-微浸润腺癌组混合性磨玻璃结节的敏感度和特异度为68.3%和74.5%,AUC 为0.723。本研究显示肿瘤增强强化值在两组间差异有统计学意义,并且是区分IAC组与AIS/MIA组mGGN的独立危险因子,OR值为1.132,其诊断性能良好,AUC 为0.779,肿瘤强化程度仅取决于血管内对比剂的积累,这与供应血管的数量和血流量密切相关,肿瘤强化值可较好的反应肿瘤强化程度且受病变本身密度影响较小,这与Li 等[18]的研究结果一致。
在本研究中,发现从AIS 到MIA 再到浸润性腺癌的增强均匀性逐步降低,但ID整体及NID整体在两组之间无显著差异,可能与腺癌不同组织亚型之间可能存在相似的血管分布有关,与Sun 等[24]的研究结果一致。本研究显示在IAC组与AIS/MIA组两组间ID实性及NID实性均具有统计学差异,但均不能作为IAC组独立预测因子,这可能是由于即使在同一肿瘤中,肿瘤的血管与相同区域的肿瘤组织密度不一定相符。并且NID实性由病变和主动脉的增强程度决定,对于血供不良的病变,NID实性的变化可能更受主动脉碘密度的影响。Zhu等[25]的研究比较了坏死性和非坏死性肺肿瘤之间的碘密度,并显示坏死性肿瘤表现出统计学上显著的低灌注,与本研究结果相似。但Zhang 等[14]研究结果与本研究有所不同,可能因使用的后处理算法不同,其采用能谱CT,依据两物质分解算法;本研究使用DECT和依据三物质分解算法进行量化计算,该种算法更加准确和接近病灶真实碘摄取值。
虽然仅结节最大径、实性成分大小及DECT参数可以为鉴别肺肿瘤提供价值,但单独使用这些指标并不能作为诊断标志物产生令人满意的敏感度、特异度或准确度。在本研究中联合预测模型具有更高的诊断性能,准确度高达81.3%,敏感度及特异度分别为94.9%和77.3%,AUC 值为0.913。因此,该模型提供了一种手段使得放射科医生可以较为准确地诊断肺肿瘤的病理亚型。
本研究尚存在下述局限性:(1)手动勾画ROI可能有主观差异,但是由于自动勾画结节软件的测量常常不够准确,无法用于GGN,因此,在绘制病变边界时尽量仔细,并且手动排除结节内的大血管、支气管壁和空洞等;(2)本研究专注于分析动脉期的DECT 数据测量,而不是静脉期。
综上所述,本研究结果表明,增加DECT 衍生的碘摄取参数可以有效提高术前mGGN 型肺肿瘤浸润性的预测效能。

