ADC 图影像组学预测Luminal B 型乳腺癌新辅助化疗疗效的初步研究
余雅丽 蒋燕妮 王思奇 娄鉴娟 邹启桂 查小明 王聪
基于乳腺癌基因分型概念的提出,乳腺癌治疗变得更加精确和个体化。在乳腺癌所有分子分型中,Luminal B 型最为常见,所占比例约为40%[1]。根据人类表皮生长因子受体2(human epidermal growth factor receptor 2,HER-2)不同状态,Luminal B 型乳腺癌分为HER-2 阴性和HER-2 阳性两个亚组。近年来,新辅助化疗(neoadjuvant chemotherapy,NAC)已成为乳腺癌综合治疗的一个重要组成部分,被广泛用于治疗局部晚期乳腺癌[2],研究表明NAC 在Luminal B 型乳腺癌中的疗效优于内分泌治疗[3]。NAC 的三个主要目标是降低肿瘤的临床分期、提高保乳手术率和体内早期评估药物敏感性。病理完全缓解(pathological complete response,PCR)是指病理上没有检测到残留的浸润性癌细胞,NAC 达到PCR 的患者其总生存期(overall survival,OS)和无病生存期(disease free survival,DFS)显著提高[4,5]。临床实践中发现,Luminal B 型乳腺癌生物学行为存在个体差异,肿瘤内部异质性较强,其对NAC 的敏感性和预后存在显著差异。Haque 等[6]发现Luminal B 型乳腺癌中HER-2阳性亚组PCR 率高于HER-2 阴性亚组。在治疗前识别出疗效不佳的患者具有重要的临床价值。
目前很多关于乳腺癌NAC 后获得PCR 的体外研究无法在化疗前对疗效进行精准地预测,因此,需要一种非侵入性的方法来代替病理早期评估NAC 疗效。放射组学是一种新兴的影像评估方法,与MRI 的传统图像特征分析不同的是,放射组学特征不仅反映了病灶的信号强度、形状、大小和体积,而且还提供了小波变换后的纹理和高阶特征,可对整个肿瘤区域及其周围区域进行影像特征定量评估[7-9]。之前的研究已经证明了放射组学在治疗评估中的可能性和潜力[10]。
MRI 影像组学在Luminal B 型乳腺癌中的应用尚未开展专项报道。本研究拟通过构建Luminal B 型及其亚组基线期全容积ADC 图影像组学预测模型,并联合临床特征,为临床Luminal B 型乳腺癌个体化治疗方案调整及疗效评估提供影像学依据。
资料与方法
1.一般资料
本研究通过了南京医科大学第一附属医院伦理委员会的批准。搜集2016 年1 月~2020 年6 月期间经粗针穿刺活检证实的164 例Luminal B 型浸润性乳腺癌患者进行回顾性研究。纳入标准如下:(1)经粗针穿刺活检证实为Luminal B 浸润性乳腺癌;(2)术前均依据新辅助化疗标准方案(中国抗癌协会乳腺癌诊治指南与规范)完成全部化疗;(3)化疗前均行乳腺3.0 T MRI 检查;(4)术后病理标本均采用Miller-Payne(M-P)病理系统评估。排除标准如下:(1)MRI 图像上表现为非肿块样强化的病灶;(2)妊娠期和哺乳期乳腺癌;(3)末次化疗与手术时间间隔大于2 周;(4)MRI 图像质量不合格。本研究入组流程如图1 所示。
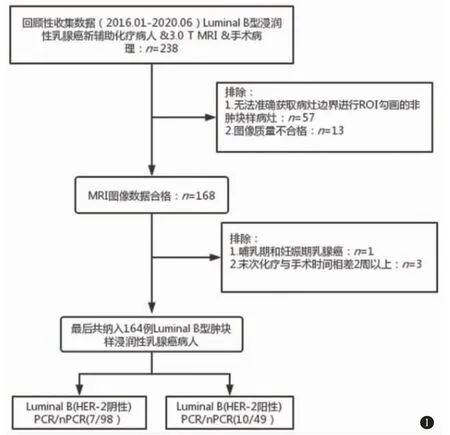
图1 入组人群流程图
收集年龄、临床T 分期、临床N 分期、Ki-67等临床和组织学资料。在影像读片系统上对肿瘤内有无囊变坏死进行评估,测量肿瘤最大径。
2.磁共振参数
所有乳腺MRI 检查均在NAC 前进行,使用3.0 T(Trio Tim,Siemens)MR 机。常规扫描序列包括轴位T2WI-TIRM、轴位DWI、轴位T1WI 动态增强及矢状位T2WI 压脂序列。轴位T2WI-TIRM 序列的扫描参数:TR 5000 ms,TE 61 ms,层厚4 mm,采集矩阵320×320,视野340 mm×340 mm。轴位DWI序列的扫描参数:TR 5200 ms,TE 65 ms,层厚5 mm,采集矩阵110×220,视野323 mm×384 mm,b 值分别取0和800 s/mm2。轴位T1WI 动态增强序列的扫描参数:TR 4.23 ms,TE 1.57 ms,层厚0.9 mm,采集矩阵448×448,视野340 mm×404 mm,翻转角10°。注射对比剂前先扫描蒙片,然后经静脉高压注射器团注对比剂Gd-DTPA,剂量0.1 mmol/kg,注射流率3 ml/s,注射对比剂后快速推注20 ml 生理盐水进行冲管,随后连续不间断扫描5 期,总扫描时长为6 min 23 s。矢状位T2WI 压脂序列的扫描参数:TR 3000 ms,TE 72 ms,层厚4.0 mm,采集矩阵320×320,视野180 mm×214 mm。
3.免疫组化分析及分组标准
每位患者均在NAC 前使用粗针对乳腺肿瘤病灶进行穿刺活检,记录病人术前病理类型、雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)、HER-2和肿瘤增殖细胞核抗原Ki-67 表达情况。ER和PR 采用免疫组织化学法,其阳性标准为细胞核染色的肿瘤细胞数大于等于1%;HER-2 采用免疫组织化学检测或荧光原位杂交法,其阳性标准为HER-2 标记为阳性(+++)或免疫荧光原位杂交检测为HER-2 基因扩增;Ki-67 不超过14%定义为低表达,Ki-67 大于14%定义为高表达。
根据上述分组标准,Luminal B 型乳腺癌根据HER-2 状态不同分为Luminal B(HER-2 阴性)和Luminal B(HER-2 阳性)两个亚组,其中Luminal B(HER-2 阴性)亚组:ER和/或PR 阳性,HER-2 阴性,Ki-67 大于14%;Luminal B(HER-2阳性)亚组:ER和/或PR阳性,HER-2 阳性。
4.化疗方案和病理学分析
164 例患者中:Luminal B(HER-2阳性)乳腺癌(共59 例)43 例行AC-TH(蒽环类、环磷酰胺和赫赛汀,然后序贯紫杉类和赫赛汀)共计8 个疗程、10 例行AC-TH(蒽环类、环磷酰胺然后序贯紫杉类和赫赛汀)共计8 个疗程、6 例行TCH(多西他赛、卡铂和赫赛汀治疗)共计6 个疗程;Luminal B(HER-2 阴性)乳腺癌(共105 例)均行AC-T(蒽环类+环磷酰胺序贯紫杉醇)方案,共计8 个疗程。
根据M-P 病理标本分级将患者分为PCR组和非病理完全缓解组(non-PCR,nPCR组)。M-P 分级5 级者为PCR,PCR 定义为在切除的乳腺标本的任何切片中均未发现浸润性癌细胞,伴或不伴导管原位癌[11]。
5.影像组学分析方法
肿瘤图像三维分割:将高b 值DWI 图像导入ITK-SNAP 软件(Version 3.6.0,https://itk.org/),瘤灶的容积兴趣区(volume of interest,VOI)的标记工作由一名放射科住院医师(2 年乳腺MRI 诊断经验)手工逐层标记获得(未避开明显出血、坏死、钙化、血管区域),病灶边缘参考动态对比增强(dynamic contrast-enhanced,DCE)图像,标记时不超出病灶边缘,略小于肿瘤实际大小,最后由另一名主任医师(10 年以上乳腺MRI 诊断经验)复核确认VOI。多病灶及多中心病例选取最大病灶进行ROI 的勾画,如遇主病灶选择不确定或其他意见分歧时,通过协商最后达成一致。除知晓病例为浸润性癌信息外,其他临床资料均不知悉。直接将在DWI 上逐层勾画的ROI 复制到ADC 图像,并通过ITK-SNAP 软件再次确认VOI(图2)。
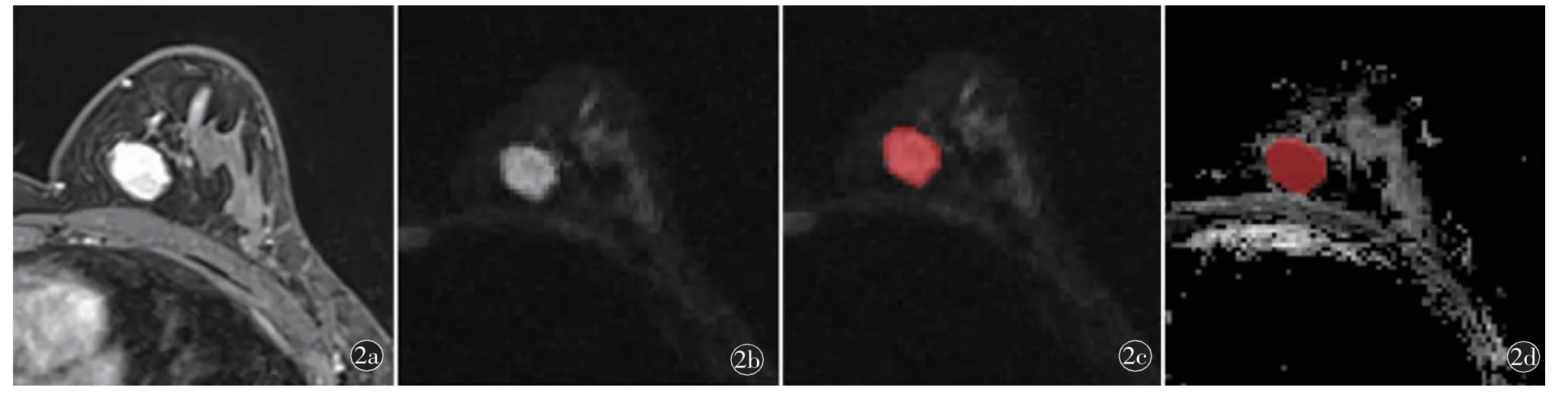
图2 乳腺癌病灶分割示意图。a)动态增强扫描第2 期T1WI 图像,见左乳内侧肿块,边界清楚,强化尚均匀;b)DWI 图像(b=800 s/mm2),该病灶扩散受限;c)利用ITK-SNAP 软件在DWI 图像上沿病灶边缘逐层勾画ROI,肿块边界参照a)动态增强图像;d)将DWI 上逐层勾画的ROI 复制到ADC 图像上
影像组学特征提取:在特征提取之前,对所有ADC 图像进行归一化预处理。采用A.K 软件(Artificial Intelligence Kit V 3.0.0.R,GE 公司)提取ADC 图特征,共提取828 个特征,主要包括形态学参数(VOI 内肿瘤形状及大小)、一阶直方图特征(量化图像的体素强度分布情况)、纹理特征(灰度或体素强度的空间相对位置相关信息,包括灰度共生矩阵、灰度游程矩阵和灰度大小区域矩阵)和小波特征(在肿瘤体积内的不同频率范围内,经小波分解计算得到)。每幅图像经过三个方向的高通或低通滤波,从而得到8 种不同分解的组合:LLH、LHL、HLL、LHH、HHL、HLH、HHH和LLL(H表示高,L 表示低)。
影像组学特征筛选及模型的建立:对于提取到的组学特征,笔者使用基于Python 3.6和Sklearn的开源软件FeAture Explorer(FAE)[12]。首先使用上采样的方式对不均衡的样本进行扩增。通过数据标准化(两种方法)、降维(一种方法)、特征选择(四种方法)和分类(五种方法)四个过程建立影像组学模型(表1)。在对特征矩阵进行降维后,特征选择器选取每个模型的前20 个特征进行建模。为找到最佳模型,测试了特征选择器和分类器的不同组合。当多个模型具有相同或非常相似的预测性能时,为了降低模型的复杂性和非泛化风险,选择包含最少特征的模型。

表1 影像组学模型建模可供选择方法表
临床-影像组学模型:采用单因素分析评估两组间临床病理因素的差异。通过整合临床参数和最佳影像组学模型中的特征参数,建立了临床-放射组学模型。
6.模型效能评估
由于数据量的限制,拆分独立测试集后的训练样本相较于特征数来讲较少,使用10 折交叉验证进行模型评估,选择验证集最高的模型作为最优模型。采用受试者操作特征(receiver operating characteristic,ROC)曲线下面积(area under the curve,AUC)量化模型的诊断性能。用DeLong 测试来观察AUC 模型的差异。
7.其他统计学方法
对PCR组及nPCR组之间的临床因素差异分析,采用SPSS 24.0 软件(IBM,Armonk,NY)进行统计学分析。数值变量以均值±标准差表示,根据数据正态分布检验结果,数值变量资料采用两独立样本t 检验,或Mann-Whitney U 检验,分类变量资料采用卡方检验进行统计分析,P<0.05 认为统计有显著差异。
结果
1.一般资料
本研究共纳入164 例,年龄26~68 岁,平均(49.7±10.1)岁。17 例(10.4%)为PCR,147 例(89.6%)为nPCR。Luminal B(HER-2 阴性)亚组为105 例,PCR 率为6.7%(7/105);Luminal B(HER-2 阳性)亚组为59 例,PCR 率为16.9(10/59)。Luminal B(不区分HER-2 状态)组及Luminal B(HER-2 阳性)亚组两者的PCR组肿瘤囊变坏死率均低于nPCR组,且两者之间差异有统计学意义(P<0.05)。Luminal B(HER-2 阴性)亚组PCR组和nPCR组之间临床特征均无明显统计学意义。PCR组和nPCR组临床特征总结如表2、3。

表2 Luminal B 型肿块样乳腺癌新辅助化疗后PCR组及nPCR组基线期临床特征
2.Luminal B(不区分HER-2 状态)组模型性能
经过对比特征选择方法和分类器后,经十折交叉验证进行模型评估,验证集AUC 最高的模型为最优模型。最终筛选出3 个最优特征参数用于建立影像组学标签(MinMax_PCC_RFE_3_LR)。将肿瘤是否囊变坏死整合最佳影像组学模型中的3个组学特征参数,建立临床-影像组学模型。
在ROC 分析中,影像组学模型在训练集AUC为0.785(95%CI:0.7684~0.8022),验证集AUC 为0.709(95%CI:0.5766-0.8279)。临床-影像组学模型在训练集AUC 为0.847(95%CI:0.8320~0.8621),验证集AUC 为0.793(95%CI:0.6617~0.8996)。在验证集中,DeLong 检验的P 值为0.1827(P>0.05),表明临床-影像组学模型预测效能与影像组学模型无明显差异。临床-影像组学模型的关键特征与系数见表4。
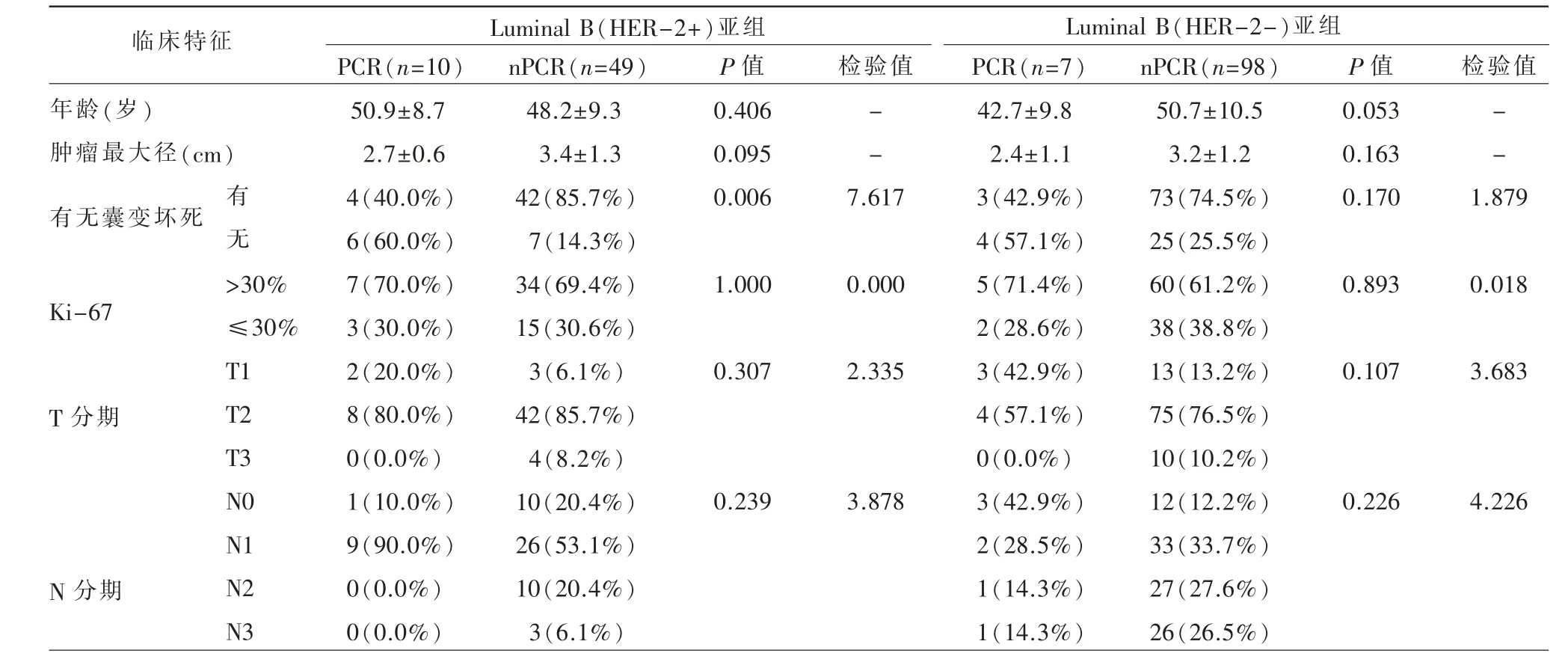
表3 Luminal B 不同亚组肿块样乳腺癌新辅助化疗后PCR组及nPCR组基线期临床特征
3.Luminal B(HER-2 阳性)亚组模型性能
经过对比特征选择方法和分类器后,经十折交叉验证进行模型评估,验证集AUC 最高的模型为最优模型。最终筛选出1 个最优特征参数用于建立影像组学标签(Zscore_PCC_KW_1_SVM)。将肿瘤是否囊变坏死整合最佳影像组学模型中的1个组学特征参数,建立临床-影像组学模型。
在ROC 分析中,影像组学模型在训练集AUC为0.868(95%CI:0.8417~0.8909),验证集AUC 为0.849(95%CI:0.7107~0.9630)。临床-影像组学模型在训练集AUC 为0.924(95%CI:00.9073~0.9406),验证集AUC 为0.890(95%CI:0.7956~0.9689)。在验证集中,DeLong 检验的P 值为0.4671(P>0.05),表明临床-影像组学模型预测效能与影像组学模型无明显差异。临床-影像组学模型的关键特征与系数见表4。
4.LuminalB(HER-2 阴性)亚组模型性能
经过对比特征选择方法和分类器后,经十折交叉验证进行模型评估,验证集AUC 最高的模型为最优模型。最终筛选出6 个最优特征参数用于建立影像组学标签(MinMax_PCC_KW_6_LR)。
在ROC 分析中,影像组学模型在训练集AUC为0.893(95%CI:0.8417~0.8909),验证集AUC 为0.758(95%CI:0.5248~0.9580)。影像组学模型的关键特征与系数见表4。

表4 Luminal B组、Luminal B(HER-2 阳性)和(HER-2 阴性)亚组临床-影像组学模型中的关键特征和特征系数
讨 论
随着对于乳腺癌的认识不断深入,研究者发现不同分子分型的乳腺癌患者在生物学行为、影像学特征和治疗方案等方面存在显著差异[13]。Haque 等[6]的一项关于分子亚型与NAC 反应关系的大规模研究,涉及近14000 患者,该研究证实分子亚型是PCR和OS 的强有力独立预测因子。既往基于乳腺癌影像组学预测NAC 疗效的研究大多不区分分子分型[14],由于未考虑乳腺癌分子分型对NAC 疗效的影响,这些研究的结果差异性较大,模型诊断效能有限且泛化性较差。目前已有一些研究应用影像组学在HER-2 过表达型或三阴性乳腺癌中预测NAC 疗效及预后[15-17],证实进一步区分分子分型后能找到更特异和有价值的预测特征。
Luminal B 型在乳腺癌各分子分型中占比最高,因Ki-67和HER-2 两种指标的不同,HER-2阴性亚组和HER-2 阳性亚组的治疗和预后有着明显差异,故探讨Luminal B 型NAC 后疗效有重要的临床意义。本研究中Luminal B(HER-2 阴性)亚组数量较多,但PCR 率却明显低于Luminal B(HER-2 阳性)亚组(6.7%比16.9%),可能原因是Luminal B(HER-2 阳性)亚组乳腺癌患者在NAC 时联合抗HER-2 靶向治疗进一步提高PCR率[18]。在Luminal B 型及其亚组三种影像组学预测模型中,验证集AUC 由高到低分别为HER-2阳性亚组、HER-2 阴性亚组、不区分HER-2 状态组(0.849>0.758>0.709),进一步区分亚组能更好地预测疗效,反映肿瘤的异质性。一个精准的术前疗效预测模型不仅可以避免化疗无效的患者被过度治疗,减少化疗不良反应和对患者心理的影响,也可及时改变用药方案及选择合适的手术方法。
Luminal B(不区分HER-2 状态组)和Luminal B(HER-2 阳性)亚组在最终临床-影像组学模型中,都纳入了wavelet-HLH_firstorder_Kurtosis(组学参数)和肿瘤是否囊变坏死(临床参数)。经小波变换的Kurtosis(峰度系数)权重占比较大,峰度系数是通过衡量兴趣区内ADC 值的直方图分布,描绘概率分布曲线,峰度越高代表水分子的扩散运动越偏离高斯分布,肿瘤内部结构越复杂[19]。Liu等[20]研究发现,峰度系数在异质性较强的恶性肿瘤内明显增高。峰度系数在Luminal B 型乳腺癌PCR组高于nPCR组,可能提示PCR组的肿瘤内部异质性越强,恶性程度越高。基于既往ADC 值直方图预测乳腺癌NAC 疗效的研究表明[21],峰度系数越高,新辅助化疗疗效越好,与本研究结论相符。上述两组临床参数中肿瘤是否囊变坏死在PCR和nPCR组间有统计学差异,且PCR组的肿瘤囊变坏死率明显低于nPCR组,既往研究也证实MRI 上有明显坏死的肿瘤不易取得PCR[22,23]。但最终纳入该指标参与建立临床-组学模型,预测效能均未见明显提升,可能是由于肿瘤内囊变坏死在ADC 图像上主要体现在ADC 平均值的增加,而笔者提取的组学特征已能更全面具体地反映肿瘤内ADC 值的变化。此外,本研究Luminal B(HER-2 阴性)亚组中,最后参与构建模型的6 个影像组学特征均为高阶特征,Nie 等[24]的一项研究表明,高维特征的使用有助于提高模型的性能,由于其包含了关于癌症的更详细信息,可更好地反映肿瘤的生物学行为,所以在评估PCR 方面敏感度更高。
在训练二分类模型中,当碰到样本类别不均衡的情况下,机器学习方法的性能较差。Wu 等[25]对不平衡数据进行了深入探讨,并比较了三种常见的数据平衡技术对机器学习方法性能的影响,作者建议构建预测模型之前,需要对不平衡的数据进行适当处理。本研究中PCR组与nPCR组样本之间同样存在不平衡问题,两者比例大约为1:5。笔者采用上采样的方法(对分类中少数类的样本进行复制),试图从新的角度解决数据不平衡带来的过拟合问题。上采样作为数据采样的一种,原理简单,在实际运用中容易操作[26,27]。此外,本研究通过十折交叉验证来进一步测试结果的准确性,有效避免学习偏向多数类,从而提高泛化能力。
本研究为初步探讨的结果,仍然存在一定局限性:(1)作为单中心回顾性研究,容易受到潜在选择偏差的影响,患者NAC 化疗方案未能统一标准化;(2)本研究选用验证集最高模型作为最优模型,缺乏独立的测试集进行验证,存在高估模型性能的风险;(3)样本存在明显不均衡问题,随着数据平衡技术的发展,期待一种自适应的方法来给少数类样本分配权重,而不是使用统一的采样权重;(4)病变分割不是自动的,在分割过程中没有评估观察者间的可变性,因此可能受到潜在的人为因素影响;(5)只对ADC 图提取的影像组学特征进行研究,未进行多模态MRI(DCE、T2WI 等多序列)综合诊断模型分析。
综上所述,基线期ADC 图影像组学模型对Luminal B 型乳腺癌新辅助化疗后获得病理完全缓解有一定预测价值,联合临床特征后预测效能有所提高,但无统计学意义;基线期ADC 图影像组学模型在预测Luminal B 型不同亚组乳腺癌新辅助化疗后获得病理完全缓解方面具有一定的价值,Luminal B(HER-2 阳性)亚组预测效能优于Luminal B(HER-2 阴性)亚组,其中Luminal B(HER-2 阳性)亚组进一步联合临床特征后预测效能无明显提升。

