光照对坛紫菜生长和无机碳利用的影响
徐琳杰,李梦雅,许 凯,徐 燕,纪德华,王文磊,陈昌生,谢潮添
(集美大学水产学院,福建 厦门 361021)
0 引言
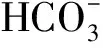
大型海藻主要分布在潮间带,接受的光照强度和波长会随着混合层深度及海水透光性的变化而发生改变。因此,大型海藻必须具备光适应机制,以满足自身对光照的需求。坛紫菜由叶状体(配子体)和丝状体(孢子体)两个世代构成异形世代交替生活史,两个世代在形态及生活环境等方面都差异显著[7]。在自然环境中,丝状体生长在低潮区或潮下带的贝壳等石灰岩基质的内部,叶状体附着在中高潮区的岩礁上生长[8]。这种生活环境的差异表明坛紫菜的两个世代对光强的要求可能不同[9]。为此,研究人员分析了光强对坛紫菜生长的影响[10-12]:在50 μmol·m-2·s-1光强下,坛紫菜叶状体的生长和光合速率都高于丝状体;当光强高于100 μmol·m-2·s-1时,坛紫菜丝状体生长受到抑制;而在550 μmol·m-2·s-1光强下,叶状体生长速率没有受到显著抑制。
坛紫菜生长的基础是光合作用,即以光能为能量来源,吸收无机碳并合成有机物。理论上光与无机碳利用的关系非常紧密,但以往研究并不认可这一点[13]。为此,本研究拟分析坛紫菜叶状体及丝状体在不同光照条件下生长和无机碳利用上的差异。本研究拟通过室内培养实验,分析在10,50,500 μmol·m-2·s-1三种光强下,坛紫菜光合速率、生长、色素、无机碳吸收速率和碳酸酐酶活性等应答光照强度的变化,有利于进一步了解坛紫菜光合生理及无机碳利用的差异。
1 材料与方法
1.1 实验材料
实验材料为坛紫菜Z-61品系,由集美大学坛紫菜团队通过杂交方法选育获得,以自由丝状体形式保存在福建省坛紫菜种质资源库。藻体培养温度为21 ℃,光周期为12 L∶12 D,光照强度为50 μmol·m-2·s-1,培养液每2 d更换一次,以保证生长过程中有充足的营养盐。叶状体培养至15 cm 左右,剪成2~3 cm长的片段。丝状体用茶漏匙收集。藻体用无菌纱布吸干表面水分备用。将藻体分别放入1 L培养瓶中,培养2 d(短期)和7 d(长期),设置10,50,500 μmol·m-2·s-1三种光强,每种处理设置三个生物学重复。
1.2 荧光参数的测定
将藻体放置于21 ℃温度恒定的培养室内,暗处理15 min,随后用Diving-PAM(Walz,Germany)分别测定丝状体和叶状体的光系统 Ⅱ 最大光化学效率Fv/Fm,其饱和脉冲光强为8000 μmol·m-2·s-1。
1.3 净光合速率的测定
采用黑白瓶法测定净光合放氧速率。用纱布轻压丝状体和叶状体去除表面的水分,称量其鲜重(WF)。然后将藻体放入玻璃溶氧瓶中,以不加藻体的作为空白瓶。白瓶置于对应生长光强下培养4 h。测定培养前后的溶解氧浓度。溶解氧测定方法参考国家标准(GB 7489—1987),用G20电位滴定仪(METTLER-TOLEDO)自动检测滴定终点并识别等当点。白瓶和空白瓶的溶解氧差值用于计算净光合速率。
1.4 CA的测定
参照Wilbur[14]的方法测定eCA及总碳酸酐酶(total CA)活性。取适量藻体称量鲜重(WF),并用无碳海水冲洗三遍。无碳海水的配置方法:加入盐酸使新鲜海水培养基的pH值小于3,在冰浴条件下,充氮气 30 min,随后加入Tris试剂使最终质量浓度为6 g·L-1,继续充氮气30 min,然后添加NaOH将海水pH值调整为8.1。将漂洗后的藻体放入5 mL无碳海水中,迅速加入2.5 mL CO2饱和海水,立即计时,记录混合液pH值从8.1降到7.2的时间(T藻样)。同时记录不加藻体的无碳海水pH值下降时间(T空白),并依照公式E(eCA)=(T空白÷T藻样-1)÷WF计算eCA的活性E(eCA)。
对于总碳酸酐酶活性,取适量藻体,用2 mL无CO2海水研磨粉碎,将1 mL匀浆与4 mL无碳海水及2.5 mL CO2饱和海水迅速于烧杯中混合。记录T藻样和T空白,并依照公式E(total CA)=(T空白÷T藻样-1)÷(0.5×WF)计算总碳酸酐酶的活性E(tatal CA)。
1.5 色素含量的测定
用纱布吸掉藻体表面水分,称其鲜重。取3份藻体置于55 ℃烘箱中烘2 h,称其干重(WD)。测定藻体的含水率(WC)。
参照Jensen[15]的方法测定叶绿素a(Chla)含量。将藻体在4 ℃的90%(体积分数)丙酮中研磨粉碎,将组织匀浆放入50 mL(V)磨口瓶中。室温下,遮光萃取24 h,离心后取上清液,用分光光度计测定其在666 nm和730 nm处的吸光度值(A)。Chla质量比(mg/g)的计算公式为:w(Chla)=(A666-A730)×10V÷890×[WF(1-WC)]。
参照高洪峰[16]的方法测定藻胆蛋白含量。将藻体在4 ℃的0.05 mol·L-1PBS(pH=6.8)缓冲液中研磨粉碎。将组织匀浆放入-20 ℃冰箱冷冻,待完全冷冻后取出放置在室温下解冻,反复冻融6次,然后于4 ℃冰箱中过夜。离心后取上清液,用分光光度计测定其在565,615,650,615,730 nm处的吸光度值(A)。每克藻体中藻红蛋白(PE)、藻蓝蛋白(PC)、别藻蓝蛋白(APC)质量比w(mg/g)的计算公式[16]为:
w(PE)=[0.123(A565-A730)-0.068(A615-A730)+0.015(A650-A730)]×V÷[WF(1-WC)],
w(PC)=[0.162(A615-A730)-0.001(A565-A730)-0.098(A650-A730)]×V÷[WF(1-WC)],
w(APC)=[0.171(A650-A730)-0.006(A565-A730)-0.004(A615-A730)]×V÷[WF(1-WC)]。
1.6 光合-无机碳响应曲线(P-C曲线)
配置不同无机碳浓度的海水:往无碳海水中加入NaHCO3,配制无机碳浓度为0,0.05,0.1,0.5,1,2,4,10 mmol·L-1的海水。取适量藻体置于不同无机碳浓度海水中,培养4 h,测量10,50,500 μmol·m-2·s-1三种光照强度下的放氧速率。通过Michaelis-Menten方程v=vmax×[s]/(Km+[s]),求得最大光合速率(vmax)。其中:[s]为无机碳浓度;v为该无机碳浓度下的净光合速率;Km为最大光合速率一半时的无机碳浓度。
1.7 比生长速率
用纱布吸干藻体表面水分,称量培养前后藻体鲜重,分别记为WF0、WFt。计算比生长速率μ的公式为:μ=(lnWFt-lnWF0)÷t,其中t为培养时间(d)。
1.8 数据分析
用t检验、单因素方差分析和双因素方差分析法,分析光强对坛紫菜两个世代的影响和差异。设定显著性差异为P<0.05,极显著差异为P<0.001,所用软件为SPSS statistics 22.0。
2 结果分析
2.1 光强对Fv/Fm的影响
三种光强下,叶状体的Fv/Fm均明显高于丝状体(P<0.05,见图1)。其中,在10 μmol·m-2·s-1光强下,差异极显著(P<0.001)。随着光强的增加,丝状体和叶状体的Fv/Fm都明显下降,即与光强呈负相关。在500 μmol·m-2·s-1光强下,叶状体与丝状体的Fv/Fm降幅都超过了55%。
2.2 光强对光合效率的影响
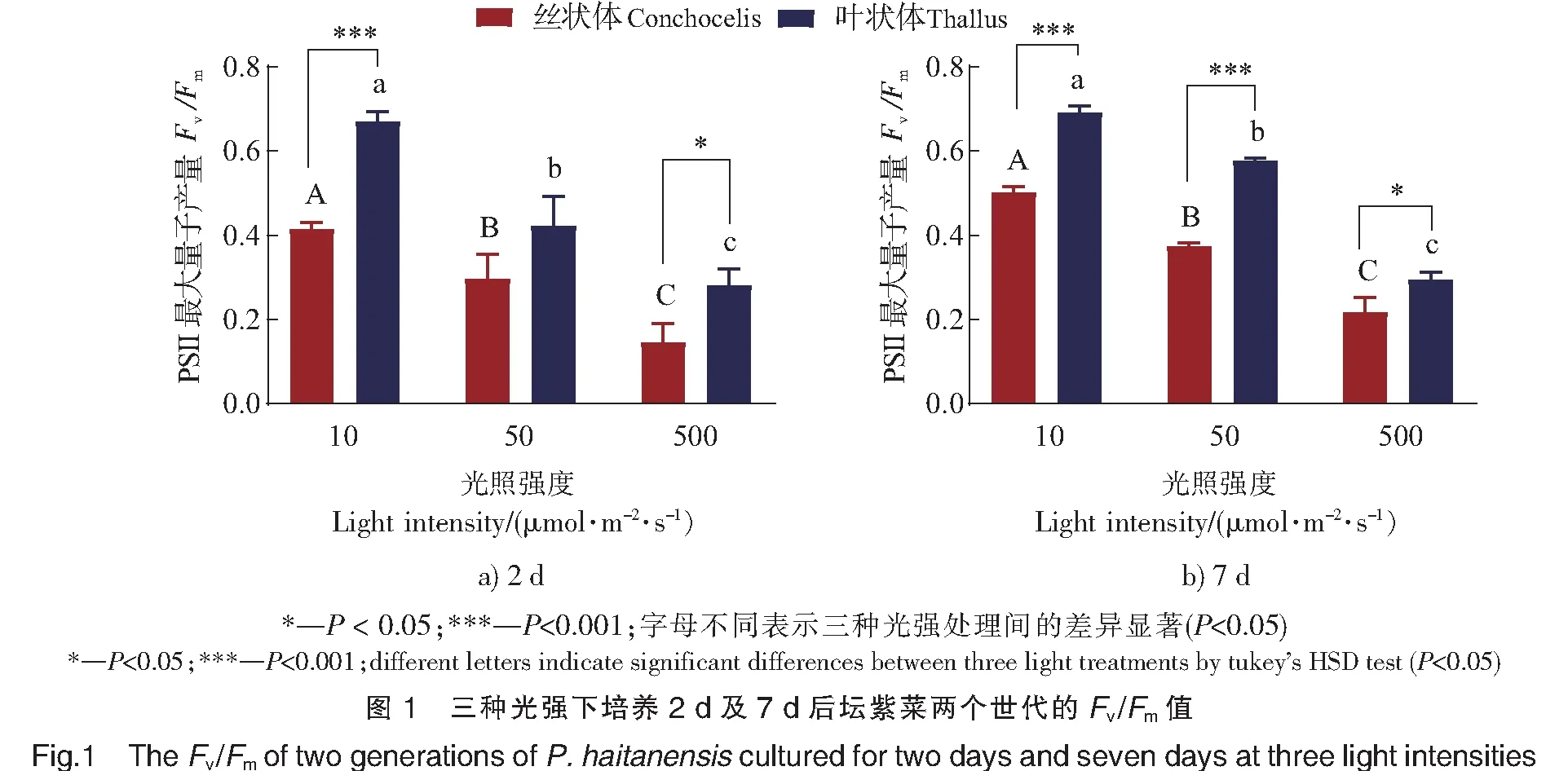
培养时间相同时,光强升高可以增大藻体的净光合速率,并且叶状体比丝状体的增幅更大(见图2)。与10 μmol·m-2·s-1相比,光强提高到500 μmol·m-2·s-1,叶状体和丝状体净光合速率分别增加2.8和7.1以上。无论培养2 d或7 d,在10 μmol·m-2·s-1下,叶状体与丝状体的净光合速率没有明显差异(P>0.05);提高光强后,叶状体净光合速率均显著高于丝状体(P<0.05)。
2.3 光强及无机碳浓度对光合速率的影响
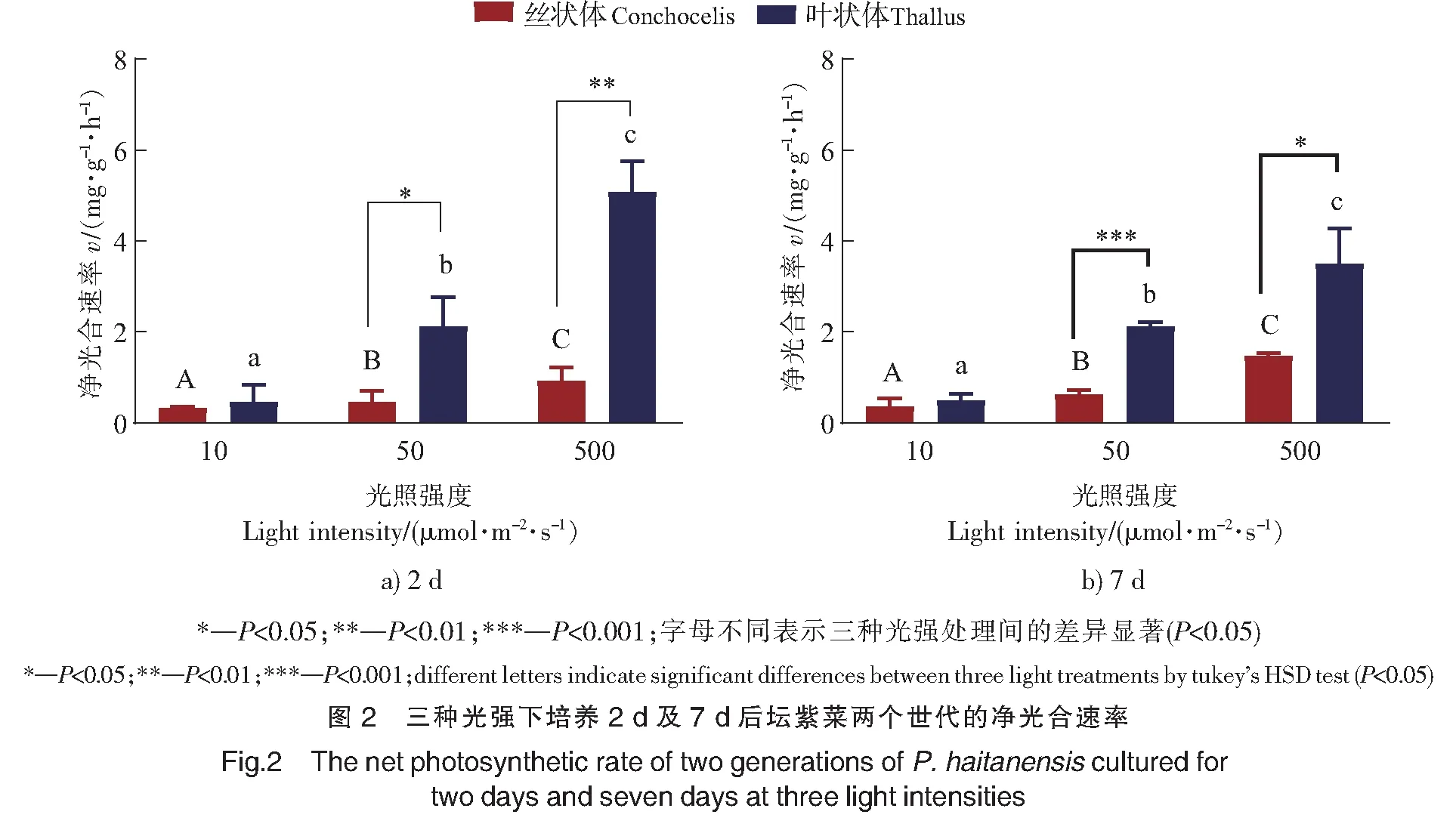
如图3所示,坛紫菜叶状体和丝状体的光合放氧速率都先随无机碳浓度(DIC)的升高而增加,趋近饱和后不再增加。无论培养2 d或7 d,光强为50,500 μmol·m-2·s-1时,叶状体的净光合速率总是极显著高于丝状体(P<0.001)。这说明坛紫菜丝状体的光补偿点比叶状体低,更容易达到饱和。
如表1所示,丝状体和叶状体的最大光合速率(vmax)随光照强度显著增加(P<0.001),说明光照强度可以影响坛紫菜的光合固碳能力。在50 μmol·m-2·s-1及500 μmol·m-2·s-1的光强下,无论培养2 d或7 d,丝状体的vmax无显著差异(P>0.05)。随光强的增加,叶状体vmax逐渐大于丝状体,尤其在500 μmol·m-2·s-1下,叶状体的vmax极显著高于丝状体(P<0.001),达到6倍以上,说明坛紫菜不同世代对无机碳的利用能力存在较大差异。
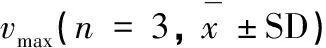
表1 三种光强下坛紫菜的
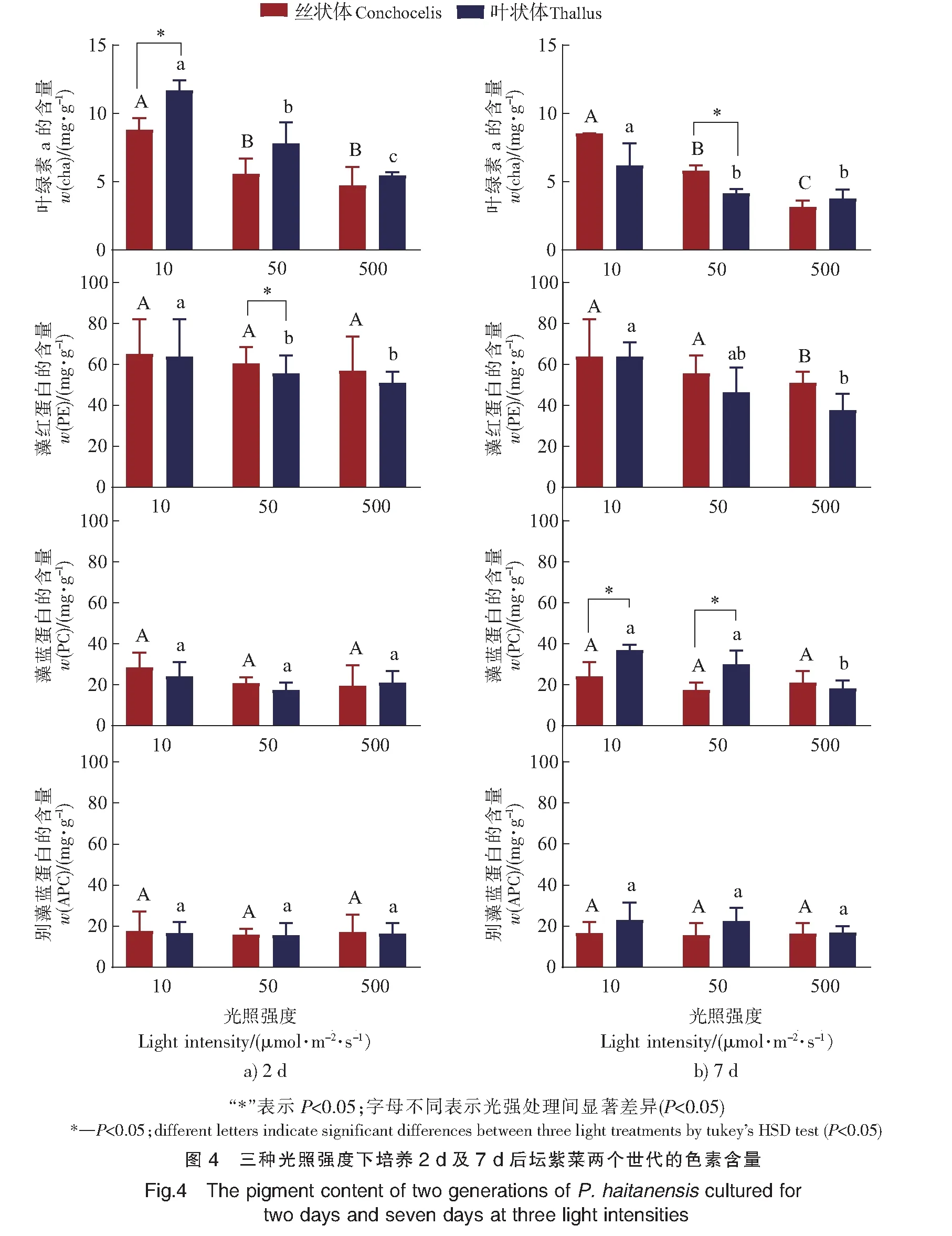
2.4 光强对色素含量的影响
不论培养2 d或7 d,丝状体和叶状体的Chla含量随光照强度的增加而呈极显著降低(P<0.001)。丝状体和叶状体中, PE含量在38~65 mg·g-1范围内,远高于其他色素。叶状体PE含量随光强的增加而降低(P<0.05);但在丝状体中,PE含量仅在培养7 d下与光强呈负相关(P<0.05)。整体而言,光强对PC和APC含量的影响较小(P>0.05)。仅在培养7 d后,叶状体中PC含量与光强呈负相关关系(P<0.05)(见图4)。
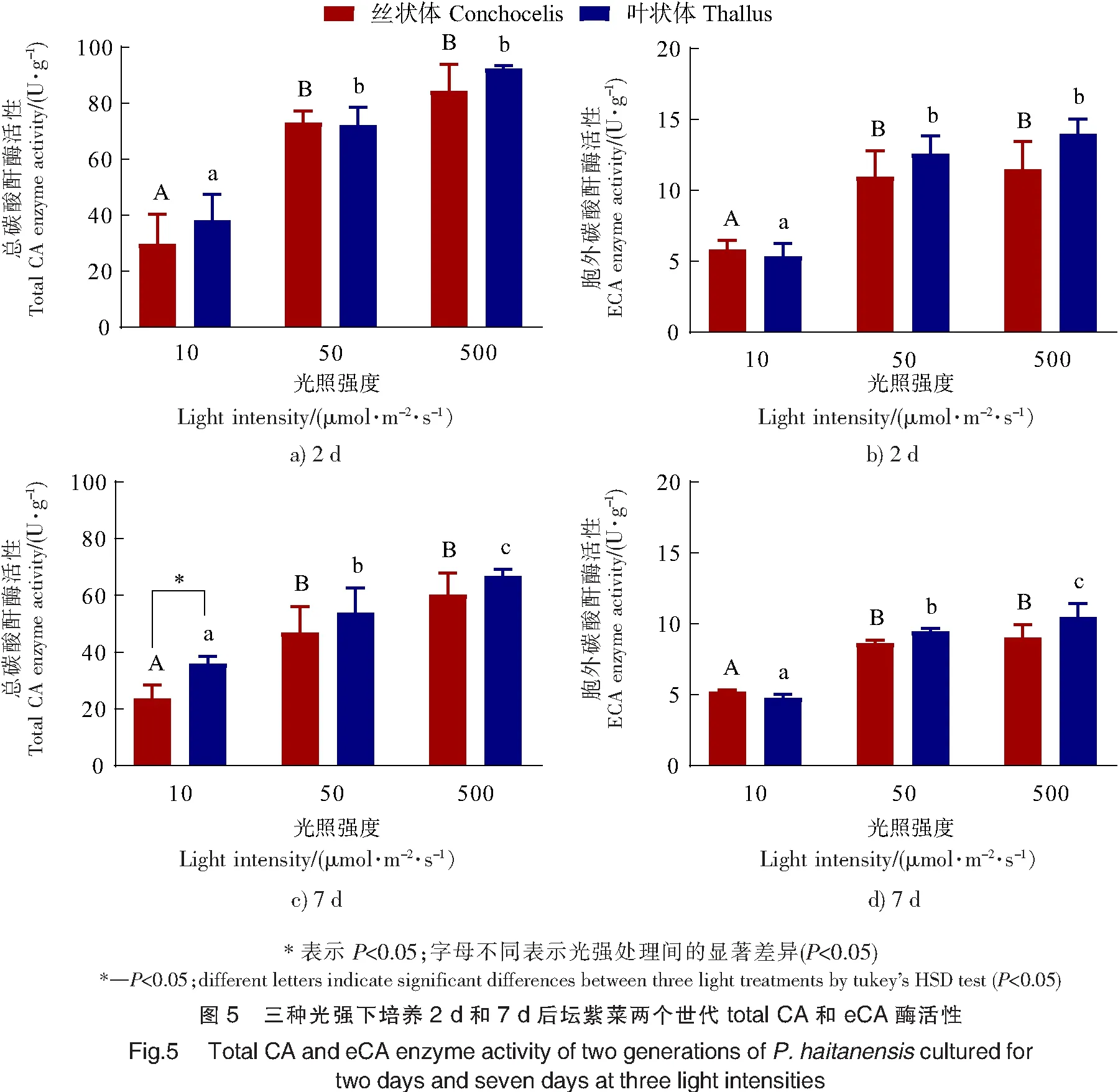
2.5 光强对碳酸酐酶活性的影响
由图5所示,培养2 d或7 d,total CA和eCA活性均与光强呈正相关(P<0.001)。与10 μmol·m-2·s-1相比,在500 μmol·m-2·s-1光强下,叶状体和丝状体的total CA和eCA活性增幅均超过40%。在10 μmol·m-2·s-1光强下培养7 d,total CA存在世代差异(P<0.05),但在其他光照与培养时间下,坛紫菜的total CA和eCA均无显著的世代差异(P>0.05)(见图5)。
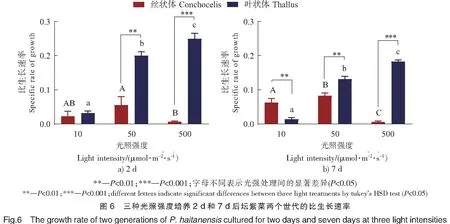
2.6 光强对生长的影响
如图6可见,坛紫菜丝状体和叶状体的生长对光强的响应存在差异。培养2 d或7 d,叶状体生长和光强均呈正相关,相比于10 μmol·m-2·s-1,在500 μmol·m-2·s-1光强下叶状体的生长增加670%以上(P<0.001)。而丝状体截然相反,相比于10 μmol·m-2·s-1,在500 μmol·m-2·s-1光强下培养2 d,丝状体的生长降低了90%(P<0.001)。在50,500 μmol·m-2·s-1光强下培养,坛紫菜的生长存在明显的世代差异(P<0.05),尤其在500 μmol·m-2·s-1光强下培养2 d,叶状体的比生长速率μ比丝状体高了近42倍。然而,在10 μmol·m-2·s-1光强下培养7 d,丝状体μ比叶状体高了近5倍。
3 讨论
3.1 无机碳利用的世代差异对光强的应答
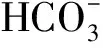
藻体对无机碳的利用会影响光合速率,因此最大光合速率vmax是判断藻类无机碳亲和力的重要参数。本研究结果表明,随着无机碳浓度的提高,坛紫菜丝状体的vmax比叶状体更容易达到峰值,表明叶状体对无机碳利用能力更强(见图3)。此外,叶状体与丝状体的vmax均与光强呈正相关(见表1),这与Takashi[20]在衣藻(Chlamydomonasreinhardtii)中的研究结果相一致,这表明光强可以影响CCM。净光合速率是碳捕获能力的最终体现。本研究中,相比于光强10 μmol·m-2·s-1,坛紫菜在光强500 μmol·m-2·s-1下培养2 d和7 d后,丝状体和叶状体的净光合放氧速率提高至2.8倍和7.1倍(见图2)。这些结果说明光强的增加可以提高无机碳的利用能力,从而对坛紫菜的光合作用产生促进效果。
综上,坛紫菜两个世代的无机碳利用对光强的应答存在明显差异。
3.2 光强对光合作用和生长的影响及世代差异
光是影响大型海藻生长的重要环境因素之一,光强变化会影响藻类的光合作用、色素合成、营养物质积累及生长速率[21]。Fv/Fm是一种准确、灵敏的光响应检测指标,能反映藻体受到光抑制的程度[22]。在强光下,能量过载和对PS Ⅱ的损伤是Fv/Fm降低的主要原因[23]。在本研究中,随着光强的增加,坛紫菜的两个世代Fv/Fm均逐渐降低,说明强光对叶状体和丝状体的光合系统均产生抑制作用(见图1)。高等植物会改变捕光色素的浓度和比例,在强光下减少色素含量以减弱光抑制,而在弱光下提高色素含量以提高捕光效率[23-24]。坛紫菜的捕光色素不仅有叶绿素,还有大分子藻胆蛋白。本研究发现,随着光照增加,坛紫菜Chla和PE含量显著降低,但PC和APC含量没有显著变化(见图4)。这说明坛紫菜的色素对光强的应答比高等植物更复杂。Harb等[25]发现,增加光强,红藻拟鸡毛菜(Pterocladiellacapillacea)的PC含量减少,但Chla和APC含量没有明显变化,而PE含量是先增加后减少。龙须菜(Gracilarialemaneiformis)随光强的增加,PC和Chla含量不变,而PE及APC含量减少[26]。由此可知,坛紫菜、龙须菜和拟鸡毛菜三种红藻对光的响应并不相同。
光合作用是光合生物干物质积累的基础,因此决定了经济海藻的产量[27]。但是不适宜的光强会抑制或减弱光合作用,从而抑制植株的生长。赵振鲁等[28]和Wang等[3]通过对虫黄藻(Symbiodiniumvoratum)、绿藻(Botryococcusbraunii)的研究发现,藻体生长速率随光强增加呈现先增加后降低的趋势。研究[10-12,29]表明,坛紫菜叶状体比丝状体更喜强光,但两个世代来自不同的品系。本研究中,通过比较来自同一品系的叶状体和丝状体,发现:相较于光强50 μmol·m-2·s-1,高光强500 μmol·m-2·s-1下丝状体的生长速率降低了90%,而叶状体则升高了38%;低光强10 μmol·m-2·s-1下,丝状体生长速率下降了25%,叶状体却下降了85%(见图6)。这说明强光对坛紫菜叶状体生长有促进作用,但抑制丝状体生长;坛紫菜丝状体更适应低光,而叶状体更适应高光,两个世代的光合作用和生长,以及对光强的应答存在明显差异。
综上所述,坛紫菜两个世代对光强的应答在无机碳利用、光合作用以及生长上存在差异。坛紫菜的生长速率不完全与光化学反应和固碳效率相一致。因此,在坛紫菜高产新品系的选育与评估时,生长速率才是衡量产量的重要指标,净光合速率只能作为辅助参考。在坛紫菜丝状体育苗、叶状体养殖以及种质保存期间,应选择适宜的光照强度进行培育以满足生产需求。

