异芒果苷通过调节PTEN-PI3K-AKt-mTOR通路抑制恶性胶质瘤的恶性行为*
唐春花,宁志丰,周雄飞,毛开新,胡美纯,吴 喆,王 龙,苏延停,刘星吟
(1.湖北科技学院附属第二医院,湖北 咸宁 437100;2.湖北科技学院基础医学院,湖北 咸宁 437100;3.湖北科技学院国家级全科医学实验教学示范中心,湖北 咸宁 437100)
神经胶质瘤亦称胶质细胞瘤,简称胶质瘤,是发生于神经外胚层的肿瘤,亦称神经外胚层肿瘤或神经上皮肿瘤。肿瘤起源于神经间质细胞,即神经胶质、室管膜、脉络丛上皮和神经实质细胞,即神经元。大多数肿瘤起源于不同类型的神经胶质,但根据组织发生学来源及生物学特征类似,对发生于神经外胚层的各种肿瘤,一般都称为神经胶质瘤。据统计在美国,癌症的发病率为21%,其中神经系统肿瘤占常见儿童癌症的27%[1]比2020统计数据增加1%[1-2],目前胶质瘤治疗以手术切除辅以放化疗为主,但疗效不理想。尽管胶质瘤的治疗方案不断优化,但大多数恶性胶质瘤患者的2年预后仍然很差[3]。近年来随着对中药活性成分的分离鉴定等研究,也发现越来越多具有抗肿瘤活性的活性成分如芒果苷[4]和异芒果苷[5]。异芒果苷是鸢尾科植物的主要活性成分,尚未见关于异芒果苷抑制恶性胶质瘤的报道。本文旨在研究异芒果苷对恶性胶质瘤的影响及可能的作用机制。
1 材料与方法
1.1 实验材料 恶性胶质瘤U251和人脑正常胶质细胞株HEB购于武汉大学中国培养物典藏中心,DMEM高糖培养基、胎牛血清选自Hyclone公司,异芒果苷来源于上海源叶,MTT和Hoechst细胞凋亡检测试剂盒购于碧云天生物技术有限公司,实验所用抗体全部来自ABclonal。
1.2 细胞培养 按常规方法用含10%胎牛血清和100×青霉素及/链霉素双抗的DMEM高糖培养基,在37℃、5% CO2及100%湿度的培养箱中培养,根据细胞的生长状况每2~3 d传代1次,取处于对数生长期的细胞进行实验。
1.3 MTT实验 取对数生长期的U251细胞,调整细胞浓度8×104个/mL后,以每孔100 μL即8 000个细胞接种至96孔板,并使每个孔的细胞均匀分布后,将其放入细胞培养箱中培养5 h待细胞贴壁后,用异芒果苷处理细胞,异芒果苷的给药浓度为0、1、2、4、8、16 μM,每个浓度4个复孔,给药浓度为0的一组为对照组,培养48h,选取4 μM作为给药时间考察的浓度,分别培养24、72、96 h,实验终止时,使用MTT法检测每孔的吸光值(A值),计算肿瘤细胞生长率=(A给药组-A空白对照组)/A对照组×100%。
1.4 平板克隆形成实验 取对数生长期的U251细胞,调整细胞浓度1 000个/mL,以每孔1 mL即1 000个细胞接种至6孔板,并使每个孔的细胞均匀分布后,将其放入细胞培养箱培养24 h待每个低倍镜显微镜(20×)下能观察到生长良好的单个细胞后,用异芒果苷处理细胞,异芒果苷的给药浓度为0、1、2、4、8、16 μM,给药浓度为 0的 1组为对照组。3 d左右换1次细胞培养液,随后在细胞培养箱中静置培养1周时间后终止培养(以对照组生成均匀的肉眼可见的细胞群落为止)。然后用PBS浸洗3遍6孔板中的细胞,接着用预冷的甲醇室温固定细胞20 min,后用0.1%结晶紫染液对细胞染色20 min并用清水冲洗掉多余结晶紫染色液,最后在显微镜下观察并计数含50个以上细胞的克隆数目。然后按公式计算克隆形成率:克隆形成率(%)=克隆数/接种细胞数×100%。
1.5 Transwell小室迁移和侵袭实验 用DMEM高糖无血清培养基按照1∶3稀释matrigel胶包被上室,每孔70 μL,室温孵育4 h。取对数生长期的U251细胞,用无血清培养基重悬细胞后,调整细胞浓度为2×106个/mL,以每孔 100 μL 即 2×105个细胞接种至接种于上室即Transwell小室内。下室即24孔板中加入500 μL含20%FBS和不同浓度的异芒果苷的完全培养基,其中20%FBS作为趋化剂,异芒果苷的给药浓度为0、4、16 μM培养24 h左右,其中给药浓度为0的1组为对照组,培养结束后,去除培养液,用棉签擦去上室的细胞,然后用预冻甲醇固定细胞20 min,随后用PBS清洗细胞3遍,接着用0.1%结晶紫染液对细胞染色20 min并用清水冲洗掉多余结晶紫染色液,室温静置24 h使Transwell小室和细胞干燥,后在显微镜下计数移至微孔膜下层的细胞,每个样本计数5个视野。迁移实验与细胞侵袭实验相同,但不需要在上室包被matrigel胶。
1.6 细胞划痕实验 取对数生长期的U251细胞,调整细胞浓度25×104个/mL,以每孔1 mL即25万个细胞接种至6孔板,并使每个孔的细胞均匀分布后,将其放入细胞培养箱培养48 h待每个孔的细胞愈合率达到90%~100%时,用1 mL的枪头在每孔中间划一道竖线,去掉线上的细胞即可,不要划伤六孔板底部的包被膜。随后用PBS冲洗掉脱落的细胞。最后用异芒果苷处理细胞,异芒果苷的给药浓度为0、4和16 μM每个浓度2个复孔,给药浓度为0的1组为对照组。并在给药培养12 h和24 h时显微镜下观察并记录划痕的愈合情况。
1.7 细胞凋亡实验 取对数生长期的U251细胞,调整细胞浓度6.5×104个/mL后,以每孔100 μL即6 500个细胞接种至96孔板,并使每个孔的细胞均匀分布后,将其放入细胞培养箱培养5 h待细胞贴壁后,用异芒果苷处理细胞,异芒果苷的给药浓度为0、4、16 μM,每个浓度3个复孔,其中给药浓度为0的1组为对照组,培养48 h后,使用Hoechst细胞凋亡检测试剂盒检测细胞的凋亡情况,染色后将不同给药浓度的细胞在荧光显微镜下观察并拍照记录。
1.8 Western blot实验 取对数生长期的U251细胞,调整细胞浓度3.4×106个/mL后,以每培养皿1 mL即340万个细胞接种至培养皿,并使每个培养皿的细胞均匀分布后,将其放入细胞培养箱培养5 h待细胞贴壁后,用异芒果苷处理细胞,异芒果苷的给药浓度为0、4、16 μM,其中给药浓度为0的1组为对照组。培养48 h后,用RIPA细胞裂解液提取每个培养皿的细胞的总蛋白,BCA法检测蛋白浓度后,取等量蛋白上样,通过十二烷基磺酸钠-聚丙烯酰胺凝胶(SDS-PAGE)电泳,以GAPDH作为内参、PTEN、总PI3K、总 AKT、mTOR、磷酸化的 PI3K、磷酸化的 AKt和磷酸化的mTOR作为一抗,恒压100 v电泳。以400 mA电流转膜45 min后,用5%BSA进行室温封闭1 h,一抗稀释液孵育PVDF膜4℃过夜。1×TBST洗膜3次,二抗稀释液室温孵育1 h,显色曝光获得条带灰度值,并进行统计学分析。
1.9 RNA干扰 利用siRNA在线设计工具siDirect 2.0设计3对针对PTEN3’-UTR区的小干扰RNA,siRNA序列如表1。利用Lipofectamine 2000将siRNA和siRNA-control转染HEB细胞,western blot检测沉默效果,以沉默效率达85%以上的siRNA进行下一步实验。

表1 siRNA序列
1.10 统计学方法 应用SPSS 23.0统计学软件进行数据分析处理,随后用GraphPad 5进行统计图绘制。运用t检验或单因素方差分析进行组间比较,以P<0.05判断为差异有统计学意义,所有实验重复3次。
2 实验结果
2.1 异芒果苷抑制U251细胞的增殖 根据MTT的实验结果,计算出异芒果苷对U251的IC50为(4.4±0.25)μM,且随着异芒果苷的浓度增加,U251细胞的抑制率随之升高,呈浓度依赖性(见图1A),通过考察给药 24、48、72、96 h,4 μM 异芒果苷对 U251 的抑制作用,发现与对照组相比,异芒果苷给药24 h,两者的U251细胞生存率无明显差异,但给药48 h两者出现统计学差异(P<0.05),并随着给药时间的延长两者的差异越来越显著,表明异芒果苷对U251的抑制作用呈显著的时间依赖性(见图1B)。且随着药物浓度增加,细胞逐渐变圆(见图1C)。由此可知异芒果苷对恶性胶质瘤细胞U251的抑制效果随着异芒果苷的给药浓度增加和给药时间的延长而增加;即异芒果苷对U251的抑制作用呈浓度和时间依赖性,根据MTT实验结果,transwell迁移和侵袭实验以及细胞划痕实验的给药浓度和时间分别定为0、4、16 μm和24 h(划痕试验增加1个12 h);western blot实验和凋亡实验的给药浓度和时间分别定为0、4、16 μm和48 h。
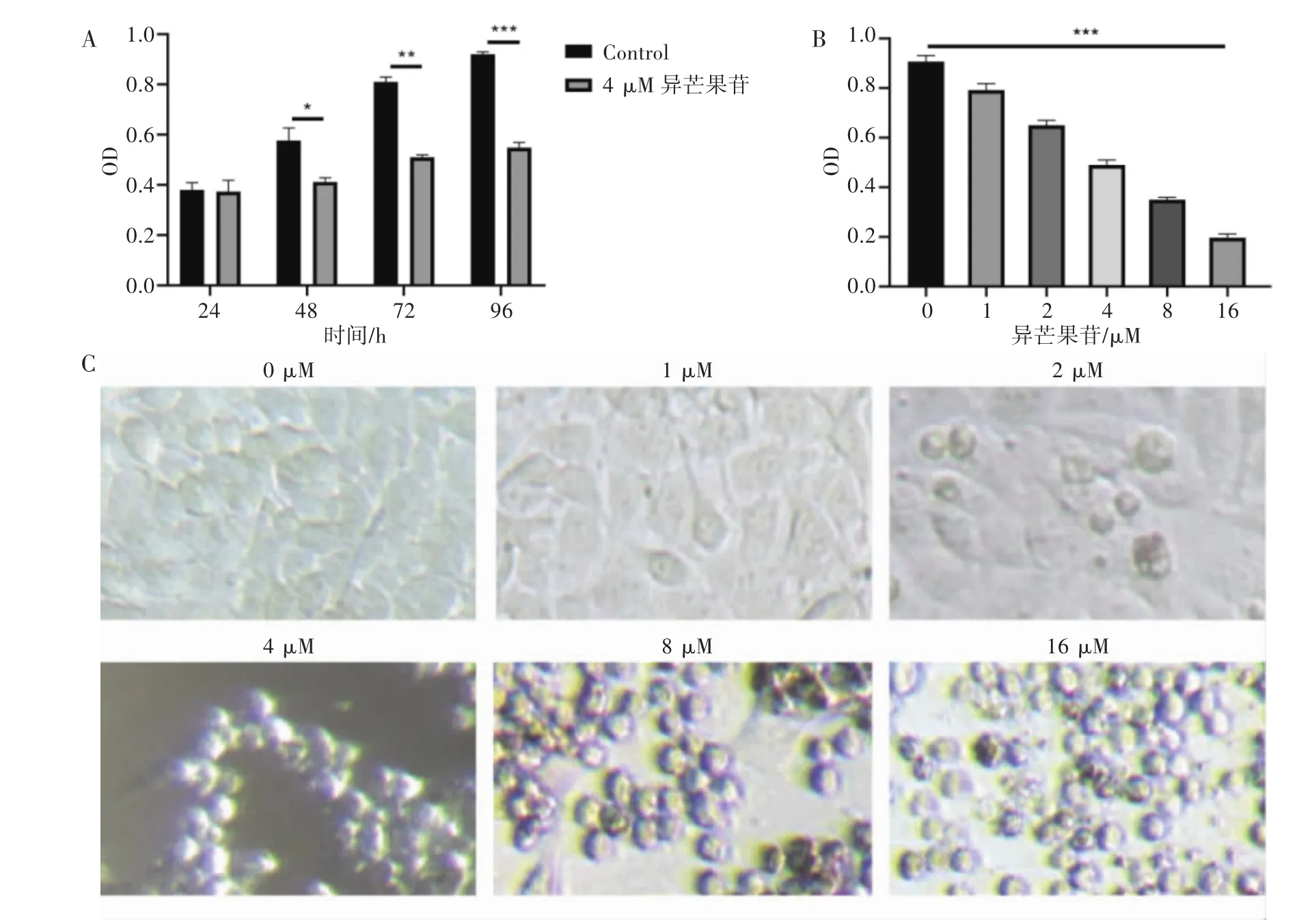
图1 异芒果苷抑制U251细胞的存活和增殖
2.2 异芒果苷抑制U251细胞的平板克隆形成能力根据平板克隆形成实验结果,1 μM异芒果苷就可以初步抑制U251细胞的克隆形成,4 μM异芒果苷就可以抑制50%左右的U251细胞的克隆形成,16 μM异芒果苷处理后U251只能形成20%的克隆群落。故异芒果苷能有效抑制恶性胶质瘤U251细胞的克隆形成,并随着异芒果苷的浓度增加呈现浓度依赖性。(见图2)
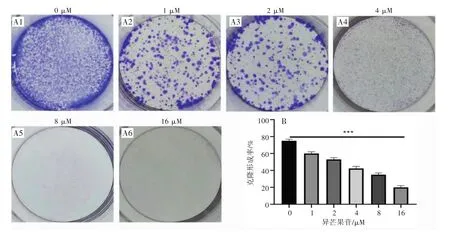
图2 异芒果苷抑制U251细胞的克隆形成
2.3 异芒果苷抑制U251细胞的迁移和侵袭能力根据Transwell小室迁移、侵袭实验结果可知,当异芒果苷的给药浓度为4 μM时,就可以显著抑制U251细胞的纵向迁移和侵袭,16 μM异芒果苷就可以显著抑制50%左右的U251细胞的纵向迁移和侵袭;通过细胞划痕实验可知,当异芒果苷的给药浓度为4 μM,给药时间为12 h时与未给药组比,划痕愈合率就有统计学差异(P<0.05),随着给药浓度和时间的增加划痕愈合率显著降低,表明异芒果苷对U251细胞的横向迁移的抑制呈浓度和时间依赖性。由此可知异芒果苷可以抑制恶性胶质瘤U251细胞的纵向迁移和侵袭能力以及横向迁移能力,且呈浓度和时间依赖性(见图3)。
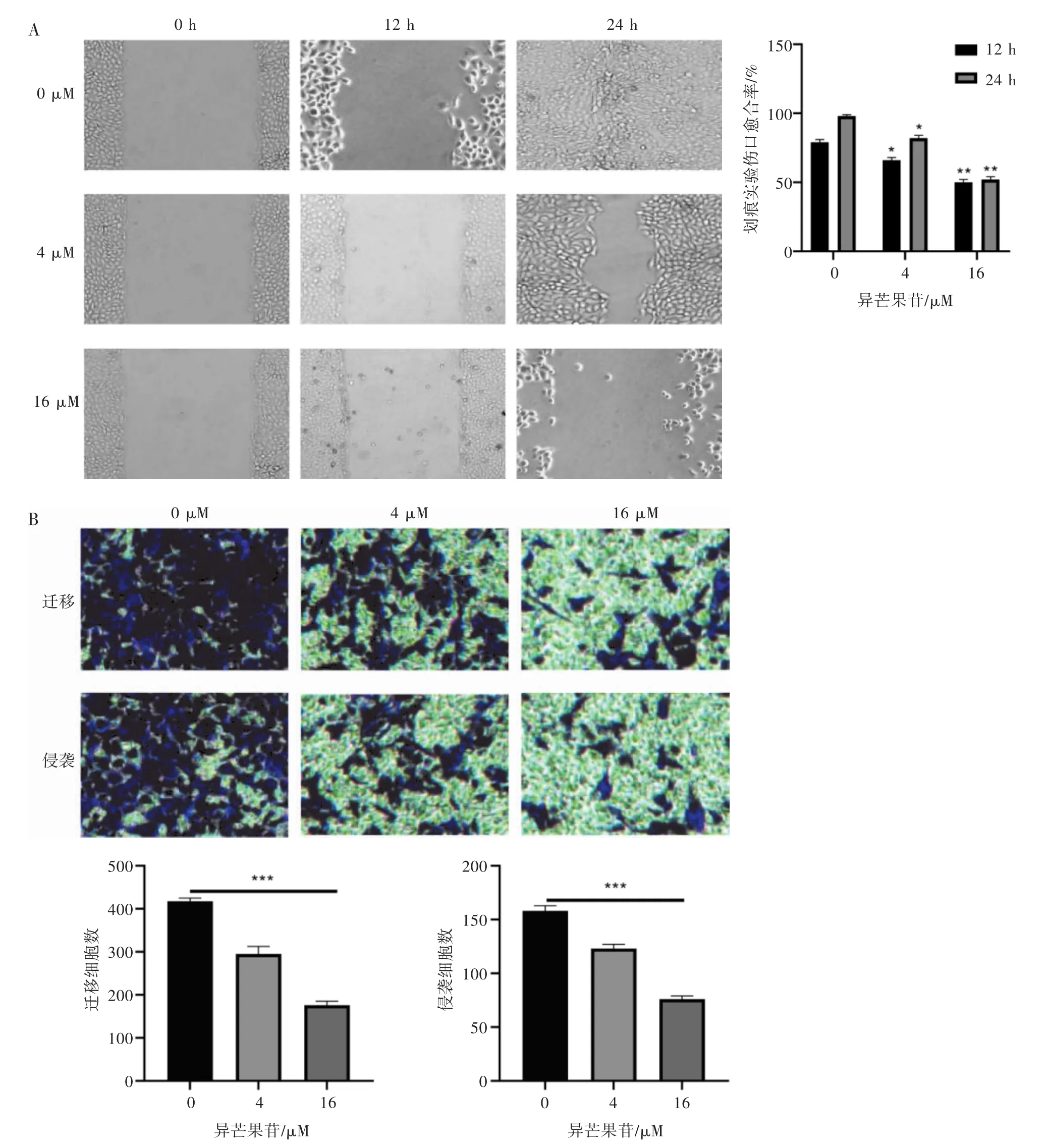
图3 异芒果苷抑制U251细胞的迁移和侵袭
2.4 异芒果苷通过下调PTEN-PI3K-AKt-mTOR抑制U251细胞 通过Western blot实验,我们发现异芒果苷可以浓度依赖性的上调PTEN的表达,进而抑制磷酸化的PI3K、磷酸化的AKt及磷酸化的mTOR的表达量,而不影响总PI3K、总AKt及总mTOR的表达量(见图4A)。我们设计了3对针对PTEN 3’-UTR区的siRNA,发现siRNA-2沉默效率最好,可达85%以上,故选取siRNA-3开展后续实验(见图4B),siRNA沉默PTEN可以部分抵消异芒果苷对U251细胞的抑制作用(见图4C)。故异芒果苷可以通过调控PTEN-PI3K-AKt-mTOR通路对恶性胶质瘤U251产生抑制作用。
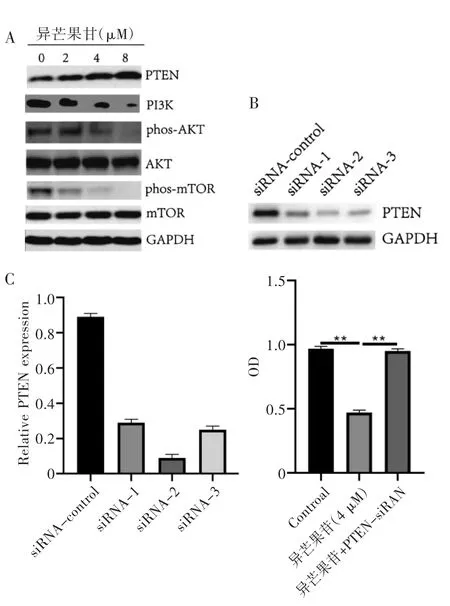
图4 异芒果苷通过调控PTEN-PI3K-AKt-mTOR通路抑制U251
3 讨论
由实验结果可知异芒果苷可以抑制U251细胞的增殖、迁移和侵袭、单克隆形成,经过初步探索其作用机制,我们发现异芒果苷可以诱导U251细胞的凋亡,进而发现其可以通过调控PTEN-PI3K-AKtmTOR通路从而对恶性胶质瘤U251细胞产生抑制作用。并得出结论,异芒果苷可以抑制恶性胶质瘤U251细胞的恶性生物学行为,且作用机制与直接或间接调控PTEN-PI3K-AKt-mTOR通路有关。
异芒果苷是鸢尾科植物的主要活性成分,属于C-葡萄糖苷氧杂蒽酮类化合物[5]。有研究表明其可以作为一种新型强效的血管内皮生长因子受体2激酶抑制剂来抑制乳腺癌的增殖、转移和血管生成[6]。除此之外异芒果苷还可以靶向HMGB1/NLRP3/NF-κB通路来抑制炎症反应[7]。虽然已有报道说明异芒果苷的确有抗肿瘤作用,但其的抗肿瘤谱和具体的作用机制还需进一步研究。而PTEN基因(gene of phosphate and tension homology deleted on chromsome ten,PTEN),又称为 MMAC1(mutated in multiple advanced cancer 1)和 TEP1(TGF-regulated and epithelial cell-enriched phosphatase)。定位于染色体10q23.3,由9个外显子组成,编码由403个氨基酸组成的蛋白质,具有磷酸酯酶的活性[8]。PTEN蛋白可通过拮抗酪氨酸激酶等磷酸化酶的活性而抑制肿瘤的发生发展[9-10]。
有研究发现,在中枢神经肿瘤特别是胶质瘤中普遍存在PTEN基因的突变或缺失[8,11-12]。而PTEN基因的表达可通过特异性地使IP3的第3位磷酸去磷酸化而间接地抑制胰岛素诱导的磷酸肌醇-3激酶(PI3K)的活性,而PI3K是其下游信号通路的主要二级信使,故PI3K的下游信号也因此诱导抑制,包括膜募集和丝氨酸/苏氨酸激酶AKT的激活[13]。而PI3K、AKt和mTOR信号通路,在生理和病理条件下对细胞的生长和生存至关重要,其相互间联系紧密,故在一定程度上可以视为一个单独的、特殊的通路[14],其中PI3K/Akt通路是细胞应激过程中存活的关键调节因子[15],如促进肿瘤细胞的增殖、存活、迁移/侵袭以及上皮间质转变(EMT)、抑制凋亡、自噬和衰老等[16],并对正常组织和肿瘤组织中的血管生成起到重要作用[17-18]。
本实验中我们通过细胞活性实验—MTT实验、克隆形成试验—平板克隆形成实验、迁移和侵袭试验—transwell迁移和侵袭试验以及划痕实验证明异芒果苷可以抑制恶性胶质瘤细胞U251的增殖、克隆形成、迁移和侵袭。通过western blot实验,我们进一步发现异芒果苷可以通过PTEN-PI3K-AKt-mTOR通路发挥抗肿瘤作用。虽然实验中还有一些不足之处,如异芒果苷对PTEN下游的其它通路的作用未进行探索,也未进一步研究异芒果苷对PTEN靶点是直接作用还是间接作用,即未对异芒果苷与PTEN的作用位点或原理进行研究,再者也未开展动物实验对异芒果苷的药效进行进一步确认。但本次实验拓展了异芒果苷的抗肿瘤谱,并提供了其抗肿瘤的一种可能的作用机制,为异芒果苷的未来临床应用或结构改造提供数据支持。

